|
|
Synthèses organiques |
|
|
|
|
|
Les molécules sont réalisées avec le logiciel ACD/ChemSketch |
|
I- La structure
des entités chimiques organiques. |
|
II- L’optimisation d’une synthèse. |
|
III- La stratégie d’une synthèse. 1)- Modification de groupe ou de chaîne.
3)- Réaction de polymérisation. |
|
1)- Réaction chimique : Synthèse du polystyrène.
QCM r
Les synthèses organiques La structure des entités
chimiques organiques L’optimisation d’une
synthèse La stratégie d’une synthèse. |
|
Préparation à l’ECE : Synthèse d’un ester à l’odeur de jasmin 1)- Exercice 04
page 202 : Représenter des formules topologiques. 2)- Exercice 06
page 202 :Reconnaître un groupe caractéristique. 3)- Exercice 08
page 203 : Justifier des noms. 4)- Exercice 10
page 203 : Identifier des isomères de constitution. 5)- Exercice 12
page 203 : Optimiser un rendement et une vitesse. 6)- Exercice 15
page 203 : Compléter des étapes d’une synthèse. 7)- Exercice 16
page 204 : Attribuer une catégorie de réaction. 8)- Exercice 20
page 204 :Représenter un motif. 9)- Exercice 22
page 205 : Quelques réactions de synthèse. 10)- Exercice 25
page 206 : Le nylon 6,6. 11)- DS 01 (30
min) Un ester à l’odeur de rhum : Exercice 32 page 210. 12)- DS 02 : (30
min) Synthèse de la testostérone : exercice 33 page 210. |
|
QCM r
Les synthèses
organiques La structure des
entités chimiques organiques L’optimisation d’une
synthèse La stratégie d’une synthèse.
|
I- La structure des entités chimiques organiques.
►
Les différentes structures de l'atome de carbone
-
Configuration électronique de l’atome
de carbone : 1s1
2s2
2p2
-
Il possède 4 électrons sur sa couche
électronique de valence (2s2
2p2)
-
Il peut mettre en commun 4 électrons
pour acquérir une configuration de valence en octet.
-
L’atome de carbone est tétravalent.
-
Le carbone tétragonal
: 
-
Il échange 4 liaisons simples avec 4
atomes ou groupe d'atomes distincts.
-
Il possède 4 voisins.
-
Le carbone trigonal :
-
Il échange 2 liaisons simples et une
double liaison.
-
Il possède 3 voisins.
-
Il se trouve au centre d'un triangle
dont les trois voisins occupent les sommets.
-
Le carbone digonal :
 ou
ou

-
Il peut échanger
-
soit une simple liaison et une triple
liaison
-
soit deux doubles liaisons.
-
Il possède deux atomes
voisins distincts
-
L’écriture topologique est une
représentation simple et rapide des molécules organiques.
-
Les atomes de
carbone
et les atomes d’hydrogène
liés à ces atomes ne
sont pas indiqués.
-
Les atomes d’hydrogène
non liés à des atomes de carbone
sont indiqués.
-
Un
sommet
correspond à un atome de carbone et aux atomes d’hydrogène qui sont liés à
l’atome de carbone.
-
Un
segment
correspond à un doublet liant.
-
La
chaîne carbonée
est représentée en ligne
brisée.
►
Exemple : molécule d’acide
3-méthylbutanoïque
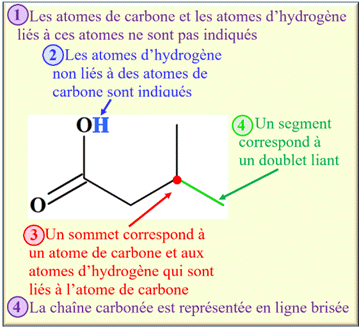
►
Exemple : les différences entre la
formule développée et la forme topologique :
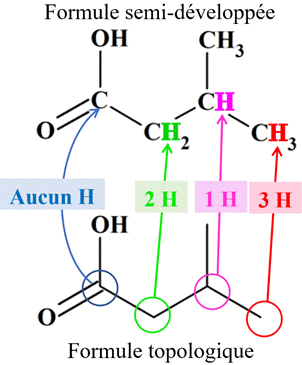
►
Remarque :
-
(Le nombre d’atome(s) d’hydrogène
lié(s) à chaque atome de carbone)
+
(le nombre de doublet(s) liant(s) qui l’entoure) est égal (à quatre).
-
N
(atome H) +
N (doublet
liant – ) =
4
|
Formule semi-développée :
Formule topologique
Nom : 2,2-diméthylbutane |
|
Formule semi-développée :
Formule topologique
Nom : octan-2-one |
|
Formule semi-développée :
Formule topologique
Nom : 2-méthylbutan-2-ol |
| Méthylcyclohexane |
 |
Butan-2-ol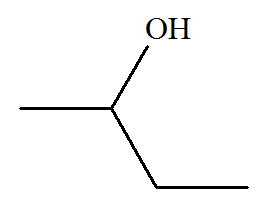 |
Phénol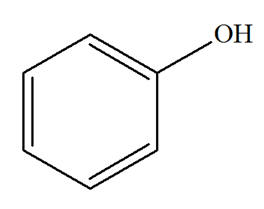 |
Phénylméthanol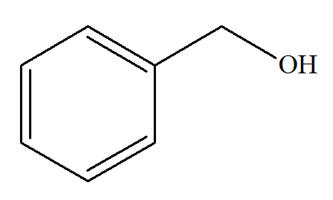 |
2)- Familles fonctionnelles et nomenclature.
a)-
Un peu de nomenclature.
-
En 1892, la commission de Genève a
élaboré 60 règles permettant de nommer les molécules organiques en construisant
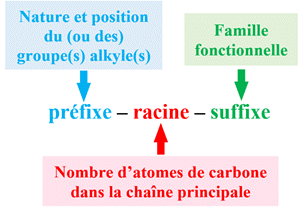
leur nom en trois parties :
-
préfixe
– racine
– suffixe
-
La nomenclature a évolué mais cette
construction en trois parties demeure.
►
Composition d’une molécule organique.
-
Les molécules organiques comportent
deux parties :
-
Un squelette carboné ;
-
Et un ou plusieurs groupes
caractéristiques.
-
Les molécules qui possèdent le même
groupe caractéristique ont des propriétés chimiques communes.
-
Ces propriétés chimiques communes
définissent une fonction chimique.
-
Une molécule organique comporte un
enchaînement d’atomes de carbone.
-
Cet enchaînement est appelé :
chaîne carbonée.
-
Cette chaîne carbonée peut être
linéaire,
ramifiée ou
cyclique.
-
Chaque molécule organique possède un
nom qui donne des informations :
-
Sur sa chaîne carbonée
-
Sur la famille de composé à laquelle
elle appartient.
-
Le nom des molécules organiques est le
la forme :
préfixe
– racine
– suffixe
►
Un peu de nomenclature :
Chap N° 07 Structure des
entités organiques
-
Le
suffixe
indique la famille de composés à laquelle appartient
l’espèce chimique.
-
Tableau de quelques familles de
composés :
|
Famille de composés |
alcool |
aldéhyde |
cétone |
acide carboxylique |
|
Suffixe |
ol |
al |
one |
oïque |
|
Formule générale |
R – OH |
|
|
|
-
R
représente un radical alkyle (type : –
CnH2n
+ 1)
-
La
racine
indique le nombre d’atomes de carbone C
de la chaîne principale.
-
Le carbone fonctionnel :
-
L’atome de
carbone fonctionnel
est celui qui appartient au groupe caractéristique ou qui est lié au groupe
hydroxyle.
-
La chaîne principale :
-
La chaîne principale est la chaîne
carbonée :
-
Qui comporte le
plus grand nombre d’atomes de carbone
-
Ainsi que l’atome de
carbone fonctionnel.
|
Nombre d’atomes de carbone |
Racine |
|
1 |
méthan- |
|
2 |
éthan- |
|
3 |
propan- |
|
4 |
butan- |
|
5 |
pentan- |
|
6 |
hexan- |
|
7 |
heptan- |
|
8 |
Octan- |
|
9 |
nonan- |
|
10 |
décan- |
|
11 |
undécan- |
|
12 |
dodécan- |
|
13 |
tridécan- |
|
14 |
tétradécan- |
|
15 |
pentadécan- |
|
16 |
hexadécan- |
|
17 |
heptadécan- |
|
18 |
octadécan- |
-
Un
préfixe
apparaît dans le nom si la chaîne principale est ramifiée par un ou plusieurs
groupes alkyles de formule générale – CnH2n+1.
-
Le
préfixe
indique la position
et la nature
du groupe alkyle.
-
Les 4 premiers groupes alkyles :
|
Groupe alkyle |
Nom |
|
–CH3 |
méthyl- |
|
–CH2–CH3 |
éthyl- |
|
–CH2–CH2–CH3 |
propyl- |
|
–CH2–CH2–CH2–CH3 |
butyl- |
-
Remarque :
-
Si la chaîne carbonée porte plusieurs
groupes identiques, on utilise les préfixes :
di, tri, tétra…
►
En résumé :
|
Famille fonctionnelle |
Ester |
Amine |
Amide |
Halogénoalcane |
|
|
Groupe caractéristique |
|
|
|
– F |
– Cl |
|
– Br |
– I |
||||
|
Suffixe ou préfixe |
…oate de …yle |
Amine * |
Amide * |
fluoro ; chloro bromo ; iodo |
|
|
Formule générale |
|
R – NH2 |
|
|
|
-
Cas des amines : amine primaire :
R – NH2 ;
|
Amine |
Primaire |
Secondaire |
Tertiaire |
|
Formule générale |
R – NH2 |
|
|
|
|
|
Amines substituées |
|
-
Cas des
amides :
|
Amide |
Primaire |
Secondaire |
Tertiaire |
|
Formule générale |
|
|
|
|
|
|
Amides substituées sur
l’azote |
|
-
Si l’atome d’azote, en plus d’être lié
à la chaîne principale, est aussi lié à des groupes alkyles, le nom est précédé
de la mention N–alkyl.
- Nomenclature des amines (exemples).
|
Quelques amines |
|
|
Formule topologique |
Nom |
|
|
Éthanamine |
|
|
N-méthyléthanamine |
|
|
N-éthyl-N-méthylpropan-1-amine |
|
Quelques amides |
|
|
Formule topologique |
Nom |
|
|
Propanamide |
|
|
N-méthylpropanamide |
|
|
N-éthyl-N-méthylpropanamide |
|
Quelques molécules |
|
Formule topologique et
nom |
|
3-méthylbutanoate
de
2- méthylpropyle |
|
3-methylpentan-2-amine |
|
N-methylbutanamide |
|
3-bromo-1,2-dichlorobutane |
-
Le squelette carboné représente
l’enchaînement des atomes constituant une molécule organique.
-
La chaîne carbonée est représentée sous
forme de ligne brisée dans la formule topologique.
-
Dans le squelette carboné, on peut
trouver :
-
Des liaisons simples représentées par
un tiret : –
-
Des liaisons doubles : ![]()
-
Des liaisons triples : ![]()
-
Si une liaison multiple est présente le
squelette est dit insaturé.
-
Dans le cas contraire, on dit qu’il est
saturé.
|
-
Les isomères de constitution sont des molécules |
-
Ils n'ont pas la même formule
développée ou semi-développée plane.
-
On distingue :
-
L’isomérie de chaîne (les molécules
diffèrent par leur chaîne carbonée
-
L’isomérie de position (un groupe
caractéristique ou une insaturation occupe une position différente sur un même
squelette carbonée)
-
L’isomérie de fonction (les molécules
présentes des groupes fonctionnels différents).
-
Un isomère de constitution est
parfaitement déterminé lorsque l'on connaît son squelette carboné.
-
La formule plane, appelée formule de
constitution indique la nature et l'enchaînement des liaisons entre les atomes
de la molécule.
-
On distingue :
-
La formule développée plane.
-
La formule semi-développée plane.
-
La formule topologique.
-
Les isomères de constitution sont des
corps purs différents qui possèdent des propriétés physiques et chimiques
différentes.
►
Application.
-
Donner la formule brute, la formule
semi-développée et la formule topologique de la molécule suivante : butan-2-one.
-
Donner les formules semi-développées et
les formules topologiques des différents isomères des molécules suivantes :
C4H10
et C3H8O.
-
Préciser le type d'isomérie rencontré
et le nom de chaque molécule.
►
Réponses :
|
Butan-2-one |
|
|
Formule brute |
C4H8O |
|
Formule semi-développée |
|
|
Formule topologique |
|
|
Vue 3D |
|
|
Butane |
|
|
Formule brute |
C4H10 |
|
Formule semi-développée |
|
|
Formule topologique |
|
|
Vue 3D |
|
|
Isobutane ou
2-méthylpropane |
|
|
Formule brute |
C4H10 |
|
Formule semi-développée |
|
|
Formule topologique |
|
|
Isomérie de chaîne |
|
|
Vue 3D |
|
-
Différents isomères de la molécule de
formule brute : C3H8O
|
Propan-1-ol Ou Propanol |
|
|
|
|
Propan-2-ol |
|
|
|
|
Isomérie de position
entre les deux alcools |
|||
|
Méthoxyéthane |
|
|
|
|
Isomérie de fonction
entre les alcools et l’éther |
|||
II- L’optimisation d’une synthèse.
1)- Augmentation de la vitesse de formation.
►
Les facteurs cinétiques d’une réaction
chimique :
-
De façon générale,
-
l’évolution d’un système chimique est
d’autant plus rapide que la température du mélange réactionnel est élevée ;
-
l’évolution d’un système chimique est
d’autant plus rapide que les concentrations des réactifs sont élevées.
►
Le catalyseur :
-
Dans certaines réactions, la présence
en faible quantité, d’une substance chimique spécifique, différente des
réactifs, peut accélérer l’évolution du système chimique.
-
De telles substances sont appelées
catalyseurs
-
Un catalyseur est une espèce chimique
qui accélère une réaction chimique.
-
La formule du catalyseur n’apparaît pas
dans l’équation de la réaction.
-
Un catalyseur modifie la nature des
étapes permettant de passer des réactifs aux produits.
-
La réaction globale lente est remplacée
par plusieurs réactions rapides.
-
Un catalyseur est spécifique à une
réaction chimique.
►
En conséquence :
-
Pour augmenter la vitesse de formation
d’un produit, on peut :
-
Chauffer le milieu réactionnel avec un
montage de chauffage à reflux ;
-
Augmenter la concentration des
réactifs ;
-
Utiliser un catalyseur.
2)- Optimisation du rendement.
►
Le rendement d’une réaction chimique :
-
On appelle rendement, noté
η, de la synthèse,
le quotient de la quantité de produit P
effectivement obtenue nP
par la quantité maximale attendue nmax :
-
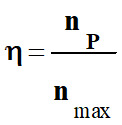
-
Si la synthèse du produit demande
plusieurs étapes, le rendement de la synthèse est égal au produit des rendements
de chaque étape.
-
Le rendement est défini par rapport au
réactif limitant.
- Rendement :
►
Augmentation du rendement d’une
réaction chimique :
-
On peut améliorer le rendement d’une
réaction limitée en ajoutant :
-
Un excès de l’un des réactifs de la
réaction,
-
Ou en éliminant un des produits de la
réaction.
►
Exemple :
Synthèse du méthanoate
d'éthyle.
-
Caractéristiques des réactifs et des
produits :
|
M g . mol–1 |
Densité |
θéb
°C |
Solubilité dans l'eau |
|
|
Acide méthanoïque HCO2H
(ℓ) |
46 |
1,05 |
100,7 |
Grande |
|
Éthanol C2H5OH
(ℓ) |
46 |
0,81 |
78 |
grande |
|
Méthanoate d'éthyle HCO2
C2H5
(ℓ) |
74 |
0,92 |
54,5 |
Faible |
|
Eau H2O
(ℓ) |
18 |
1 |
100 |
----------- |
-
Schéma du montage :
|
Distillation fractionnée
|
1- Chauffe-ballon. 2- Mélange réactionnel. 3- Colonne de Vigreux. 4- Thermomètre 5- Arrivée et sortie d’eau 6-
réfrigérant 7-
éprouvette graduée 8- Distillat. |
-
Le mélange réactionnel est constitué :
-
de 20 mL d’acide méthanoïque,
-
de 20 mL d’éthanol et
-
de quelques gouttes d’acide sulfurique
concentré (catalyseur).
-
On porte à l'ébullition douce et on
recueille le distillat dans l'éprouvette graduée.
-
Équation de la réaction : On est en
présence d’un équilibre chimique.
|
|
Estérification → |
|
||
|
HCO2H
(ℓ) |
+ C2H5OH
(ℓ) |
|
HCO2
C2H5
(ℓ) |
+ H2O
(ℓ) |
|
Acide carboxylique |
Alcool |
|
Ester |
eau |
|
|
← Hydrolyse |
|
||
-
Au cours de la distillation
fractionnée, les réactifs et les produits se vaporisent et monte dans la colonne
à distiller.
-
Au cours de l'ascension, le mélange
s'enrichi en corps le plus volatil
(ici l'ester).
-
En tête de colonne, on obtient le corps
le plus volatil pratiquement pur.
-
Le distillat est ensuite condensé grâce
au réfrigérant.
-
On élimine donc l’ester au fur et à
mesure de sa formation.
-
Pour compenser cette élimination, le
système évolue dans le sens direct
(estérification) de l’équation pour former l’ester.
-
En utilisant ce procédé, on passe d’un
rendement de 66 % (dans le cas présent) à un rendement proche de 100 %.
III- La stratégie d’une synthèse.
1)- Modification de groupe ou de chaîne.
-
Au cours d’une réaction chimique, on
peut modifier la chaîne carbonée d’une molécule.
-
On peut créer une liaison
carbone-carbone ou réaliser la rupture d’une liaison carbone-carbone.
-
On peut aussi modifier un ou plusieurs
groupes caractéristiques d’une molécule.
- Synthèse de la propan-2-one :
►
Groupe protecteur.
-
Un groupe protecteur est un groupe
caractéristique, volontairement créé dans la molécule d’un composé fonctionnel
afin de bloquer la réactivité de l’une de ses fonctions.
-
Cette fonction, que l’on veut bloquer,
est temporairement transformée en une autre fonction.
►
Propriétés du groupe protecteur.
-
Le groupe protecteur doit :
-
Réagir de manière sélective avec la
fonction à protéger ;
-
Être stable lors des réactions
suivantes ;
-
Pouvoir être enlevé facilement et de
manière sélective, une fois la réaction effectuée.
►
Remarque :
-
L’utilisation d’un groupe protecteur
nécessite au moins deux étapes supplémentaires lors de la synthèse.
-
Il faut que les étapes de
protection et de
déprotection
se fassent avec de très bons rendements.
►
Exemple : cas de la molécule A :
3-oxobutanoate de méthyle.
-
En présence de
tétrahydruroaluminate de lithium,
les deux groupes fonctionnels de la molécule A
sont transformées :
|
Molécule A |
|
Produit |
|
|
LiAℓH4 → |
|
|
3-oxobutanoate de
méthyle Fonction cétone et
fonction ester |
|
1-méthoxybutane-1,3-diol Fonction alcool et
fonction éther |
-
Grâce à des étapes de protection et de
déprotection, il est possible de transformer un seul des deux groupes
caractéristiques de la molécule A.
-
On protège la fonction cétone :
|
Molécule A |
|
|
|
|
C2H6O2 APTS → |
|
|
|
Protection |
|
-
On réalise la réaction :
|
|
|
|
|
|
LiAℓH4 → |
|
|
|
Réaction |
Intermédiaire |
-
On réalise la déprotection :
|
|
|
molécule finale |
|
|
H2O APTS → |
|
|
Intermédiaire |
Réaction |
4-hydroxy-4-méthoxybutan-2-one |
-
APTS :
acide paratoluènsulfonique (acide 4-méthylbenzène-1-sulfonique)
-
L’acide paratoluènesulfonique est un
acide organique fort.
-
Il est utilisé comme catalyseur acide
en synthèse organique.
-
Il ne présente pas de caractère oxydant
comme l’acide sulfurique.
-
Il limite les réactions secondaires (sa
base conjuguée n’est pas nucléophile).
-
Formule brute :
C7H8O3
|
Formule semi-développée |
Formule topologique |
|
|
|
-
Dans une réaction d’addition, des
atomes, ou groupes d’atomes, sont ajoutés aux atomes d’une liaison multiple.
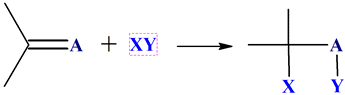 |
-
Exemple : Addition de dibrome sur un
alcène le 2-méthylbut-2-ène.
|
|
|
|
|
|
|
|
+ |
|
→ |
|
|
2-méthylbut-2-ène |
|
Dibrome |
|
2,3-dibromo-2-méthylbutane |
-
Le dibrome s’additionne sur la double
liaison C = C.
-
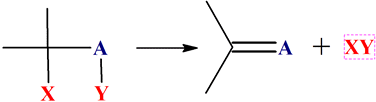
Dans une réaction d’élimination, des
atomes ou des groupes d’atomes, portés par des atomes adjacents sont éliminés
pour former une liaison multiple.
 |
-
Exemple : déshydratation d’un alcool.
|
|
H+ → |
|
+ |
|
|
2,3-diméthylbutan-2-ol |
Acide sulfurique |
2,3-diméthylbut-2-ène |
|
|
-
Dans une réaction de substitution, un
atome ou un groupement d’atomes est remplacé par un autre atome ou groupement
d’atomes.
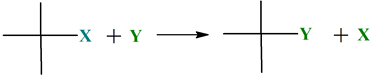 |
-
Exemple : synthèse du
2-méthylpropan-2-ol
|
|
|
|
|
|
|
|
|
+ |
H –
OH
(ℓ) |
→ |
|
+ H+
(aq) + Cℓ–
(aq) |
|
2-chloro-2-méthylpropane |
|
|
|
2-méthylpropan-2-ol |
|
-
L’atome de chlore
– Cℓ
du dérivé chloré a été remplacé par le groupe
hydroxyle – OH
-
Exemple : Synthèse du nitrobenzène
|
|
|
|
|
|
|
|
|
+ |
 |
→ |
|
+
|
|
benzène |
|
Acide nitrique |
|
nitrobenzène |
|
-
Un atome d’hydrogène
– H
est remplacé par un groupe
–NO2.
-
Une réaction acido-basique consiste à
un transfert d'un proton H+
entre l’acide A1H d’un
couple sur la base A2–
d’un autre couple.
|
A1H |
|
H
+
+ A2
|
|
A1H
+ A2
|
-
Couple acide / base 1 :
A1H ![]() H
+
+ A1–
H
+
+ A1–
-
Couple acide / base 2 :
A2H ![]() H
+
+ A2–
H
+
+ A2–
e)-
Réaction d’oxydoréduction.
-
Une réaction d’oxydoréduction est une
réaction qui met en jeu un transfert
d’électrons e–
entre ses réactifs.
-
Elle fait agir l’oxydant d’un couple
avec le réducteur d’un autre couple pour donner leurs espèces conjuguées.
-
Une réaction d’oxydoréduction fait
intervenir l’oxydant Ox1
et le réducteur Red2
de deux couples oxydant réducteur Ox1
/ Red1
et Ox2
/ Red2.
|
( Ox1
+ n1
e –
|
|
(
Red2
|
|
n2
Ox1
+ n1
Red2
|
►
Exemple :
-
La réaction qui modélise la
transformation du propan-2-ol en propanone est une réaction d’élimination.
-
C’est aussi une réaction
d’oxydoréduction.
-
Couple propan-2-one / propan-2-ol
|
propan-2-one |
|
propan-2-ol |
|
|
|
|
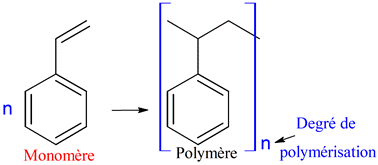
3)- Réaction de polymérisation.
-
Un polymère est une
macromolécule
constituée d’un grand nombre d’unités répétitives, les
monomères, qui sont
unis par des liaisons covalentes.
-
Dans la macromolécule, une unité
structurale appelée motif
se répète un grand nombre de fois.
|
Macromolécule |
Motif |
|
|
|
c)- Réaction de polymérisation.
-
Une
réaction de polymérisation permet d’obtenir
les macromolécules constituant le polymère à partir d’un grand nombre de
molécules identiques appelées monomères.
-
Polymérisation du styrène :
-
La synthèse organique consiste à
produire une espèce chimique organique.
-
Les molécules de cette espèce, dites
molécules cibles,
sont plus complexes que les molécules de réactifs appelés
précurseurs de la
molécule cible.
-
Une équation est toujours ajustée mais
en chimie organique, on utilise souvent une écriture simplifiée.
►
Exemple :
|
Molécule A |
|
Molécule B |
|
|
CH3I → THF, 0 ° C |
|
|
4-méthoxy-4-oxobutan-2-olate |
|
3-méthoxybutanoate de méthyle |
-
Dans le cas présent, on distingue :
-
La
molécule A
qui est le précurseur de la
molécule cible (molécule B)
-
On indique le
réactif secondaire
CH3I
au-dessus de la flèche.
-
Au-dessus et au-dessous de la flèche
des informations sont fournies
-
Solvant,
catalyseur, température,
et aussi,
durée de la réaction, chauffage (Δ), …
-
Dans l’écriture simplifiée, seule la
formule de la molécule cible est indiquée.
-
Le sous-produit de la réaction (dans le
cas présent I–)
n’est pas indiqué.
-
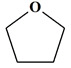
THF :
tétrahydrofurane (oxolane) : formule brute : C4H8O
-
Formule topologique :
-
Il est utilisé en synthèse organique
comme solvant et comme catalyseur.
►
Stratégie de synthèse :
-
Pour définir une stratégie de synthèse,
le chimiste dispose de banques de réactions.
-
Pour comparer plusieurs synthèses d’une
même espèce cible, un critère important est le
rendement global de
la synthèse.
-
Il doit être le plus élevé possible.
-
D’autres critères sont aussi
importants :
-
L’écoresponsabilité
-
Le coût
-
La durée
-
Les conditions expérimentales,
-
Etc.
►
Synthèse écoresponsable :
-
La chimie écoresponsable
se propose d’agir sur cinq domaines : les matières premières, les solvants,
l’énergie, les déchets et le produit fini.
-
Elle prend en compte la gestion : des
solvants, des matières premières, de l’énergie, du produit fini et des
déchets.
-
Les solvants
:
-
Utiliser des solvants non toxiques et
non polluants.
-
Les matières premières
:
-
Limiter les quantités, économiser les
atomes en valorisant toutes les molécules, préférer les réactions chimiques les
moins dangereuses et les matières premières renouvelables.
-
L’énergie
:
-
Limiter les dépenses énergétiques,
rechercher de nouvelles sources d’énergie à faible teneur en carbone, utiliser
des conditions opératoires douces (catalyseur, faible température, basse
pression)
-
Le produit fini
:
-
Concevoir un produit chimique
présentant le moins de dangers possibles, concevoir un produit chimique en vue
de sa dégradation.
-
Les déchets
:
-
Limiter la production de déchets,
valoriser ou recycler les déchets.
1)- Réaction chimique :
Synthèse du polystyrène :
|
QCM r
Les synthèses
organiques La structure des
entités chimiques organiques L’optimisation d’une
synthèse La stratégie d’une synthèse. |
|
Préparation à l’ECE : Synthèse d’un ester à l’odeur de jasmin 1)- Exercice 04
page 202 : Représenter des formules topologiques. 2)- Exercice 06
page 202 :Reconnaître un groupe caractéristique. 3)- Exercice 08
page 203 : Justifier des noms. 4)- Exercice 10
page 203 : Identifier des isomères de constitution. 5)- Exercice 12
page 203 : Optimiser un rendement et une vitesse. 6)- Exercice 15
page 203 : Compléter des étapes d’une synthèse. 7)- Exercice 16
page 204 : Attribuer une catégorie de réaction. 8)- Exercice 20
page 204 :Représenter un motif. 9)- Exercice 22
page 205 : Quelques réactions de synthèse. 10)- Exercice 25
page 206 : Le nylon 6,6. 11)- DS 01 (30
min) Un ester à l’odeur de rhum : Exercice 32 page 210. 12)- DS 02 : (30
min) Synthèse de la testostérone : exercice 33 page 210. |
|
|