|
Chap. N° 19 |
Stratégie d'une synthèse et sélectivité en chimie organique. Cours. |
|
|
|
|
Exercices : énoncé avec correction a)- Exercice 5 page 506 : analyser un protocole : synthèse d’un
liquide. b)- Exercice 6 page 506 : analyser un protocole : synthèse d’un solide. c)- Exercice 8 page 507 : savoir filtrer sous pression réduite. d)- Exercice 11 page 507 : étudier la sélectivité d’une réaction. e)- Exercice 12 page 508 : rendement d’une réaction d’oxydation. f)- Exercice 13 page 508 : Un di-antalgique, le Salipran®. g)- Exercice 14 page 509 : Synthèse d’un médicament : la benzocaïne. h)-
Exercice 17 page 511 : Analyse critique de protocole. |
I-
Stratégie à adopter lors d’une synthèse.
1)- Étape préliminaire : avant
l’expérience.
► Pour synthétiser un composé organique, il faut
choisir :
-
Les réactifs appropriés et leurs quantités (le
plus souvent l’un des réactifs est introduit en excès, il s’agit
le plus souvent du moins cher)
-
Un solvant adapté qui permet de solubiliser les
réactifs et de contrôler la température dans le milieu
réactionnel.
-
Un catalyseur afin d’accélérer la réaction.
-
Le montage adapté à la réaction.
-
Les paramètres expérimentaux : température, pression,
durée de la réaction, …
► Remarques :
- Il faut prendre en compte les aspects liés à la sécurité.
-
Il faut connaître les pictogrammes des espèces chimiques
utilisées et produites.
-
Il faut appliquer les consignes de sécurité relatives aux
espèces chimiques utilisées.
-
Il faut aussi évaluer le coût de la synthèse et l’impact
sur l’environnement.
- Certaines réactions peuvent avoir lieu à froid, à la pression atmosphérique.
-
Parfois il faut refroidir le milieu
réactionnel, on peut aussi travailler sous pression réduite.
- D’autres réactions nécessitent un chauffage qui permet d’accélérer la réaction.
-
On peut aussi chauffer et
éliminer le produit obtenu au fur et à mesure qu’il se forme.
-
Le plus souvent, le chauffage du mélange réactionnel
permet de dissoudre les réactifs solides et d’augmenter le
rendement de la réaction.
-
La technique utilisée le plus souvent est le
chauffage à reflux.
-
Le chauffage à reflux permet de chauffer tout en évitant
les pertes par évaporation.
-
Ce montage permet de maintenir le milieu réactionnel à
une température constante, en l'occurrence pratiquement la
température d'ébullition du solvant.
-
Les vapeurs sont condensées dans le réfrigérant et
retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits restent dans le milieu
réactionnel.
-
Il permet d’accélérer la réaction sans perte de matière.
► Exemple de montage lors de la
synthèse de l’acide benzoïque :
-
L’isolement consiste à séparer au mieux le produit des
réactifs n’ayant pas réagi, des produits secondaires, du
catalyseur, du solvant et des sous-produits dus à des réactions
parasites.
-
L’isolement conduit au produit brut.
b)-
Les techniques employées :
![]() La filtration sous pression réduite :
La filtration sous pression réduite :
-
Une fiole à vide munie d’un entonnoir Büchner permet une
filtration rapide et un essorage efficace sous pression réduite.
-
Schéma :

![]() Extraction liquide –liquide :
Extraction liquide –liquide :
-
L’extraction liquide –liquide permet de transférer
sélectivement des espèces chimiques présentes dans un solvant
vers un autre solvant, non miscible au premier, dans lequel
elles sont plus solubles.
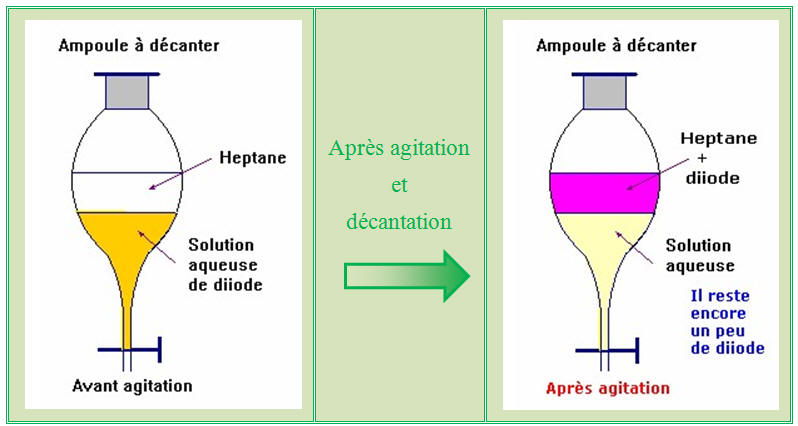
![]() extraction
du diiode présent dans une solution aqueuse : L’ampoule à
décanter :
extraction
du diiode présent dans une solution aqueuse : L’ampoule à
décanter :

► Protocole expérimental :
-
Introduire le mélange (solution aqueuse d’iodure de
potassium et de diiode) dans l’ampoule à décanter
-
Puis ajouter délicatement le solvant (hexane ou pentane :
solvant organique : liquide incolore moins dense que la solution
aqueuse et non miscible)

-
Agiter, laisser décanter et dégazer.
-
On observe alors deux phases :
-
La phase inférieure qui est pratiquement décolorée et la
phase supérieure qui contient le diiode dans le solvant qui est
violette.

-
On dit que le diiode a été extrait par le solvant.
-
On récupère la phase contenant le diiode et le solvant.
-
Après séchage pour éliminer l’eau de la phase organique
(on peut utiliser un desséchant chimique comme le sulfate de
sodium anhydre Na2SO4),
-
Évaporation du solvant (grâce à un évaporateur rotatif),
-
On recueille le diiode (solide).
4)- Étape 3 : La purification.
-
La purification consiste à éliminer les faibles quantités
d’impuretés, contenues dans le produit brut afin d’obtenir le
produit purifié.
-
Les deux méthodes utilisées :
-
On utilise la recristallisation pour les solides
et la distillation pour les liquides.
-
La recristallisation est une méthode de purification des
solides fondée sur la différence de solubilité du produit et des
impuretés dans un solvant.
► Exemple recristallisation de l’acide
acétylsalicylique obtenu par synthèse :
-
Le but de cette manipulation est de purifier l’acide
acétylsalicylique en utilisant la différence de solubilité entre
un corps et ses impuretés dans un solvant.
-
On dissout l’acide acétylsalicylique impur à chaud dans
un solvant approprié.
-
Lorsque la solution refroidit, l’aspirine cristallise et
les impuretés restent en solution.
![]() Manipulation.
Manipulation.
-
Dans un erlenmeyer verser :
-
L’acide acétylsalicylique impur (solide blanc) et 6 mL
d’éthanol.
-
Chauffer au bain-marie en agitant jusqu’à dissolution
complète du solide.
-
Ajouter 15 mL d’eau distillée à la température ambiante.
-
Laisser refroidir à température ambiante, puis placer
l’erlenmeyer dans un bain eau – glace.
-
Filtrer sur Büchner, sécher et peser.
-
La distillation est une méthode de purification des
liquides fondée sur les différences de température d’ébullition
du produit et des impuretés.
► La distillation simple :
-
Une espèce chimique volatile, non miscible à l’eau, peut
être extraite par hydrodistillation.
-
Exemple : on extrait par entraînement à la vapeur,
l’huile essentielle des fleurs de lavande.
|
(1)‑
Chauffe-ballon. (2)‑ Mélange. (3)‑ Thermomètre. (4)‑ Réfrigérant oblique. (5)‑Arrivée et Sortie de l’eau. (6)‑ Éprouvette. (7)‑ Fleur de lavande. (8)‑ Huile essentielle.
|
-
Dans l’entraînement à la vapeur, l’ébullition du mélange
d’eau et du produit crée un courant de vapeurs.
-
Ce courant de vapeurs est constitué de vapeurs d’eau et
de vapeurs des huiles essentielles du produit.
-
On condense ce mélange gazeux pour obtenir un distillat.
-
Ce distillat est constitué d’eau à l’état liquide et des
huiles essentielles à l’état liquide.
-
Les huiles essentielles étant peu miscibles avec l’eau
et moins dense que l’eau, elles surnagent.
-
Cette huile essentielle est un mélange dont le principal
constituant est l’acétate de linalyle (ester peu soluble dans
l’eau).
► Distillation fractionnée :
|
(1)‑Chauffe-ballon. (2)‑Mélange. (3)‑Colonne de Vigreux. (4)‑Thermomètre. (5)‑Arrivée et Sortie de l’eau. (6)‑Condenseur. (7)‑Éprouvette. (8)‑Distillat. (9)- Support élévateur (Vallet) |
-
Elle permet de séparer les espèces chimiques constituant
un mélange liquide.
-
Le mélange à distiller est placé dans un ballon surmonté
d’une colonne à distiller :
-
Colonne de Vigreux.

-
On chauffe le ballon jusqu’à ébullition du mélange.
-
Les vapeurs des différentes espèces chimiques montent
dans la colonne à distiller.
-
La colonne à distiller permet de séparer les différentes
espèces chimiques.
-
En tête de colonne à distiller, on trouve l’espèce
chimique la plus volatile.
-
Les autres espèces chimiques moins volatiles se
condensent et retombent dans le ballon.
-
L’espèce chimique la plus volatile est condensée grâce au
réfrigérant.
-
On recueille le distillat.
-
Les étapes d’analyses permettent de contrôler la pureté
du produit synthétisé et de l’identifier à partir de ses
caractéristiques physiques.
b)-
Technique et matériel utilisé :
-
Mesure de la température de fusion pour les solides :
Banc Kofler
-
Mesure de l’indice de réfraction pour les liquides :
Réfractomètre
-
Mesure de la température d’ébullition : Thermomètre et
colonne à distiller
-
Spectroscopie IR et
RMN.
-
Chromatographie :
C.C.M.
6)- Étape 5 : Le calcul du
rendement.
-
On appelle rendement, noté
ρ, de la synthèse, le
quotient de la quantité de produit P effectivement
obtenue nP par la quantité maximale attendue
nmax :
-

-
Si la synthèse du produit demande plusieurs étapes, le
rendement de la synthèse est égal au produit des rendements de
chaque étape.
1)- Les composés polyfonctionnels.
-
Un composé polyfonctionnel est un composé possédant
plusieurs groupes caractéristiques.
-
Exemples :
-
Le para-aminophénol possède un groupe amine et un groupe
hydroxyle :

-
Acide 2-aminoéthanoïque : groupe amine et groupe
carboxyle :

2)- Réaction sélective et Réactifs
chimio-sélectifs.
![]() Une
réaction est sélective lorsque parmi plusieurs fonctions d’une
même molécule, l’une d’elle réagit préférentiellement avec le
réactif considéré.
Une
réaction est sélective lorsque parmi plusieurs fonctions d’une
même molécule, l’une d’elle réagit préférentiellement avec le
réactif considéré.
![]() Un
réactif, qui provoque une réaction sélective, est dit
chimiosélectif.
Un
réactif, qui provoque une réaction sélective, est dit
chimiosélectif.
b)-
Exemple : synthèse du paracétamol.
-
Le paracétamol est un médicament qui se rapproche de
l'aspirine par ses propriétés analgésiques et antipyrétiques.
-
Il est dépourvu d'action anti-inflammatoire, mais ne
présente pas les contre-indications de l'aspirine.
-
On l'obtient par réaction entre le para-aminophénol et
l'anhydride éthanoïque en milieu aqueux.
-
L’équation de la réaction est la suivante :
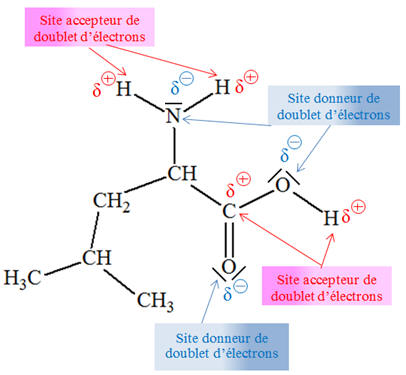
► Indiquer, dans les réactifs, les sites donneurs et
accepteurs de doublets d’électrons.
-
Cas du para-aminophénol :

-
L’atome d’azote du groupe amine et l’atome d’oxygène du
groupe hydroxyde sont des sites donneurs de doublet d’électrons.
-
Cas de l’anhydride éthanoïque :

-
L’atome de carbone C du groupe anhydride
 porte une charge partielle
positive car il est lié à deux atomes d’oxygène plus
électronégatifs que lui.
porte une charge partielle
positive car il est lié à deux atomes d’oxygène plus
électronégatifs que lui.
-
C’est un site accepteur de doublet
d’électrons.
► Indiquer par des flèches courbes, le mouvement des
doublets d’électrons permettant d’expliquer la formation et la
rupture de liaisons observées lors de cette réaction.
-
Première étape :
-
Deuxième étape :
-
Troisième étape :
► Identifier les sites qui réagissent effectivement.
-
La molécule de para-aminophénol possède deux sites
donneurs de doublets d’électrons :
-
L’atome d’azote du groupe amine et l’atome d’oxygène du
groupe hydroxyde.
-
Dans le cas présent, c’est l’atome d’azote du groupe
amine qui participe à la réaction :

► Que peut-on tirer comme conclusion ?
-
L’atome d’azote est un meilleur site donneur de doublet
d’électrons que l’atome d’oxygène.
-
Le groupe amine réagit préférentiellement sur l’anhydride
éthanoïque.
-
La réaction est sélective et l’anhydride éthanoïque est
un réactif chimiosélectif.
c)-
Exemple : réaction entre l’aspirine et la soude.
-
Formule de l’aspirine :

► Entourer et nommer les fonctions présentes dans
l’aspirine.

► Quelles sont les réactions possibles sur
l’aspirine lorsque l’on fait agir une base forte comme la
soude ?
-
La réaction acide-base qui se produit à température
ambiante.
-
C’est une réaction totale, rapide.
-
Elle permet de doser l’aspirine présente dans un cachet
d’aspirine.
-
Équation de la réaction :
-
Il se produit une réaction de saponification entre la
fonction ester et les ions hydroxyde.
-
Cette réaction est totale mais elle est très lente à la
température de 25 °C.
-
Il faut chauffer pour accélérer la réaction.
-
Équation bilan de la réaction :
► Influence de la vitesse de réaction et de la
température.
-
Lors de la réaction entre l’aspirine et la soude, à la
température ambiante, seule la fonction acide carboxylique
réagit : la réaction est sélective.
-
Si l’aspirine est chauffée à reflux avec un excès de
soude, les deux fonctions réagissent.
-
Dans ces conditions, la réaction est non sélective.
![]() La
sélectivité ou non-sélectivité d’une réaction dépend des
réactifs utilisés mais aussi des conditions expérimentales.
La
sélectivité ou non-sélectivité d’une réaction dépend des
réactifs utilisés mais aussi des conditions expérimentales.
-
Un groupe protecteur est un groupe caractéristique,
volontairement créé dans la molécule d’un composé fonctionnel
afin de bloquer la réactivité de l’une de ses fonctions.
-
Cette fonction, que l’on veut bloquer, est temporairement
transformée en une autre fonction.
b)-
Propriétés du groupe protecteur.
-
Le groupe protecteur doit :
-
Réagir de manière sélective avec la fonction à protéger ;
-
Être stable lors des réactions suivantes ;
-
Pouvoir être enlevé facilement et de manière sélective,
une fois la réaction effectuée.
► Remarque :
-
L’utilisation d’un groupe protecteur nécessite au moins
deux étapes supplémentaires lors de la synthèse.
-
Il faut que les étapes de protection et de déprotection
se fassent avec de très bons rendements.
c)-
Exemple : synthèse d’un dipeptide :
|
La leucine et l’alanine sont
deux acides α–aminés dont les formules
topologiques sont données ci-dessous : On fait réagir ces deux acides
α–aminés dans des conditions telles que les
fonctions acide carboxylique peuvent réagir avec les
fonctions amine. 1. La réaction entre la leucine (Leu) et l’alanine (Ala) est-elle sélective ? Si non, à combien de dipeptides peut conduire cette réaction ?
Donner les réactions
chimiques correspondantes. On souhaite synthétiser le
dipeptide dont la formule est donnée ci-dessous. ► Remarque : -
L’alanine
-
La leucine
-
Les dipeptides formés à partir de ces deux
acides α–aminés sont nommés par les
abréviations à trois lettres des acides α–aminés
à partir desquels ils sont construits. -
Pour construire le nom du dipeptide, on
commence par l’acide aminé
qui a gardé son groupement – NH2 libre. -
Ainsi le dipeptide suivant : -
Porte le nom suivant :
Leu –
Ala -
L’un des acides α–aminés (Leu)
garde sa fonction amine, l’autre garde sa fonction
acide (Ala) 2. Nommer la nouvelle fonction chimique créée. 3. Quelles fonctions sont à protéger pour
synthétiser ce dipeptide ? |
|
1. La réaction entre la leucine (Leu)
et l’alanine (Ala) : - L’alanine et la leucine sont des acides α–aminés. -
Ils possèdent une fonction amine et une fonction
acide carboxylique. -
Ce sont des réactifs polyfonctionnels. -
La fonction acide carboxylique de l’alanine
peut réagir avec les fonctions amine de l’alanine de
de la leucine. -
La fonction acide carboxylique de la leucine
peut réagir avec les fonctions amine de l’alanine de
de la leucine. - On peut obtenir quatre dipeptides différents. -
On se limite ici à la formation de dipeptides, on
peut obtenir aussi des tripeptides) : -
Ala–Ala ;
Leu–Leu ;
Ala–Leu ;
Leu–Ala. -
Équation de la réaction générale : Ou (formule
topologique) -
La fonction acide carboxylique de l’acide
α–aminés A1 réagit avec la
fonction amine de l’acide α–aminés
A2. -
Formation de Ala – Ala : -
La fonction acide carboxylique de l’acide
α–aminés Ala réagit avec la fonction
amine de l’acide α–aminés Ala. -
Formation de Ala – Leu : -
La fonction acide carboxylique de l’acide
α–aminés Ala réagit avec la fonction
amine de l’acide α–aminés Leu. -
La fonction acide carboxylique de l’acide
α–aminés Leu réagit avec la fonction
amine de l’acide α–aminés Ala. -
Formation de Leu – Leu : -
La fonction acide carboxylique de l’acide
α–aminés Leu réagit avec la fonction
amine de l’acide α–aminés Leu. 2.
Nouvelle fonction chimique créée : -
Il se forme une liaison peptidique avec
élimination d’une molécule d’eau entre les deux
acides α–aminés. -
Le dipeptide formé possède une fonction
amine, une fonction acide carboxylique et une
fonction amide. -
La fonction amide est la nouvelle fonction
chimique formée. 3. -
Le dipeptide formé est le Leu – Ala : -
La fonction acide carboxylique de l’acide
α–aminés Leu réagit avec la fonction
amine de l’acide α–aminés Ala. -
Il faut protéger la fonction amine de la
Leucine et la fonction acide
carboxylique de
l’Alanine. -
Dans le même temps, on peut activer la
fonction acide carboxylique
de la Leucine et la
fonction amine de l’Alanine.
|
III- Réductions sélectives et protection.
► Document 1 :
► Document 2 :

►
Document 3 :
|
1. La transformation d’une cétone R – CO – R’ en alcool R – CHOH – R’ est appelée réduction.
Justifier en écrivant la demi-équation
électronique. 2. 3. 4.
plutôt que de réaliser
les étapes 1,2 et 3. Est-ce qu’un tel réactif est présent dans le document 1 ? 5.
Dans la synthèse multi-étape, document 3, le
groupe acétal est appelé « groupe protecteur ».
Proposer une définition d’un groupe protecteur. |
|
1.
La transformation d’une cétone
R – CO – R’
en alcool R – CHOH – R’ :
-
Demi-équation électronique :
-
Un oxydant est une entité chimique capable de
gagner un ou plusieurs électrons. -
Oxydant : gagne
(R – CO – R’) -
Un réducteur est une entité chimique capable
de perdre un ou plusieurs électrons. -
Réducteur :
perd
(R – CHOH – R’) -
Au cours de la réaction, l’oxydant (R – CO
– R’) a été réduit en R – CHOH – R’. 2.
La réduction du composé A par
LiAlH4
est non sélective : -
La réaction de réduction de l’espèce
A
est non sélective car les deux fonctions ester et
cétone réagissent avec LiAlH4. 3.
Les produits B’ et
B’’ formés. -
Avec le DIBAL :
- Le DIBAL est un réducteur qui réduit les esters en aldéhyde. -
Il ne réduit pas les
cétones. - Dans ce cas, le DIBAL est un réactif chimiosélectif. - Il n’intervient que sur la fonction ester du composé A. -
Il n’intervient pas sur
la fonction cétone. -
On obtient le composé
B’ suivant :
- NaCNBH3, réduit lentement les aldéhydes et les cétones, mais n’agit pas
sur
les ester, les amides et les acides carboxyliques. - C’est un réactif chimiosélectif vis-à-vis du composé A. -
Il n’agit que sur la fonction
cétone. -
On obtient le composé
B’’ suivant : 4. - Pour passer directement du composé A au composé B à l’aide d’un réactif chimiosélectif, il faut trouver un réactif qui réduit les esters en alcool sans agir sur la fonction cétone. - Ce réactif n’est pas présent dans
le tableau du document 1. -
Il est préférable d’utiliser un réactif
chimiosélectif plutôt que de réaliser plusieurs
étapes pour une synthèse pour des raisons de
rendement. - S’il existait, son utilisation serait
surement préférable à la réalisation successive des
étapes 1, 2 et 3 pour des raisons de rendement. - Si la synthèse du produit demande plusieurs
étapes, le rendement de la synthèse est égal au
produit des rendements de chaque étape. 5. Définition d’un groupe protecteur. - Un groupe protecteur est un groupe
caractéristique, volontairement créé dans la
molécule d’un composé polyfonctionnel afin de
bloquer la réactivité de l’une de ses fonctions. -
Cette fonction, que l’on veut bloquer, est
temporairement transformée en une autre fonction. -
Exemple :
-
Le groupe acétal est un groupe protecteur.
-
Dans le cas présent, il protège la fonction
cétone de la molécule A. |
||||||||||||||||||||||||||||||||||
IV-
Synthèse peptidique. (acides
α–aminés)
-
Les peptides sont obtenus à partir d’acides
α–aminés,
leur synthèse nécessite plusieurs étapes :
-
L’étape ou les étapes de Protection ;
-
L’étape ou les étapes d’Activation ;
-
L’étape de Couplage ;
-
Et l’étape ou les étapes de déprotection.
► Document 1 :
|
- Les amines primaires et secondaires réagissent lentement à chaud
avec les acides
carboxyliques pour donner un amide : |
►
Document 2 :
|
- Dans la nature, les acides α–aminés sont combinés sous forme de protéine dont chacune
comprend des centaines ou même des milliers d’acides
α–aminés.
- Les petits assemblages d’acides α–aminés sont appelés peptides et la liaison amide qui les
assemble est appelée liaison peptidique.
-
Une nomenclature abrégée conventionnelle est
souvent utilisée pour les polypeptides. -
On dit que le polypeptide s’écrit du
N
terminal vers le C terminal. -
Exemple de dipeptide
Ala –
Gly :
Ala –
Gly |
|||||||||
|
- « L’aptitude à contrôler des groupes amine et acide carboxylique est essentielle pour la synthèse contrôlée des peptides […] Commençons par réfléchir à la façon de faire réagir ensemble deux
acides
α–aminés
pour faire un dipeptide : la leucine et la glycine
par exemple. - Si nous voulons que le groupement – CO2H de la leucine réagisse avec le groupement – NH2 de la glycine, nous activerons d’abord l’acide carboxylique. […] Mais le problème principal vient du fait qu’il y a un autre groupement – CO2H libre et une autre amine qui peuvent réagir. […]
Pour cette raison nous devons protéger à la fois le
groupement
– NH2 de la leucine et le
groupement
– CO2H
de la glycine. » -
Couplage sans protection : compétition de
trois donneurs d’électrons Extrait de J.
Clayden, Chimie organique, De Boeck, 2003, p.
651. |
|
- « Les peptides sont obtenus par condensation de plusieurs acides α–aminés. L’ordre d’enchaînement de ces acides α–aminés est fondamental. Le procédé proposé par R. B. MERRIFIELD (prix Nobel en 1984) utilise un support polymère qui permet d’enchaîner sans ambiguïté les différents acides α–aminés. Le principe est de construire, acide α–aminé par α–aminé, la chaîne
peptidique dont une extrémité est attachée
au polymère insoluble. » |
|
e)-
Choix d’un groupe protecteur : - « Quel type de groupe protecteur doit-on utiliser ? Nous devons pouvoir les enlever après qu’ils ont rempli leur office et donc il n’est pas question d’utiliser, par exemple un amide pour protéger l’amine. […] Idéalement, nous voulons deux groupes que l’on puisse enlever dans des conditions différentes, tout cela sans rompre la
liaison peptidique. » - « Le dipeptide Leu – Gly constitue l’extrémité d’une hormone peptidique, l’ocytocine : -
H2N – Cys – Tyr –
Ile – Gln – Asn – Cys – Pro – Leu – Gly –
CONH2 - L’ocytocine est une hormone qui intervient dans le déclenchement de l’accouchement chez la femme et dans la montée du lait. -
C’est la première
hormone qui a été synthétisée en 1953. » Extrait de J.
Clayden, Chimie organique, De Boeck, 2003, p.
652. |
|
1. Lorsqu’on souhaite créer une liaison peptidique entre la leucine et la glycine sans prendre de précautions particulières,
plusieurs dipeptides sont obtenus. a. Écrire les formules semi-développées de ces
dipeptides et les nommer en utilisant la
nomenclature abrégée conventionnelle. b. La réaction entre la leucine et la glycine est non sélective.
Justifier cette affirmation. 2.
a.
Identifier dans les deux acides α–aminés,
leucine et glycine, les sites accepteur et donneur
de doublet d’électrons. b. Quels sont les sites qui doivent réagir pour
conduire au dipeptide souhaité ? c. Représenter par des flèches courbes, le
mouvement des doublets d’électrons permettant
d’expliquer la formation de la liaison peptidique. 3. Pourquoi active-t-on la fonction acide
carboxylique ? 4. Pour quelle raison n’utilise-t-on pas une
fonction amide pour protéger une fonction amine ? 5. Dans le cas de la synthèse d’un polypeptide, justifier pourquoi il est nécessaire
d’opérer de la
façon décrite dans le passage en italique. 6.
a. Une fois le dipeptide Leu – Gly synthétisé,
quelle fonction doit-on déprotéger
pour continuer la
synthèse de l’ocytocine ? b. On donne la formule de la proline :
c. Quelles sont les fonctions à protéger pour
synthétiser ce tripeptide ? 7.
a. Lors de la synthèse du dipeptide Leu – Gly,
quel est le rendement final si le
rendement de
chaque étape est 90 % ? b. Que devient le rendement, dans ces
conditions, pour un polypeptide composé
de dix
acides α–aminés ? c. Quel avantage présente l’utilisation d’un
polymère insoluble, dans le procédé
Merrifield, par
rapport à une synthèse classique en phase homogène ? 8. Rédiger un texte donnant : -
La définition d’un groupe protecteur ; -
Les propriétés qu’il doit posséder. -
Données : électronégativité :
O : 3,4 ; C :
2,5 ; H : 2,2 ;
N : 3,0. |
|
1. a.
Formules semi-développées de ces dipeptides
et nom. -
Leu–Leu : -
Leu – Gly :
-
Gly – Leu :
-
Gly – Gly :
b. Réaction entre la leucine et la glycine non
sélective. - Les deux fonctions de la leucine et de la glycine (fonction acide carboxylique et fonction amine) peuvent réagir.
La synthèse réalisée est non
sélective. 2.
a. Sites accepteur et donneur de doublet
d’électrons. - L’atome d’oxygène constitue un site riche en électrons : -
c’est un site donneur de doublet d’électrons
(présence de deux doublets d’électrons non liants). - L’atome de carbone du groupe acide carboxylique, est appauvri en électrons car il est moins électronégatif que l’atome d’oxygène et
constitue un site accepteur de doublet d’électrons. - L’atome d’azote de l’amine possède un doublet non liant. -
Il constitue un site donneur de doublet
d’électrons. - Les atomes d’hydrogène des groupes amine et acide carboxylique constituent des sites accepteurs de doublet d’électrons. -
L’atome d’hydrogène est
moins électronégatif que l’atome d’azote et que
l’atome d’oxygène. -
Cas de la glycine :
-
Cas de la leucine :
b. Sites qui doivent réagir pour conduire au
dipeptide souhaité. -
On veut former le dipeptide suivant : Leu –
Gly. -
La fonction acide carboxylique de la leucine
doit agir sur le groupe amine de la glycine. -
Les sites concernés sont :
-
L’atome de carbone du groupe carboxyle de la
leucine et l’atome d’azote du groupe amine de la
glycine. c. Mouvement des doublets d’électrons permettant d’expliquer la formation de la liaison peptidique. -
Un mécanisme possible : -
Première étape : -
Deuxième étape : -
Troisième étape : 3. Activation de la fonction acide carboxylique. - Un acide carboxylique réagit très lentement sur une amine. - Pour accélérer la réaction, on active la fonction acide carboxylique de la leucine. -
On
peut remplacer la fonction acide carboxylique
-
-
On remplace ainsi une réaction lente par une
réaction rapide et totale. -
Si la fonction acide carboxylique de la
leucine est activée, il n’est pas nécessaire de protéger la fonction acide de la glycine. 4.4. Fonction amide pour protéger une fonction
amine. -
On ne peut pas protéger une fonction amine
– NH2 en la remplaçant par
une fonction amide
car
lors de l’étape de déprotection, on va casser les
liaisons peptidiques formées. 5.5. Dans le cas de la synthèse d’un polypeptide,
justifier pourquoi il est nécessaire d’opérer de la
façon décrite dans le passage en italique. - Au sujet des groupes protecteurs : phrase en
italique : Idéalement, nous voulons deux groupes
que l’on puisse enlever dans des conditions
différentes, … -
Il est très utile de pouvoir enlever les
groupes protecteurs dans des conditions différentes, ainsi on peut garder la fonction acide bloquée
et
débloquer la fonction amine et inversement. -
Cela est très utile si l’on veut continuer la
réaction et ne pas se limiter à
l’obtention de
dipeptides. 6.
a. - « Le dipeptide Leu – Gly constitue l’extrémité d’une hormone peptidique, l’ocytocine : -
H2N – Cys – Tyr –
Ile – Gln – Asn – Cys – Pro – Leu – Gly –
CONH2 -
On part du dipeptide Leu – Gly. Pour
continuer la synthèse, il faut passer par
l‘intermédiaire suivant : -
Pro – Leu – Gly -
En conséquence, la fonction acide
carboxylique de la proline doit agir sur la fonction
amine de la leucine. -
Il faut donc déprotéger la fonction amine de
la leucine et activer la fonction
acide carboxylique
de la proline. b.
Formule topologique du tripeptide Pro – Leu –
Gly. -
Formule topologique : c. Les fonctions à protéger pour synthétiser ce
tripeptide. -
Pour obtenir le dipeptide Leu – Gly, il a
fallu protéger la fonction acide carboxylique de la
glycine et la fonction amine de la leucine. -
En conséquence, on garde la protection de la
fonction acide carboxylique de la glycine et on
protège la fonction amine de la proline pour éviter
la formation de Pro – Pro. -
On active aussi la fonction acide
carboxylique de la proline. 7.
a. Rendement final pour la synthèse de Leu –
Gly. -
La synthèse du dipeptide Leu – Gly comprend -
Deux étapes de protection, -
Une étape d’activation, -
Une étape de couplage, -
Et deux étapes de déprotection. -
La synthèse comprend 6 étapes. Le rendement
de chaque étape est de 90 %. -
Le rendement de la synthèse est égal au
produit des rendements des différentes étapes : -
ρ
= 0,906 -
ρ ≈ 0,53 -
ρ ≈ 53 % b. Rendement pour un polypeptide composé de dix
acides α–aminés. -
Les différentes étapes :
Nombre
d’acides
α–aminés 1 2 3 4 5 6 7 8 9 10
protection 2 1 1 1 1 1 1 1 1 1
activation 1 1 1 1 1 1 1 1 1 1
couplage 1 1 1 1 1 1 1 1 1 1
déprotection 1 1 1 1 1 1 1 1 2 -
Il y a en tout 41 étapes. -
ρ
= 0,9041 -
ρ ≈ 1,3
× 10–2 -
ρ ≈ 1,3 % c. Avantage de l’utilisation d’un polymère
insoluble, dans le procédé Merrifield, par rapport à
une synthèse classique en phase homogène. -
En utilisant le polymère insoluble, le
polypeptide reste fixé au solide. -
On peut plus
facilement le récupérer (par filtration) et le
purifier. 8.
-
La définition d’un groupe protecteur : -
Un groupe protecteur est un groupe
caractéristique, volontairement créé dans la
molécule d’un composé fonctionnel afin de bloquer la
réactivité de l’une de ses fonctions. -
Cette fonction, que l’on veut bloquer, est
temporairement transformée en une autre fonction. -
Les propriétés qu’il doit posséder : -
Le groupe protecteur doit : -
Réagir de manière sélective avec la fonction
à protéger ; -
Être stable lors des réactions suivantes ; -
Pouvoir être enlevé facilement et de manière
sélective, une fois la réaction effectuée. -
L’utilisation d’un groupe protecteur
nécessite au moins deux étapes
supplémentaires lors de la synthèse (protection et déprotection).
- Ces
deux étapes doivent s’effectuer avec un bon
rendement. |
2)- Exercices :
a)-
Exercice 5 page 506 : analyser un protocole : synthèse
d’un liquide.
b)-
Exercice 6 page 506 : analyser un protocole : synthèse
d’un solide.
c)-
Exercice 8 page 507 : savoir filtrer sous pression
réduite.
d)-
Exercice 11 page 507 : étudier la sélectivité d’une
réaction.
e)-
Exercice 12 page 508 : rendement d’une réaction
d’oxydation.
f)-
Exercice 13 page 508 : Un di-antalgique, le Salipran®.
g)-
Exercice 14 page 509 : Synthèse d’un médicament : la
benzocaïne.
|
|
















 est
symbolisée par les trois lettres
est
symbolisée par les trois lettres
 est symbolisée
par les trois lettres
est symbolisée
par les trois lettres





















 . Écrire la
formule topologique
. Écrire la
formule topologique










 par
la fonction chlorure d’acyle :
par
la fonction chlorure d’acyle :


