|
Chap. N° 07
|
Structure des entités organiques Cours |
|
|
|
|
|
I- Les familles des composés organiques. 1)- Modélisation des molécules. |
|
II- Le nom et la formule semi-développée. 1)- Évolution de la nomenclature. |
|
III- La spectroscopie infrarouge. |
|
1)- Nom de quelques molécules.
Les familles
des composés organiques.
Le nom et la
formule semi-développée.
La
spectroscopie infrarouge. |
|
Exercices : 1)-
Exercice 04 page 130 : Déterminer la formule brute d’une molécule. 2)-
Exercice 06 page 130 : écrire une formule semi-développée. 3)-
Exercice 07 page 130 : Identifier des groupes caractéristiques. 4)-
Exercice 08 page 130 : Nommer des groupes caractéristiques. 5)-
Exercice 09 page 131: Identifier des familles de composés. 6-
Exercice 11 page 131 : Corriger des noms de molécules. 7)-
Exercice 17 page 132 : Valider un procédé de synthèse. 8)-
Exercice 18 page 133 : Réaliser un contrôle de qualité. 9)-
Exercice 24 page 135 : La chimie des sucres. DS 01 (30 min) 10)-
Exercice 25 page 135 : Synthétiser un arôme de banane. DS 02 (30 min)
|
I- Les familles des composés organiques.
1)- Modélisation des molécules.
-
On peut modéliser une molécule de
plusieurs façons :
a)-
Le modèle moléculaire.
-
On peut représenter les molécules à
l’aide de modèles moléculaires.
-
Dans un modèle moléculaire, chaque
atome est modélisé par une boule de taille et de couleur déterminées.
-
Au lycée, on utilise le modèle compact
ou le modèle éclaté.
-
Modèle éclaté :
-
Chaque atome est représenté par une
sphère (une boule).
-
Les sphères sont liées les unes aux
autres par des tiges représentant les doublets de liaisons (les doublets liants)
ou les liaisons covalentes.
-
La longueur des tiges est
proportionnelle à la distance entre les noyaux des atomes liés entre eux.
-
Modèle compact :
-
Dans ce modèle, plus proche de la
réalité, les sphères sont en contact les unes avec les autres, mais on ne peut
pas distinguer le nombre de liaisons que deux atomes forment entre eux.
|
Élément
chimique |
H |
O |
N |
Cl |
C |
S |
|
Couleur |
Blanc |
Rouge
|
Bleu |
Vert |
Noir |
Jaune |
|
Représentation |
|
|
|
|
|
|
b)-
La formule brute :
-
La formule brute d’une molécule indique
la nature et le nombre des atomes constituant la molécule.
-
Elle ne donne aucune indication sur la
structure de la molécule : chaîne carbonée, groupe fonctionnel,…
-
Exemple :
|
Formule brute |
Indication |
|
C4H10 |
Butane ou isobutane ? |
|
C2H6O |
Alcool ou éther
oxyde ? |
c)-
La formule développée plane.
-
Elle indique l’enchaînement des atomes
et la nature des liaisons qui les unissent.
-
Les liaisons sont représentées par des
tirets entre les symboles des atomes.
-
Exemples :
|
Formule développée :
n-butane |
|
|
Formule développée :
éthanol |
|
-
Cette représentation est rapidement
difficile à manipuler quand la chaîne carbonée est importante.
d)-
Formule semi-développée.
-
Elle dérive de la formule développée.
-
Les liaisons sont représentées par des
tirets entre les symboles des atomes excepté celles engagées par les atomes
d’hydrogène.
-
Elle fait apparaître la chaîne
carbonée.
-
Elle ne fait pas apparaître les
liaisons entre un atome d’hydrogène et un autre atome.
-
Exemple : butane linéaire
|
Formule brute |
C4H10 |
|
Formule développée |
|
|
Formule semi-développée |
CH3 – CH2 – CH2 – CH3 ou
|
e)-
Formule topologique.
-
La chaîne carbonée est représentée sous
forme de ligne brisée.
-
Les atomes autres que de carbone
C et d’hydrogène
H sont
représentés de manière explicite ainsi que les atomes d’hydrogène
H qu’ils portent.
-
Exemples :
|
|
Formule topologique |
|
n-butane |
|
|
isobutane |
 |
|
Propan-1-ol |
|
f)-
L’acide lactique : utilisation de quatre
modèles :
-
Acide lactique : acide
2-hydroxypropanoïque
|
Modèle moléculaire |
|
|
Formule brute |
C3H6O3 |
|
Formule semi-développée |
Ou
|
|
Formule topologique |
|
2)- Groupes caractéristiques et famille de composés.
-
Dans une molécule, un groupe
caractéristique est un groupement spécifique d’atomes qui ne contient pas
uniquement des atomes de carbone C
et d’hydrogène H.
-
Un groupe caractéristique (ou
fonctionnel) confère des propriétés spécifiques aux molécules qui le possèdent.
-
Les composés ayant le même groupe
caractéristique appartiennent à une même famille et ils ont des propriétés
chimiques analogues.
-
Tableau de quelques groupes
caractéristiques :
|
Groupe caractéristique |
Famille de composés |
Formule générale |
|
– OH Hydroxyle |
Alcool |
R – OH |
|
Carbonyle |
aldéhyde |
|
|
Cétone |
|
|
|
Carboxyle |
Acide carboxylique |
|
-
Remarque :
-
Ne pas confondre le groupe hydroxyle
– OH
avec l’ion hydroxyde OH–.
-
L’acide lactique possède un groupe
hydroxyle – OH
et un groupe carboxyle
 .
.

3)- Identification de la géométrie d’une molécule
a)-
Introduction.
-
La géométrie des molécules organiques
influence leur réactivité. Il est important de la connaître.
-
L’atome de carbone impliqué dans un
groupe caractéristique est appelé, carbone fonctionnel.
-
Selon le groupe caractéristique auquel
il appartient un atome de carbone peut avoir différentes géométries.
-
Sa géométrie est liée au nombre
d’atomes voisins qu’il possède.
b)-
Les différentes structures de l'atome de carbone.
-
Le carbone tétragonal
:
-
Il échange 4 liaisons simples avec 4
atomes ou groupe d'atomes distincts.
-
Il possède 4 voisins.
-
On parle de carbone tétraédrique car
l'atome de carbone est situé au centre d'un tétraèdre.
-
Représentation conventionnelle :
notion de stéréochimie
|
Carbone tétragonal du carbone tétragonal. - Un trait plein représente une liaison entre deux atomes situés dans le plan de la figure. - Un triangle allongé représente une liaison entre un atome situé dans le plan de la figure et un atome situé en avant de ce plan. - Un trait pointillé représente une liaison entre un atome situé dans le plan de la figure et un atome situé en arrière de ce plan. |
|
Molécule de méthane. CH4
|
|
Cas des alcools : Exemple :le méthanol
|
L’atome de carbone possède 4 atomes
voisins. L’atome de carbone lié au groupement hydroxyle est le carbone fonctionnel Il est tétragonal. Dans un alcool, le groupe
hydroxyle – OH est lié à un atome de carbone
tétragonal. |
|
-
Le carbone trigonal :
-
Il échange 2 liaisons simples et une
double liaison.
-
Il possède 3 voisins.
-
Il se trouve au centre d'un triangle
dont les trois voisins occupent les sommets.
-
Représentation conventionnelle :
notion de stéréochimie
|
Carbone trigonal |
|
Propanone ou acétone
|
|
Cas des aldéhydes et des cétones Méthanal :
Propanone :
|
L’atome de carbone possède 3 atomes
voisins. Il est doublement lié à l’atome
d’oxygène C’est l’atome de carbone fonctionnel. L’atome de carbone appartenant au
groupe carbonyle
est un carbone trigonal. |
|
|
Cas des acides carboxyliques
|
Dans le cas de l’acide méthanoïque,
L’atome fonctionnel possède 3 atomes
voisins. L’atome de carbone appartenant au
groupe carboxyle est un carbone
trigonal. |
|
-
Le carbone digonal :
-
Il peut échanger soit une simple
liaison et une triple liaison soit deux doubles liaisons.
-
Il possède deux atomes voisins
distincts.
|
Carbone digonal |
Ou
|
Acétylène
Dioxyde de carbone
|
|
Molécule linéaire |
|
|
II- Le nom et la formule semi-développée.
1)- Évolution de la nomenclature.
-
Jusqu’au XIXe
siècle, le nom des entités organiques évoquait leur origine ou leurs propriétés.
-
Cette nomenclature n’était pas
internationale et des confusions pouvaient exister.
-
Ainsi, le méthanol était tour à tour
« alcool de bois», « esprit de bois », ou « alcool méthylique ».
-
Des chimistes se sont réunis lors de
commissions pour créer un langage nouveau tenant compte du squelette carboné et
des familles de composés responsables des propriétés chimiques.
-
En 1892, la commission de Genève a
élaboré 60 règles permettant de nommer les molécules organiques en construisant
leur nom en trois parties :
-
préfixe
– racine
– suffixe
-
La nomenclature a évolué mais cette
construction en trois parties demeure.
2)- Composition d’une molécule organique.
-
Les molécules organiques comportent
deux parties :
-
Un squelette carboné
-
Et un ou plusieurs groupes
caractéristiques.
-
Les molécules qui possèdent le même
groupe caractéristique ont des propriétés chimiques communes.
-
Ces propriétés chimiques communes
définissent une fonction chimique.
-
Une molécule organique comporte un
enchaînement d’atomes de carbone.
-
Cet enchaînement est appelé :
chaîne carbonée.
-
Cette chaîne carbonée peut être
linéaire, ramifiée ou cyclique.
-
Chaque molécule organique possède un
nom qui donne des informations :
-
Sur sa chaîne carbonée
-
Sur la famille de composé à laquelle
elle appartient.
-
Le nom des molécules organiques
oxygénées est le la forme :
préfixe
– racine
– suffixe
3)- Introduction à la nomenclature :
a)-
Le suffixe :
-
Le
suffixe
indique la famille de composés à laquelle appartient
l’espèce chimique.
-
Tableau de quelques familles de
composés :
|
Famille de composés |
alcool |
aldéhyde |
cétone |
acide carboxylique |
|
Suffixe |
ol |
al |
one |
oïque |
|
Formule générale |
R – OH |
|
|
|
-
Remarques :
-
R
représente un radical alkyle (type : –
CnH2n
+ 1)
-
Dans un alcool, l’atome de carbone, lié
au groupe hydroxyle, est tétragonal.
-
Ainsi le phénol n’appartient pas à la
famille des alcools car le carbone fonctionnel est trigonal.

- Les aldéhydes : Un aldéhyde est un composé carbonylé dont l’atome de carbone fonctionnel est lié à au moins un atome d’hydrogène.
- Les cétones : Une cétone est un composé carbonylé dont l’atome de carbone fonctionnel n'est lié qu’à des atomes de carbone.
-
Pour les acides carboxyliques, le nom
de la molécule commence par le mot acide.
-
Exemple :

-
Cette molécule possède le groupe
carbonyle.
-
Elle appartient à la famille des
cétone.
-
Le nom se termine par
one :
-
On utilise donc le suffixe :
one.
b)-
La racine :
-
La
racine
indique le nombre d’atomes de carbone C
de la chaîne principale.
-
Le carbone fonctionnel :
-
L’atome de
carbone fonctionnel
est celui qui appartient au groupe caractéristique ou qui est lié au groupe
hydroxyle.
-
La chaîne principale :
-
La chaîne principale est la chaîne
carbonée :
-
Qui comporte le
plus grand nombre d’atomes de carbone
-
Ainsi que l’atome de
carbone fonctionnel.
Cette chaîne est numérotée de telle
sorte que le numéro de l’atome fonctionnel soit le plus petit possible.
-
Exemple :
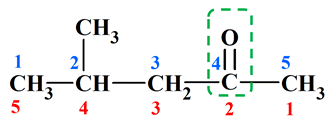
-
Il y deux numérotations possibles :
-
La bonne numérotation est celle de
couleur rouge.
-
Le carbone fonctionnel possède le
numéro 2.
(avec la numérotation de couleur bleue, il a le numéro
4)
-
Racine du nom suivant le nombre
d’atomes de carbone de la chaîne carbonée :
|
Nombre d’atomes de carbone |
Racine |
|
1 |
méthan- |
|
2 |
éthan- |
|
3 |
propan- |
|
4 |
butan- |
|
5 |
pentan- |
|
6 |
hexan- |
|
7 |
heptan- |
|
8 |
Octan- |
|
9 |
nonan- |
|
10 |
décan- |
|
11 |
undécan- |
|
12 |
dodécan- |
|
13 |
tridécan- |
|
14 |
tétradécan- |
|
15 |
pentadécan- |
|
16 |
hexadécan- |
|
17 |
heptadécan- |
|
18 |
octadécan- |
-
La chaîne principale de la molécule
comprend 5 atomes de carbone, le radical est :
-
« pentan- »
-
Exemple :

c)-
Le préfixe :
-
Un
préfixe
apparaît dans le nom si la chaîne principale est ramifiée par un ou plusieurs
groupes alkyles de formule générale – CnH2n+1.
-
Le
préfixe
indique la position et la nature du groupe alkyle.
-
Les 4 premiers groupes alkyles :
|
Groupe alkyle |
Nom |
|
–CH3 |
méthyl- |
|
–CH2–CH3 |
éthyl- |
|
–CH2–CH2–CH3 |
propyl- |
|
–CH2–CH2–CH2–CH3 |
butyl- |
-
Exemple :

-
Nom de la molécule :
-
4-méthylpentan-2-one
-
Remarque :
-
Si la chaîne carbonée porte plusieurs
groupes identiques, on utilise les préfixes :
di, tri, tétra…
III- La spectroscopie infrarouge.
1)- Présentation d’un spectre. )
-
La spectroscopie
IR est une
spectroscopie d’absorption.
-
Les composés organiques absorbent aussi
dans le domaine de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance
T ou intensité
lumineuse transmise par l’échantillon analysé en ordonnée (elle s’exprime en
pourcentage)
-
Le nombre d’ondes
σ en abscisse.
-
Le nombre d’ondes
σ est l’inverse de
la longueur d’onde λ.
-

-
Unité :
-
Généralement, le nombre d’ondes
σ
s’exprime en cm–1 en
chimie organique.
-
En chimie organique, les
radiations infrarouges exploitées vont de 400 cm–1
à 4000 cm–1. (25 μm à 250
μm)
-
Cette spectroscopie peut se faire en
phase gazeuse ou en phase condensée.
-
Exemple : Spectre de la propanone.
-
Remarque :
-
Une faible valeur de transmittance
correspond à une forte absorption.
-
Les bandes d’absorption sont orientées
vers le bas.
-
L’axe des abscisses est orienté vers la
gauche. Cette échelle n’est pas toujours linéaire.
-
On distingue deux zones principales
dans le spectre IR :
►
Le nombre d’onde compris
entre 1500 et 4000 cm–1.
-
Cette zone ne contient qu’un nombre
limité de bandes, correspondant à des types de liaisons particuliers.
-
Chaque bande est caractérisée par :
-
Sa position dans le spectre (la valeur
du nombre d’onde du minimum de transmittance,
-
Sa largeur (bande large ou fine),
-
Son intensité (faible, moyenne ou
forte), correspondant à la valeur minimale de la transmittance.
►
Le nombre d’onde compris
entre 400 et 1500 cm–1.
-
Il s’agit d’une zone très riche en
bandes d’absorption pour les molécules organiques possédant un ou plusieurs
atomes de carbone.
-
Elle est généralement exploitée qu’en
comparaison avec un spectre de référence.
-
Cette zone s’appelle l’empreinte
digitale de la molécule.
-
Dans un spectre infrarouge, la zone
d’identification des groupes caractéristiques correspond à :
σ >
1600 cm–1.
-
Les spectres
IR sont constitués
d’une série de bandes d’absorption.
-
Chaque bande d’absorption est associée
à un type de liaison, principalement caractérisé par les deux atomes liés et la
multiplicité de la liaison.
-
Un spectre infrarouge renseigne sur la
nature des liaisons présentes dans une molécule.
-
Les bandes d’absorption associées à
chacune des liaisons rencontrées en chimie organique correspondent à un domaine
de nombre d’ondes bien précis.
-
Une table des absorptions
caractéristiques des liaisons dans le domaine de l’IR
donne les fourchettes des nombres d’onde (souvent l’allure des bandes) pour
différents types de liaison.
-
Les spectres
IR sont liés au
fait que les atomes d’une molécule ne sont pas fixes, ils vibrent autour d’une
position d’équilibre.
-
Les vibrations peuvent correspondre à
une élongation longitudinale :

-
Les vibrations peuvent correspondre à
une déformation angulaire :

-
Les vibrations des liaisons d’une
molécule sont à l’origine de son spectre infrarouge.
-
Un spectre infrarouge renseigne sur la
nature des liaisons présentes dans une molécule et sur les groupes
caractéristiques qui sont présents dans la molécule.
4)- Bandes d’absorption caractéristiques.
-
Tableau simplifié :
|
Liaison |
σ
(cm–1) |
Intensité |
|
–
O –
Hlib |
3580 à 3650 |
Forte |
|
–
O –
Hlié ou
–
O –
Hassocié |
3200 à 3400 |
Forte |
|
|
3000 à 3100 |
Moyenne |
|
|
3030 à 3080 |
Moyenne |
|
Ctét – H |
2800 à 3000 |
Forte |
|
|
2750 à 2900 |
Moyenne |
|
–
O –
HAcide
carb |
2500 à 3200 |
Forte |
|
1650 à 1730 |
Forte |
|
|
|
1680 à 1710 |
Forte |
|
|
1415 à 1470 |
Forte |
|
|
1050 à 1450 |
Forte |
|
|
1000 à 1250 |
Forte |
-
Les notations :
-
L’intensité
traduit l’importance de l’absorption.
-
–
O –
Hlib
sans liaison hydrogène et
–
O –
Hlié
avec liaison hydrogène.
-
Ctri
correspond à un carbone trigonal engagé dans une double liaison.
-
Ctét
correspond à un carbone tétragonal engagé dans quatre liaisons simples.
►
Bande
C = O
-
La liaison
C = O est présente
dans de nombreuses molécules organiques telles que les aldéhydes, cétones, acide
carboxyliques, esters, amides,…
-
La position de la bande d’absorption
dépend de la nature de la fonction.
-
Elle est généralement
comprise entre 1650 cm–1
et 1750 cm–1.
-
Lorsque la liaison
C = O est conjuguée
à d’autres doubles liaisons, la liaison C = O
est affaiblie et le nombre d’onde
correspondant diminue.
►
Bande
C – O
-
La liaison
C – O est présente
dans les alcools, les acides carboxyliques,…
-
Sa bande d’absorption se
situe entre 1070 cm–1 et
1450 cm–1.
-
Tableau à connaître :
|
Liaison |
σ
(cm–1) |
Bande |
|
–O – H Alcool |
3200 – 3400 |
Bande forte et large |
|
–O – H Acide carboxylique |
2600 – 3200 |
Bande forte et large |
|
C = O Aldéhyde Cétone Acide carboxylique |
1700 – 1760 |
Bande forte et fine |
-
Une bande est forte lorsque la valeur
de la transmittance est faible.
-
Une bande est large si elle s’étale sur
un intervalle de nombre d’ondes important.
Groupe hydroxyle :

Groupe carbonyle :

Groupe carboxyle :

b)-
Exemples de spectres infrarouges :
►
Spectre
IR de l’éthanol :
-
Spectre de l’éthanol à l’état gazeux :
-
Spectre de l’éthanol à l’état liquide :
-
Ci-dessus, on peut observer les
spectres infrarouges de l’éthanol à l’état gazeux et à l’état liquide.
-
À l’état gazeux :
-
La liaison
O – H
donne une bande moyenne et fine vers 3620 cm–1.
-
Il n’existe pas de liaison hydrogène
entre les molécules d’éthanol, la liaison O –
H est dite libre, que l’on note
O – Hlib.
-
À l’état liquide :
-
La liaison
O – H
se manifeste par une bande d’absorption forte et large de 3200 cm–1
à 3400 cm–1.
-
Les liaisons hydrogène établies entre
les molécules d’éthanol affaiblissent les liaisons covalentes
O – H et conduisent
à un abaissement du nombre d’onde σO
– H.
-
De plus, la bande s’élargit, la liaison
O – H est
dans ce cas dite associée, on la note O – Hassocié
ou O – Hlié.
-
Ce résultat est général.
►
Cas de la propanone :
-
Les liaisons
C – H
donnent une bande large et moyenne de 2800 cm–1
à 3100 cm–1.
-
La double liaison
C = O
donne une bande fine et forte vers 1700 cm–1.
►
Acide éthanoïque :
-
Les liaisons
O – H
donnent une bande large et forte de 2500 cm–1
à 3200 cm–1.
- Pour les acides carboxyliques en solution concentrée, les molécules s’associent sous forme de dimères grâce à des liaisons hydrogène.
- On note un affaiblissement important des liaisons
– O – H.
-
La bande d’absorption relative aux
liaisons – O – H
se situe autour du nombre d’onde σ ≈ 3000 cm–1.
-
Cette bande est caractéristique d’un
acide carboxylique.
-
La double liaison
C = O
donne une bande fine et forte vers 1700 cm–1.
1)- Nom de quelques molécules.
a)-
Nommer les molécules suivantes et indiquer à
quelle famille elles appartiennent.
|
|
Molécule |
Nom |
|
a. |
|
......................... |
|
|
CH3
– CH2 –
CH2 – CH2 – OH |
......................... |
|
b. |
|
|
|
c. |
|
......................... |
|
d. |
|
......................... |
b)-
Nommer les molécules suivantes et indiquer à
quelle famille elles appartiennent.
|
|
Molécule et nom |
Famille |
|
a. |
|
|
|
b. |
|
........ |
|
c. |
|
........ |
|
d. |
|
........ |
|
e. |
|
........ |
c)-
Nommer les molécules suivantes et indiquer à quelle
famille elles appartiennent.
|
|
Molécule et nom |
Famille |
|
a. |
|
.................... |
|
b. |
|
.................... |
|
c. |
|
.................... |
|
d. |
|
.................... |
|
e. |
... |
.................... |
Les familles
des composés organiques.
Le nom et la
formule semi-développée.
La
spectroscopie infrarouge.
|
1)-
Exercice 04 page 130 : Déterminer la formule brute d’une molécule. 2)-
Exercice 06 page 130 : écrire une formule semi-développée. 3)-
Exercice 07 page 130 : Identifier des groupes caractéristiques. 4)-
Exercice 08 page 130 : Nommer des groupes caractéristiques. 5)-
Exercice 09 page 131: Identifier des familles de composés. 6-
Exercice 11 page 131 : Corriger des noms de molécules. 7)-
Exercice 17 page 132 : Valider un procédé de synthèse. 8)-
Exercice 18 page 133 : Réaliser un contrôle de qualité. 9)-
Exercice 24 page 135 : La chimie des sucres. DS 01 (30 min) 10)-
Exercice 25 page 135 : Synthétiser un arôme de banane. DS 02 (30 min)
|