|
Chap. N° 17 |
Une chimie du développement durable. Cours. |
|
|
1)- Les
principes de la chimie durable.
|
|
2)- Les
bioplastiques biosourcés. |
|
VI- Le
biodiesel : un agrocarburant. |
|
1)-
Étude d’un texte scientifique. |
|
En travaux a)- Exercice 5 page 452 : comprendre les enjeux de la chimie durable. b)- Exercice 7 page 452 : utiliser des solvants alternatifs. c)- Exercice 8 page 452 : limiter les sources de pollution. d)- Exercice 9 page 453 : réduire l’émission de gaz à effet de serre. e)- Exercice 11 page 453 : recycler les déchets. f)- Exercice 12 page 454 : privilégier les ressources naturelles. g)- Exercice 13 page 454 : capter le dioxyde de carbone. h)- Exercice 15 page 455 : valoriser les déchets. i)- Exercice 16 page 456 : limiter l’usage des solvants. |
1)- Les principes de la chimie
durable.
a)-
Définition :
- La chimie durable s’inscrit dans une logique de développement durable.
- Sa mise en œuvre
industrielle veille à l’équilibre social, environnemental et
économique :
-
Économiser et partager les
ressources de manière équitable
-
Utiliser des technologies qui
polluent moins et consomment moins d’énergie.
-
Développer des procédés
suffisamment efficaces et rentables.
b)-
La chimie : Un paradoxe sociétal.
-
La chimie est pour beaucoup un
paradoxe : symbole à la fois de progrès et de pollution ou de
danger.
-
Pourtant, pour leur survie et le
confort, les sociétés ont de plus en plus besoins de produits
chimiques pour :
-
Se nourrir,
-
Le traitement de l’eau afin de la
rendre potable,
-
Produire des médicaments pour se
soigner,
-
Produire de l’énergie,
-
La chimie est durable si sa mise
en œuvre industrielle veille à l’équilibre social,
environnemental et économique.
c)-
La chimie : un enjeu économique.
-
L’industrie chimique mondiale
génère environ 2000 milliards d’euros de chiffre d’affaires par
an (autour de 80 milliards en France en 2010) et des millions
d’emplois (plus de 17000 en France en 2010, sans compter les
emplois directs liés aux produits de l’industrie chimique).
-
Les ressources de notre planète
ne sont pas infinies et la capacité de la Terre à assimiler nos
déchets à atteint ses limites.
-
La chimie doit se réinventer et
entrer dans une nouvelle ère : l’ère de la chimie verte.
-
La chimie verte a pour but de
limiter l’impact négatif de la chimie sur l’environnement ainsi
que sur la santé des consommateurs et des travailleurs œuvrant
dans l’industrie chimique.
- Chimie verte et chimie durable sont souvent confondues :
- Une chimie verte s’inscrit dans une
chimie durable quand elle tient compte des aspects sociaux et
économiques.
-
Le développement durable est une
synthèse entre l’économie (produire), le social (répartir) et
l’environnement (préserver).
-
Il doit répondre aux besoins du
présent sans compromettre la capacité des générations future à
satisfaire leurs propres besoins.
►
La chimie verte :
-
La chimie verte se propose d’agir
sur cinq domaines : les matières premières, les solvants,
l’énergie, les déchets et le produit fini.
-
La chimie verte prend en compte
la gestion : des solvants, des matières premières, de l’énergie,
du produit fini et des déchets.
- Les solvants :
- Utiliser des
solvants non toxiques et non polluants.
- Les matières premières :
- Limiter
les quantités, économiser les atomes en valorisant toutes les
molécules, préférer les réactions chimiques les moins
dangereuses et les matières premières renouvelables.
- L’énergie :
- Limiter les dépenses
énergétiques, rechercher de nouvelles sources d’énergie à faible
teneur en carbone, utiliser des conditions opératoires douces
(catalyseur, faible température, basse pression)
- Le produit fini :
- Concevoir un
produit chimique présentant le moins de dangers possibles,
concevoir un produit chimique en vue de sa dégradation.
- Les déchets :
- Limiter la
production de déchets, valoriser ou recycler les déchets.
► La chimie verte est fondée sur 12
principes :
-
1. Limiter la pollution à la
source,
-
2. Économiser les atomes,
-
3. Travailler avec des conditions
opératoires sûres,
-
4. Concevoir des produits sûrs,
-
5. Rechercher des solvants
alternatifs,
-
6. Économiser l’énergie,
-
7. Privilégier les ressources
renouvelables,
-
8. Réduire les déchets,
-
9. Préférer les réactions
catalysées,
-
10. Concevoir les produits
dégradables,
-
11. Analyser en temps réel pour
prévenir la pollution,
-
12. Réduire les risques
accidents.
► La chimie du végétal :
-
C’est une partie très importante
de la chimie verte.
-
Elle s’oriente vers l’utilisation
des matières premières végétales.
► La chimie douce :
-
Elle aussi est une partie
importante de la chimie verte.
- Elle a pour ambition de synthétiser des matériaux en s’inspirant du vivant et en mettant en jeu des conditions opératoires plus douces :
- Température
modérée, pression atmosphérique plus basse,…)
-
Le terme bioplastique recouvre
deux réalités distinctes selon qu’est prise en compte la
ressource ou la fin de vie.
-
On appelle bioplastiques :
-
Les plastiques issus de matières
premières végétales.
-
Les plastiques biodégradables
issus de matières premières fossiles.
2)- Les bioplastiques biosourcés.
- Les plastiques biosourcés sont issus de matières premières végétales (maïs, ricin, colza).
- Ils
ont des performances similaires aux plastiques issus du pétrole.
- Leur intérêt provient du caractère renouvelable des ressources utilisées ainsi qu’un bilan carbone réduit.
- Grâce à la synthèse chlorophyllienne, les
plantes utilisées comme matières premières végétales consomme le
dioxyde de carbone qui est un gaz à effet de serre.
-
D’autre part, il faut tenir
compte des faits suivants :
-
Le développement des
agroressources peut entrer en concurrence avec les cultures
destinées à l’alimentation.
-
L’impact environnemental doit
être étudié en prenant en compte l’intégralité du processus de
production (engrais, eau d’irrigation,…).
-
Certains bioplastiques ne sont
pas biodégradables.
3)- Les bioplastiques
biodégradables.
-
On qualifie de biodégradables,
des plastiques biodégradables qu’ils soient issus de matières
premières fossiles ou renouvelables.
![]() Rechercher
la définition des mots et expressions suivantes :
Rechercher
la définition des mots et expressions suivantes :
-
Bilan carbone,
-
Matières premières fossiles ou
renouvelables,
-
Ressources vivrières,
-
Matériau compostable.
► Réponses :
- Bilan carbone :
- Outil de
comptabilisation des émissions de gaz à effet de serre.
- Matières premières fossiles :
- Ressources naturelles non renouvelables (comme le pétrole), car
le renouvellement nécessite des centaines de millions d’années.
- Matières premières renouvelables :
- Ressources
non tarissables, car leur vitesse de renouvellement est
plus grande que leur vitesse de disparition.
- Ressources vivrières :
- Ressources
issues d’une agriculture essentiellement tournée vers
l’autoconsommation et l’économie de subsistance.
- Matériau compostable :
- Matériau
pouvant être dégradé par des micro-organismes (champignons
microscopiques et bactéries)
III-
Une
chimie douce bio-inspirée.
-
Le concept de chimie douce a pour
ambition de synthétiser des matériaux en s’inspirant du vivant.
2)- Un exemple : construction d’un
réseau de silice.
a)-
Documents :
|
Industriellement, les verres sont obtenus en chauffant du sable à très haute température aux alentours de 1500 °C. Dans la nature, des micro-organismes fabriquent ces matériaux à température ambiante, avec des performances souvent supérieures à celle de verre
industriel. Les diatomées, algues unicellulaires, s’entourent d’un exosquelette de silice SiO2, nommé frustule, dont la structure est similaire à celle du verre. Cette carapace est élaborée à partir de la silice dissoute dans l’eau sous forme d’acide silicique Si(OH)4, édifice tétraédrique (voir ci-contre). Grâce à des enzymes, la diatomée élimine une molécule d’eau entre deux tétraèdres pour les lier. À mesure que les tétraèdres s’associent, du « verre » est formé. Les chimistes ont reproduit cette synthèse à partir de précurseurs d’acide silicique tels que les TMOS (tétraméthoxysilane)
Si(OCH3)4. Une hydrolyse donne d’abord les dérivés hydroxylés. Puis une polymérisation conduit à des espèces colloïdales qui forment des « sols » (solide dispersé dans une phase liquide). Le liquide finit par former un « gel » (liquide dispersé dans une phase solide) ; d’où le nom de procédé « sol-gel » donné à cette
technique. Le produit obtenu est un gel de silice hydraté (SiO2, n H2O).Utilisé sous cette forme, la matrice sol-gel peut servir à emprisonner et transporter des médicaments ou des enzymes à vertu thérapeutique dans le corps humain. Le gel ne permet pas d’élaborer un verre massif, car l’élimination d’eau conduit à une poudre. En revanche, par extrusion à température ambiante, il est possible d’obtenir des fibres de silice qui ont, par exemple, été utilisées dans les tuiles réfractaires de la navette Colombia. Ces réactions, effectuées à température ambiante, peuvent être contrôlées, étape par étape, jusqu’au produit final : des matériaux répondant à des besoins spécifiques peuvent donc
être ainsi fabriqués. |
Les diatomées élaborent des carapaces de silice. Construction d’un réseau de silice |
a)-
Questions :
-
Qu’est-ce que la chimie douce ?
Pourquoi la nomme-t-on ainsi ?
-
Rechercher des mots suivants
trouvés dans le texte : unicellulaires, exosquelette,
polymérisation, colloïdales, extrusion.
-
Écrire l’équation de la réaction
globale conduisant à la silice à partir de l’acide silicique.
-
Écrire l’équation d’hydrolyse de
TMOS.
-
Les précurseurs utilisés peuvent
être aussi les TEOS (tétraéthoxysilane) : écrire leur
formule.
-
Dans le cadre de la chimie verte,
expliquer pourquoi cette technique est un gain en termes
d’énergie et de produit fini.
b)-
Réponses :
-
La chimie douce : Elle aussi est
une partie importante de la chimie verte.
- Elle a pour ambition de synthétiser des matériaux en s’inspirant du vivant et en mettant en jeu des conditions opératoires plus douces :
- Température
modérée, pression atmosphérique plus basse,…)
-
Les mots :
-
Algue unicellulaire : algue
formée d’une seule cellule.
-
Exosquelette : squelette externe
qui protège un animal.
-
Réaction de polymérisation :
c’est une réaction qui conduit à un polymère à partir d’un motif
élémentaire le monomère.
- Espèces colloïdales : c’est, une dispersion dans un solvant liquide, d’un soluté formé de particules de petites tailles (quelques nm à quelques mm).
- Ce
peut être aussi un agrégat de petites molécules (micelles).
- Extrusion :
- Procédé par lequel un
matériau compressé est contraint de traverser une filière ayant
la forme de la pièce à obtenir dans le but de former un produit
long (tube, tuyau, profilé,…)
-
Équation
de la réaction globale conduisant à la silice à partir de
l’acide silicique :
Si(OH)4
→ SiO2 +
2 H2O
-
Équation d’hydrolyse de
TMOS :
Si(OCH3)4
+ 2 H2O
→ Si(OH)4
+ 4 HOCH3
-
Formule des précurseurs
TEOS (tétraéthoxysilane) :
-
Si(OC2H5)4
-
Gain en termes d’énergie et de
produit fini de la chimie verte :
- Gain d’énergie car la synthèse s’effectue à température ambiante.
- Il n’est pas nécessaire de
chauffer.
-
Gain en termes de produit fini :
le verre obtenu répond à des besoins spécifiques avec des
performances souvent supérieures à celles du verre industriel.
-
Les solvants traditionnels sont :
l’eau et les solvants organiques.
-
Parmi les solvants organiques, on
distingue :
-
Les solvants oxygénés : alcools,
cétones, esters, éthers.
-
Les hydrocarbures : alcanes,
composés aromatiques, …
-
Les solvants halogénés : les
composés chlorés, les composés bromés, …
►
Remarque :
- L’eau mise à part, aucun solvant n’est inoffensif.
- Ils ont un impact non négligeable sur les
organismes vivants et peuvent être cancérigènes, mutagènes ou
reprotoxiques (CMR) lorsque l’exposition est régulière.
-
Les solvants représentent près du
tiers des composés organiques volatils (COV) émis dans
l’atmosphère.
► Tableau :
2)- Solvants d’origine végétale.
-
La substitution des solvants
organiques usuels par des solvants d’origine végétale, appelés
agrosolvants, constitue une alternative à l’épuisement du
pétrole, mais aussi l’un des moyens de diminuer les dangers pour
la santé et de réduire les coûts du recyclage.
►
Un exemple :
-
Par exemple, les esters
méthyliques d’acides gras (EMAG) sont obtenus par
réaction entre le méthanol et l’acide gras provenant des huiles
végétales.
-
L’oléate de méthyle est ainsi
obtenu à partir de l’acide oléique du colza ou du soja :
-
Acide oléique :
C18H34O2
-
Oléate de méthyle :
C19H36O2
- Les EMGA ont une température d’ébullition relativement élevée (supérieure à 330 °C pour les EMGA de l’huile de colza ou de soja).
- Leur
concentration dans la zone respiratoire d’un travailleur est
ainsi inférieure à 3,0 mg / m3.
- Les EMGA irritent peu la peau et les voies respiratoires.
- Ils sont biodégradables.
- Seul le
laurate de méthyle, préparé à partir de l'huile de coprah
présenterait une toxicité aquatique préoccupante.
-
Laurate de méthyle :
C13H26O2
-
Bien que combustibles, ils sont
pratiquement ininflammables.
-
Enfin, les émulsions à l’eau de
ces esters peuvent diminuer la viscosité et l’aspect gras qui
leur sont reprochés.
-
Toutefois, la production des
huiles végétales utilisées dans la fabrication des
EMGA
est préoccupante en raison notamment de l’eutrophisation
engendrée par la culture des plantes oléagineuses.
-
À quelles familles chimiques
appartient chaque solvant répertorié dans le tableau précédent ?
Rechercher leurs dangers respectifs.
-
En utilisant les formules
topologiques, écrire l’équation d’hydrolyse de l’oléate de
méthyle, susceptible de se produire dans l’environnement.
-
Le méthanol obtenu est-il
dangereux ? Commenter.
-
Justifier que l’ester contribue à
une réduction des émissions de COV.
-
Pourquoi l’ester a-t-il un aspect
gras ? Pourquoi
est-il un bon solvant pour les graisses ? Pourquoi cette
molécule forme-t-elle une émulsion avec l’eau ? Justifier.
-
Quel est l’intérêt de remplacer
les solvants pétrochimiques par des agrosolvants ?
► Étude du tableau sur les
solvants :
-
Acétone : composé organique
oxygénée : c’est une cétone.
-
Heptane : hydrocarbure : alcane
non cyclique.
-
Toluène : composé aromatique,
comprend un noyau benzénique.
-
Dichlorométhane : composé
halogéné, halogénoalcane.
► Dangers respectifs
-
H225 : Liquide et vapeurs très
inflammables.
-
H319 : Provoque une sévère
irritation des yeux.
-
H336 : Peut provoquer somnolence
ou vertiges.
-
H304 : Peut être mortel en cas
d’ingestion et de pénétration dans les voies respiratoires.
-
H315 : Provoque une irritation
cutanée.
-
H410 : Très toxique pour les
organismes aquatiques, entraîne des effets à long terme.
-
H361d : Susceptible de nuire au
fœtus.
-
H373 : Risque présumé d’effets
graves pour les organes (indiquer tous les organes affectés,
s’ils sont connus) à la suite d’expositions répétées ou d’une
exposition prolongée (indiquer la voie d’exposition s’il est
formellement prouvé qu’aucune autre voie d’exposition ne conduit
au même danger).
-
H351 : Susceptible de provoquer
le cancer (indiquer la voie d’exposition s’il est formellement
prouvé qu’aucune autre voie d’exposition ne conduit au même
danger).
► Équation d’hydrolyse de l’oléate
de méthyle :
► Cas du méthanol :
|
|
|
|
Inhalation |
Toxique et peut être mortelle. |
|
Peau |
Assèchement |
|
Yeux |
Dangereux, Rend aveugle. |
- Le méthanol, obtenu par hydrolyse de l’oléate de méthyle s’avère particulièrement dangereux.
- Lorsque le texte annonce que
l’oléate de méthyle est biodégradable, cela ne tient pas compte
de la toxicité du produit de dégradation.
► Réduction des émissions de
COV :
-
Composés organiques volatils :
COV
-
Les esters méthyliques d’acides
gras (EMAG) sont très peu volatiles, ils ont une
température d’ébullition relativement élevée (supérieure à 330
°C pour les EMGA de l’huile de colza ou de soja).
► Étude de l’ester :
- L’ester possède une longue chaîne carbonée, il est lipophile.
- Il aime les graisses qu’il peut
dissoudre.
- D’autre part, l’ester possède une extrémité hydrophile.
- Il peut former des émulsions avec l’eau.
► Solvants pétrochimiques et
agrosolvants :
-
Certains principes de la chimie
verte sont respectés :
-
3. Travailler avec des conditions
opératoires sûres,
-
5. Rechercher des solvants
alternatifs,
-
7. Privilégier les ressources
renouvelables,
-
8. Réduire les déchets,
-
10. Concevoir les produits
dégradables,
-
12. Réduire les risques
accidents.
V-
Oxydation hydrothermale par l’eau supercritique.
-
L’eau peut se présenter sous
trois états physiques (solide, liquide gazeux) en fonction de la
température et de la pression.
-
Cependant, au-delà d’une
température et d’une pression bien précises, caractérisant un
point critique, l’eau entre dans son état supercritique où elle
acquiert des propriétés intermédiaires entre celles du liquide
et celles du gaz.
► Diagramme de phase de l’eau :
- Dans ce domaine, souvent décrit comme la coexistence de domaines liquides et gazeux, il apparaît des fluctuations de densité qui sont probablement à l’origine des propriétés particulières du fluide.
- Aussi dense qu’un liquide, il possède une bonne capacité de solvatation.
- Sa faible
viscosité associée à une
diffusion moléculaire
élevée, facilite le transport de matière.
-
L’eau supercritique peut agir à
la fois comme
solvant polaire
et le plus étonnant, comme
solvant apolaire.
-
Le traitement des déchets
organiques toxiques peut être réalisé avec de l’eau
supercritique.
-
Ce procédé repose sur la
solubilisation des composés organiques et du dioxygène dans
l’eau supercritique.
-
Les réactions d’oxydation sont
alors favorisées et deviennent rapides et quasi totales.
-
Les composés organiques sont
alors transformés majoritairement en dioxyde de carbone :
► Principe de l’oxydation
hydrothermale (d’après S. SARRADE)

-
Lorsque l’eau est ramenée à
l’état liquide, les éléments métalliques, les minéraux les
hétéroatomes (Cl,
N,
S, etc.) se retrouvent
dans la phase aqueuse, soit sous forme dissoute, soit sous forme
de précipités.
-
Ainsi confinés en phase aqueuse,
ils sont traités par des procédés physico-chimiques classiques (floculation,
décantation, filtration, etc.)
-
Ce procédé d’oxydation
hydrothermale permet l’élimination des déchets à relativement
basse température, et ne produit ni oxydes d’azote
NOx,
ni oxydes de soufre SOx, contrairement aux
incinérateurs classiques.
-
Rechercher le sens des mots et
expressions suivantes : diffusion moléculaire, solvant polaire,
solvant apolaire, floculation, décantation, filtration
-
Dans le diagramme de phase de
l’eau, que représente le « Point triple » ? Donner ses
caractéristiques. Déterminer le domaine d’existence de l’eau
supercritique.
-
Pourquoi la solubilisation
permet-elle d’accélérer les réactions d’oxydation ?
-
Comment l’eau supercritique
peut-elle être ramenée à l’état liquide ?
-
Qu’entend-on par « forme
dissoute » pour les minéraux ou les éléments métalliques ?
-
L’oxydation du dichlorométhane
CH2Cl2 dans l’eau supercritique
donne du dioxyde de carbone, de l’eau et un gaz hydrochloré
soluble dans l’eau. Écrire l’équation de cette oxydation. Écrire
l’équation de dissolution du gaz hydrochloré.
-
Le dioxyde de carbone peut être
valorisé en l’utilisant comme fluide supercritique : en
rechercher les usages.
► Sens des mots et expressions
suivantes :
-
Diffusion moléculaire : migration
des molécules sous l’effet de l’agitation thermique.
-
Solvant polaire : solvant
constitué de molécules qui possèdent un moment dipolaire non nul.
-
Exemple : la molécule d’eau
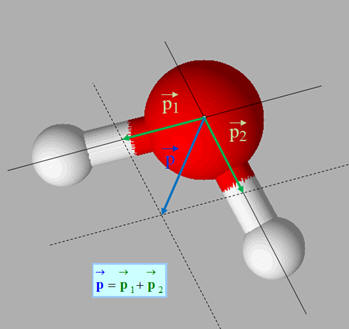
-
Solvant apolaire : solvant
constitué de molécules qui possèdent un moment dipolaire nul.
- Exemple :
- La molécule de
tétrachlorure de carbone est apolaire bien que la liaison
C –
Cl soit polarisée.
-
Floculation : phénomène au cours
duquel les matières en suspension forment des flocons par ajout
d’un floculant.
-
Décantation : séparation sous
l’effet de la gravitation de plusieurs phases non miscibles,
dont l’une au moins est liquide.

-
Filtration : séparation d’un
mélange solide – liquide au travers d’un milieu poreux.

► Le point triple de l’eau :
-
C’est le point du diagramme où
coexistent les trois états physiques : solide, liquide et
gazeux.
-
Caractéristiques du point triple
de l’eau : Tt = 273,16 K,
Pt
= 0,006 bar
-
Domaine d’existence de l’eau
supercritique : TC > 374 K et
PC
= 221 bar
► Solubilisation et réaction
d’oxydation :
-
Grâce à la solubilisation, il y a
contact entre l’eau et les solutés.
-
L’eau supercritique peut être
ramenée à l’état liquide en abaissant la température et la
pression.
► Forme dissoute :
-
Les métaux et les minéraux sont
sous forme d’ions. Les ions sont solubles d’eau qui est un
solvant polaire.
► L’oxydation du dichlorométhane
CH2Cl2 :
-
Équation de cette oxydation :
CH2Cl2
+
O2
+ H2O
→ CO2
+ H2O
+ 2 HCl
-
Équation de dissolution du gaz
hydrochloré :
HCl (aq)
+
H2O
(ℓ) →
H3O+
(aq) +
Cl–
(aq)
► Revalorisation du dioxyde de
carbone :
- Le dioxyde supercritique peut être utilisé comme solvant (extraction de la caféine du café ;
- élimination de la 2,4,6-trichloroanisole (TCA) des bouchons de liège pour supprimer le goût bouchonné au vin ;
- extraction de composés
biologiques) ou pour le transport et le stockage
lors de la
séquestration
géologique du dioxyde de carbone.
VI-
Le biodiesel : un agrocarburant.
-
Le biodiesel est un carburant de
première génération produit à partir d’huile générale.
-
Dans un contexte d’accroissement
des émissions de gaz à effet de serre, d’augmentation du prix du
pétrole et de difficulté d’approvisionnement en ressources
énergétiques, le biodiesel peut-il être une alternative ?
2)- Le biodiesel est-il durable ?
- Le biodiesel est obtenu à partir du colza, du tournesol, etc.
- Il est mélangé à 7 % en volume avec
le gazole d’origine fossile.
-
L’utilisation des biodiesels
pourrait permettre de réduire les émissions de gaz à effet de
serre (GES) jusqu’à 50 % (du puits à la roue) par rapport aux
combustibles fossiles dans lesquels ils sont incorporés.
-
De même, leur efficacité
énergétique serait de 2,2, en tenant compte d’une valorisation
optimale des coproduits (tourteaux et glycérol) obtenus lors de
la production des biocarburants.
-
Les tourteaux peuvent être
utilisés dans l’alimentation animale et le glycérol dans
l’industrie chimique.
-
En outre, pour obtenir une
économie significative d’énergie, les résidus de culture
(paille) pourraient être utilisés pour produire de l’énergie qui
serait réinjectée dans le processus de fabrication des
biocarburants.
-
Malheureusement, cette efficacité
énergétique est limitée en raison des faibles rendements à
l’hectare des cultures telles que celle du colza.
► Efficacité énergétique (EE) :
-
L’efficacité énergétique du
biodiesel est le rapport entre l’énergie contenue dans le
biodiesel et l’énergie non renouvelable primaire dépensée de la
culture à la livraison.
-
Le biodiesel se présente
actuellement sous forme d’ester méthyliques d’huiles végétales (EMHV)
-
L’ester éthylique (EEHV)
est obtenu par transestérification d’une huile végétale avec le
méthanol.
-
Exemple : le linoléate de
glycéryle est l’un des triesters de l’huile de colza.

-
Les recherches actuelles tendent
à montrer que l’EEHV aurait un comportement tout à fait
comparable à l’EMHV.
► Protocole expérimental :
|
Protocole expérimental :
|
-
Que signifient les expressions
suivantes : le gazole d’origine fossile, gaz à effet de serre,
du puits à la roue, tourteaux.
-
Qu’est-ce qu’une
transestérification ?
-
L’un des produits est le
glycérol : rechercher sa formule semi-développée et quelques
exemples d’utilisation. Écrire l’équation de la réaction.
-
Préciser l’intérêt du chauffage à
reflux.
-
Schématiser et légender le
montage.
-
À partir du tableau ci-dessous :
-
Justifier pourquoi l’éthanol est
introduit en excès ;
-
Commenter le protocole
d’extraction de l’EEHV.
|
|
Huile de colza |
Éthanol |
EEHV |
Glycérol |
|
Éthanol |
Miscible |
Miscible |
Miscible |
Miscible |
|
EEHV |
Miscible |
Miscible |
Miscible |
Miscible |
|
Eau salée |
Non Miscible |
Miscible |
Non Miscible |
Miscible |
► Expressions
suivantes :
-
Le gazole d’origine fossile :
gazole obtenu à partir du pétrole brut.
- Gaz à effet de serre : gaz absorbant les rayonnements IR émis par la surface terrestre et contribuant à l’effet de serre.
- L’augmentation de leur
concentration dans
l’atmosphère terrestre
serait à l’origine du réchauffement climatique récent.
- Du puits à la roue :
- Le calcul
des émissions de GES (du puits à la roue) prend en compte les
émissions de GES non seulement au niveau des gaz à échappement
(du réservoir à la roue) mais également au niveau de la
production des carburants (du puits au réservoir).
-
Tourteaux : résidu obtenu après
pressage des graines des oléagineux.
► Une transestérification :
-
Synthèse d’un ester à partir d’un
autre ester et d’un alcool.
► Le glycérol :
-
Le glycérol est un trialcool : le
propan-1, 2,3 -triol
-
Formule :

-
Utilisation :
- Le glycérol est un sous-produit de la saponification.
- On peut le récupérer par distillation.
-
Il est utilisé dans les
médicaments (suppositoires, sirops, etc.), en cosmétique (agent
hydratant), dans l’alimentation (émulsifiant, humectant, etc.).
-
Équation de la réaction :
transestérification à partir de l’éthanol

►
Le chauffage à reflux :
- On chauffe pour accélérer la réaction qui est lente à température ambiante.
- On chauffe aussi
pour rendre le milieu réactionnel plus homogène.
-
Le chauffage à reflux permet de
chauffer tout en évitant les pertes par évaporation.
-
Ce montage permet de maintenir le
milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant.
-
Les vapeurs sont condensées dans
le réfrigérant et retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits
restent dans le milieu réactionnel.
-
Il permet d’accélérer la réaction
sans perte de matière.
►
Schéma du montage :
|
Chauffage à Reflux
|
1–
Colonne réfrigérante
2– Ballon
3– Chauffe-ballon
4– Sortie de l’eau
5– Arrivée de l’eau
6– Mélange réactionnel
7– Vallet |
► Exploitation du tableau :
-
Éthanol introduit en excès :
- L’éthanol est introduit en excès, car il joue également le rôle de solvant afin que les réactifs soient en contact ;
- La réaction s’effectue ainsi en milieu
homogène.
-
Protocole d’extraction :
- Le relargage à l’eau salée permet d’éliminer l’éthanol et le glycérol de la phase organique (ainsi que la potasse) :
- On récupère alors l’EEHV qui n’est pas
miscible dans l’eau salée.
-
On est en présence d’une phase
aqueuse et d’une phase organique qui surnage.
1)- Étude d’un texte scientifique.
-
Certains chercheurs utilisent
« l’énergie des micro-ondes produites par des fours domestiques
comme mode de chauffage d’un milieu réactionnel[…]
-
[La fréquence] des ondes
produites par les fours à micro-ondes [est égale à ] 2450 MHz
[…]
-
Les micro-ondes pénètrent de
façon assez considérable dans la matière, et peuvent donc
augmenter l’agitation thermique au sein d’un matériau sans
passer par le biais de la
conduction thermique.
-
De la tasse froide récupérée
en fin de chauffage, jusqu’à ce que la conduction thermique ait
finalement le temps de s’établir.
-
En particulier, le chauffage par
micro-ondes permet une
activation thermique
[…] de façon très rapide.
-
Ceci permet de limiter lors du
chauffage du milieu réactionnel, les réactions parasites qui
diminuent les rendements de réaction. »
D’après C. Bureau et M. De
Franceschi
Des teintures égyptiennes aux
micro-ondes. ELLIPSES. 1998
-
Calculer la longueur d’onde, dans
le vide, des micro-ondes. S’agit-il d’ondes micrométriques ?
Rechercher pourquoi le terme « micro » a été donné à ces ondes.
-
Expliquer les expressions
suivantes : conduction thermique, activation thermique
-
En termes énergétiques, quel
avantage présente les micro-ondes par rapport au chauffage
traditionnel ?
-
Expliquer pourquoi l’utilisation
des micro-ondes est un gain en termes de déchets.
►
Longueur d’onde, dans le vide,
des micro-ondes :
-

- Le préfixe « micro- » est utilisé pour des ordres de grandeurs de l’ordre de 10–6 m.
- Le terme « micro » n’est donc pas
un terme adapté.
-
Les micro-ondes ont une longueur
d’onde intermédiaire entre l’infrarouge et les ondes de
radiodiffusion.
-
Le terme de « micro » est
employé, car les longueurs d’onde sont plus courtes que celles
de la bande VHF, utilisée par les radars de la Seconde
Guerre mondiale.
► Les expressions suivantes :
conduction thermique, activation
thermique
-
Conduction thermique :
-
Si l'on chauffe l'extrémité
d'une barre métallique, on remarque que la température de
l'autre extrémité augmente très vite. Les particules de la
partie chaude communiquent une partie de l'agitation thermique
aux particules voisines et ainsi de suite. L'agitation thermique
se transmet de proche en proche de la région chaude vers la
région froide sans transport de matière.
-
Activation thermique :
-
La plupart des réactions sont
plus rapides lorsque la température s’élève. Par conséquent si
la température augmente, la vitesse augmente.
► Avantage des micro-ondes :
-
Les micro-ondes présentent une
économie d’énergie.
► Utilisation des micro-ondes :
-
L’utilisation des micro-ondes est
un gain en termes de déchets car on diminue les réactions
parasites et ainsi la formation de produits indésirables.
► Observer les pictogrammes
mentionnés sur les réactifs utilisés.
-
Rechercher les risques que peut
présenter leur utilisation et s’organiser en conséquence.
|
Protocole expérimental :
V0 = 11,4 mL d’acide acétique pur et
V1 = 21,6 mL de
3-méthylbutan-2-ol (alcool isoamylique).
|
|
Protocole expérimental :
Homogénéiser.
|
-
Écrire l’équation de la réaction
de synthèse.
-
Déterminer les quantités de
matière initiales n0 d’alcool et
n1
d’acide acétique dans le mélange réactionnel.
-
Montrer que la quantité finale
nf d’acide acétique dans le mélange réactionnel
est donnée par :
-
nf =
Cb
. (VE1 –
VE2 )
-
Calculer la valeur de
nf.
-
En déduire la quantité de matière
nE d’ester formé, puis le rendement de
l’estérification.
-
Cette même synthèse réalisée à
l’aide d’un chauffage à reflux de 30 min conduit à un rendement
de 66 %. Commenter.
-
Données :
-
d0 = 0,81 et
d1 = 1,08
-
VE1 = 5,5 mL et
VE2 = 2,5 mL
►
Les réactifs :
|
Acide acétique |
|
|
H226 : Liquides et vapeurs inflammables. H314 : Provoque de graves brûlures de la peau et des lésions oculaires. |
|
3-méthylbutan-2-ol (alcool isoamylique) Alcool Primaire |
|
|
H226 : Liquides et vapeurs inflammables. H332 : Nocif par inhalation. H335 : Peut irriter les voies respiratoires. |
|
Acide sulfurique |
|
|
H290 : Peut être corrosif pour les métaux H314 : Provoque de graves brûlures de la peau et des lésions oculaires. |
|
|
M g / mol |
densité |
q ébullition °C |
Solubilité dans l'eau |
|
Acide
éthanoïque |
60,0 |
1,08 |
118,2 |
Grande |
|
Alcool
isoamylique |
88,0 |
0,81 |
128 |
Faible |
|
Éthanoate de
3-méthylbutyle |
130 |
0,87 |
142 |
Très faible |
► Équation de la réaction de
synthèse :
-
Quantité de matière initiale
n0
d’alcool :
-
V0 = 21,6 mL de
3-méthylbutan-2-ol (alcool isoamylique)
-
Masse volumique de l’eau :
ρeau
= 1,00 g . mL–1.
-

-
Quantité de matière
n1
d’acide acétique :
-
V1 = 11,4 mL
d’acide acétique pur
-

-
Lors du premier dosage, on dose
l’acide sulfurique et l’acide acétique restant :
-
ntotal
= Cb
. VE1
-
Lors du deuxième dosage, on ne
dose que l’acide sulfurique :
-
nacide sulfurique
= Cb .
VE2
-
La quantité finale (ou restante)
d’acide acétique est donnée par la relation suivante :
-
nf =
ntotal –
nacide sulfurique
-
nf =
Cb .
VE1 –
Cb
. VE2
-
nf =
Cb
. (VE1 –
VE2 )
-
Valeur de nf :
-
nf =
Cb
. (VE1 –
VE2 )
-
nf ≈ 2,0
x (5,5 – 2,5)
x 10–3
-
nf ≈ 6,0
x 10–3 mol
-
Tableau d’avancement :
-
On travaille avec
V = 5,0
mL du mélange réactionnel.
-
Le volume total du mélange
réactionnel est Vt =
V0 +
V1 +
V2 =
34,0 mL
-
Quantité de matière dans
V
= 5,0 mL du mélange réactionnel
|
Équation bilan |
|
C2H4O2 (acide acétique) |
|
+
C5H12O
(3-méthylbutan-1-ol) |
|
C7H14O2 Ester |
|
+
H2O
(ℓ) |
|
État du système |
Avanc. |
n’0
(mol) |
n’1
(mol) |
|
n’E
(mol) |
n3
(mol) |
||
|
État initial |
x = 0 |
n’1 |
|
0 |
0 |
|||
|
État intermédiaire |
x |
n’0
–
x |
n’1
–
x |
|
x |
x |
||
|
État final |
xmax |
n’0
– xmax
= nf
nf
≈ 6,0
x 10–3 |
n1
– xmax |
|
xmax |
xmax |
||
-
On tire la valeur de
xmax :
-
xmax =
n0
– nf ≈ 2,9
x 10–2 – 6,0
x 10–3
-
xmax ≈ 2,3
x 10–2 mol
-
Quantité de matière d’ester
obtenu :
-
n’E =
xmax
≈ 2,3
x 10–2 mol
-
Ceci pour 5,0 mL du mélange
réactionnel :
-
Ramené à 34 mL du mélange
réactionnel, la quantité de matière d’ester formé est donnée par
la relation :
-

-
Rendement de la réaction :
-
On appelle rendement, noté
ρ,
de la synthèse, le quotient de la quantité de produit
P
effectivement obtenue nE par la quantité
maximale attendue nmax :
-

-
Commentaire :
- On est en présence d’un alcool primaire.
- Le rendement attendu dans ce cas est de 66 % lorsque les réactifs sont dans les proportions stœchiométriques.
- Ce qui
est pratiquement le cas ici (n0 ≈ 0,20 mol et
n1 ≈ 0,205 mol).
-
Le rendement est nettement
supérieur à 66 % lorsque l’on utilise le four à micro-ondes.
-
Ici, il y a un déplacement
d’équilibre chimique dû au fait que, sous l’effet des
micro-ondes, l’eau
s’évapore au fur et à mesure qu’elle se forme et disparaît du
mélange réactionnel.
- L’utilisation du four à micro-ondes permet d’économiser l’énergie pour un rendement meilleur :
- C’est la chimie verte. (30 s de four à micro-ondes à
800 W et un rendement de 80 % contre 30 min de chauffage à
reflux et un rendement de 66 %)
VIII- Économiser les atomes : exemple du phénol.
-
Pour minimiser les quantités de
déchets produits, la chimie verte se propose de réduire les
sous-produits lors d’une réaction.
-
Comment mesurer l’efficacité des
procédés visant à économiser les atomes ?
► Exemple : Préparation du phénol
-
Le phénol est un intermédiaire de
synthèse de nombreux produits chimiques comme l’aspirine.
-
Jadis, le phénol était préparé
par distillation du goudron de houille. Cette méthode a été
abandonnée car l’énergie nécessaire était trop importante.
-
Le phénol se présente sous forme
de cristaux.
|
Le phénol
|
|
|
H301 : Toxique en cas
d’ingestion. H311 : Toxique par contact
cutané. H314 : Provoque de graves brûlures de la peau et des lésions oculaires. H331 : Toxique par inhalation. H341 : Susceptible d’induire des anomalies génétiques (indiquer la voie d’exposition s’il est formellement prouvé qu’aucune autre voie d’exposition ne conduit au même danger) H373 : Risque présumé d’effets graves pour les organes (indiquer tous les organes affectés, s’ils sont connus) à la suite d’expositions répétées ou d’une exposition prolongée (indiquer la voie d’exposition s’il est formellement prouvé qu’aucune autre voie d’exposition ne conduit au même danger) |
-
En 1899, le groupe BASF met au
point la synthèse du phénol par sulfonation du benzène
C6H6.
-
Ce procédé comporte plusieurs
étapes, mais on peut néanmoins écrire le bilan global de la
réaction :
|
C6H6 |
+
H2SO4 |
+ 2
NaOH |
→ |
C6H5OH |
+
Na2SO3 |
+ 2
H2O |
-
La faible économie d’atomes due à
une forte production de déchets demeure son principal
inconvénient.
-
Le procédé est abandonné dans les
années 1960.
► L’économie d’atomes :
EA (ou utilisation
atomique UA)
-
Définition de l’économie Atomique
(EA) d’une synthèse :
-
C’est le rapport de la masse
molaire du (ou des) produit(s) recherché(s) sur la somme des
masses molaires de
tous les produits formés en tenant compte des
coefficients stœchiométriques.
-
Lorsque les sous-produits ne sont pas tous
identifiés, la conservation de la matière permet de remplacer
le dénominateur par la somme des masses molaires de tous les
réactifs :
-

-
Plus cet indicateur est proche de
1 (100%), plus le procédé est efficace en termes d’économie
atomique et moins il génère de déchets.
-
C’est un indicateur qui mesure
l’efficacité des procédés.
-
Il est défini comme le rapport de
la masse molaire du (ou des) produit(s) recherché(s), sur la
somme des masses molaires des réactifs (en tenant compte des
nombres stœchiométriques) :
-

-
Avec ai et
bi
nombres stœchiométriques.
-
Plus cet indicateur est proche de
1 (100 %) plus le procédé est efficace en termes d’économie
d’atomes et moins le procédé génère de déchets.
-
Aujourd’hui, plus de 90 % de la
production de phénol est basée sur l’oxydation du cumène,
lui-même obtenu à partir du benzène.
- Ce procédé, dit « HOCK », est essentiellement catalytique.
- La réaction se déroule en trois
étapes :
![]() Synthèse du cumène :
Synthèse du cumène :
![]() Oxydation douce du cumène :
Oxydation douce du cumène :
![]() Décomposition en phénol :
Décomposition en phénol :
-
Le bilan de la réaction peut
s’écrire :
|
C6H6 |
+
C3H6 |
+
O2 |
→ |
C6H5OH |
+
CH3COCH3 |
-
L’acétone, coproduit de la
réaction est valorisée industriellement de sorte que l’économie
d’atomes est de 100 %.
-
Le procédé DOW est un procédé
catalytique en deux étapes qui permet d’obtenir environ 5 % de
la production mondiale de phénol à partir du toluène.
![]() Première étape :
Première étape :

![]() Deuxième étape :
Deuxième étape :
-
Le bilan peut s’écrire :
|
C6H5CH3 |
+ 2 O2 |
→ |
C6H5OH |
+
CO2 |
+
H2O |
- Ce procédé génère peu de sous-produits en d’impuretés.
- Il permet une économie d’atomes
élevée.
-
Cependant, il nécessite trois à
quatre fois plus d’énergie que le procédé HOCK.
-
C’est un indicateur qui mesure
l’efficacité des procédés.
-
Il est défini comme le rapport de
la masse molaire du (ou des) produit(s) recherché(s), sur la
somme des masses molaires des réactifs (en tenant compte des
nombres stœchiométriques) :
-

-
Avec ai et
bi
nombres stœchiométriques.
-
Plus cet indicateur est proche de
1 (100 %) plus le procédé est efficace en termes d’économie
d’atomes et moins le procédé génère de déchets.
-
Rechercher les utilisations du
phénol et de l’acétone (ou propanone).
-
Rechercher les noms des chimistes
qui ont synthétisé le phénol à partir du benzène.
-
Calculer l’économie d’atomes
EA des trois procédés, puis commenter les phrases en
italique dans le texte.
-
Dans le premier et le troisième
procédé, que peut-on penser de la prise en compte de l’eau comme
déchet à recycler ?
-
Pourquoi le procédé DOW est-il
moins utilisé que le procédé HOCK ?
►
Utilisations du phénol :
-
Le phénol est utilisé dans de
nombreuses synthèses de produits pharmaceutiques et de parfums.
-
En médecine, il est surtout
utilisé comme antiseptique puissant.
-
Il est utilisé pour la
préparation de la phénolphtaléine, un indicateur de pH bien
connu des chimistes.
► Utilisations de l’acétone :
-
L'acétone est un solvant très
utilisé dans l'industrie et en laboratoire car elle a l'avantage
de solubiliser de manière particulièrement rapide de nombreuses
espèces organiques et parce qu'elle est miscible avec l'eau.
-
C'est également un composé à la
base de la fabrication de plastiques, de médicaments, et autres
produits issus de l'industrie de synthèse.
- L'acétone est également le principal constituant de certains dissolvants utilisés pour retirer le vernis à ongles.
- Elle est également utilisée comme dissolvant pour dissoudre la colle et les fibres cellulosiques.
- Il est recommandé de ne pas utiliser d'acétone sur les fibres artificielles (acétate, triacétate et acrylique).
- L'acétone est
également utilisée pour le dégraissage industriel.
|
L’acétone
|
|
|
H225 : Liquide et vapeurs très
inflammables H319 : Provoque une sévère
irritation des yeux. H336 : Peut provoquer somnolence ou vertiges |
► Synthèse du phénol à partir du
benzène :
- Le phénol fut découvert à l'état impur par Johann Rudolf Glauber en 1650 à partir de la distillation du goudron de houille.
- Il le décrit comme « une
huile vive et rouge de sang qui assèche et guérit tous les
ulcères humides ».
-
En 1834, Friedrich Ferdinand
Runge parvient à l'isoler et le nomme alors
acide carbolique.
-
Il fut synthétisé et manufacturé
en 1889 par la firme BASF.
► Économie d’atomes
EA des trois
procédés :
![]() Procédé BASF :
Procédé BASF :
|
C6H6 |
+
H2SO4 |
+ 2
NaOH |
→ |
C6H5OH |
+
Na2SO3 |
+ 2
H2O |
-

![]() Procédé HOCK :
Procédé HOCK :
|
C6H6 |
+
C3H6 |
+
O2 |
→ |
C6H5OH |
+
CH3COCH3 |
-

-
En tenant compte de l’acétone :
-

![]() Procédé DOW :
Procédé DOW :
|
C6H5CH3 |
+ 2 O2 |
→ |
C6H5OH |
+ CO2 |
+ H2O |
-

-
Remarques :
-
Un procédé est d’autant plus
efficace que l’EA est proche de 1.
- En prenant en compte l’acétone dans le calcul de l’EA2, le résultat est égal à 1 :
- La valorisation industrielle de l’acétone contribue donc à
une efficacité accrue du procédé HOCK.
-
Si l’on ne tient pas compte de
l’eau comme déchet à recycler, l’EA dans chacun des
procédés va augmenter.
-
Le procédé DOW consomme lui trois
à quatre fois plus d’énergie.
IX-
Le dioxyde de carbone : séquestré ou valorisé.
-
Le dioxyde de carbone rejeté par
les activités humaines est en partie responsable du
réchauffement climatique.
-
Pour éviter son rejet dans
l’atmosphère, il peut être séquestré ou valorisé.
-
Avec la raréfaction annoncée du
pétrole et du gaz naturel (et donc l’augmentation inévitable de
leurs prix), les controverses autour des centrales nucléaires et
la difficile émergence des énergies renouvelables, la production
d’énergie (notamment électrique) à partir du charbon, bon marché
et abondant, est une solution sur laquelle beaucoup de pays ont
misé.
-
Malheureusement, l’utilisation de
ce combustible produit énormément de dioxyde de carbone,
gaz à effet de serre.
-
Des méthodes de « captage-stockage », pour
empêcher le dioxyde de carbone de s’échapper dans l’atmosphère,
sont à l’étude.
-
Les méthodes de captage différent
selon le type de centrale utilisé.
-
Dans les centrales classiques qui
brûlent du charbon pour transformer l’eau liquide en vapeur pour
faire tourner des turbines génératrices d’électricité, le
captage ne peut se faire qu’en sortie de cheminée.
-
En revanche, dans les centrales
fondées sur le cycle combiné à gazéification intégrée (CCGI),
le charbon est converti en gaz de synthèse, le « syngas », en
présence de dioxygène et d’eau.
-
Ce gaz est principalement
constitué de dihydrogène et de monoxyde de carbone.
- Le dihydrogène sert de carburant dans la centrale.
- Le monoxyde de carbone est transformé en
dioxyde de carbone qui est capté et stocké.
-
Pour le stockage du dioxyde de
carbone, on distingue plusieurs procédés dont la séquestration
souterraine dans les gisements épuisés de pétrole ou de gaz, des
aquifères marins,
etc.
► Différents procédés de
séquestration sont étudiés :
-
Cependant, cette séquestration
présente des dangers comme le relargage soudain de dioxyde de
carbone.
-
Des procédés de captation par des
organismes photosynthétiques,
tels que les algues sont à l’étude (bioséquestration).
-
Une tonne d’algues peut absorber
près de deux tonnes de dioxyde de carbone pour sa croissance.
-
Les huiles produites par les
algues pourraient être utilisées, après raffinage, comme
biocarburant de troisième génération.
-
Très gourmandes en énergie, ces
techniques ne dispensent pas l’humanité de restreindre ses
rejets de gaz à effet de serre.
-
Définir les expressions
suivantes : gaz à effet de serre, aquifères, organismes
photosynthétiques.
-
Quel danger peut présenter un
relargage soudain de dioxyde de carbone ?
-
Discuter quelques avantages et
inconvénients des procédés de séquestration et de valorisation
dans la perspective d’une chimie verte.
-
À partir des systèmes décrits
ci-dessous, écrire les équations des réactions de conversion du
charbon en « syngas ».
|
Carbone, eau |
→ |
Monoxyde de
carbone, dihydrogène |
|
|
|
|
|
Carbone,
dioxygène |
→ |
Dioxyde de
carbone |
|
|
|
|
|
Dioxyde de
carbone, carbone |
→ |
Monoxyde de
carbone |
|
|
|
|
|
Monoxyde de
carbone, eau |
→ |
Dioxyde de
carbone, dihydrogène |
►
Expressions en italiques :
- Gaz à effet de serre : gaz absorbant les rayonnements IR émis par la surface terrestre et contribuant à l’effet de serre.
- L’augmentation de leur
concentration dans
l’atmosphère terrestre
serait à l’origine du réchauffement climatique récent.
-
Aquifères : roche perméable
comportant une zone conductrice d’eau souterraine permettant
l’écoulement et le captage d’une nappe souterraine.
-
Organismes photosynthétiques :
organismes pratiquant la photosynthèse qui permet aux plantes et
à certaines bactéries de synthétiser de la matière organique en
exploitant la lumière du soleil.
► Relargage du dioxyde de carbone :
-
Lors du relargage du dioxyde de
carbone, il peut y avoir un danger d’asphyxie car le dioxyde de
carbone est plus dense que l’air.
► Avantages et inconvénients des
procédés de séquestration et de valorisation du dioxyde de
carbone :
-
Avantages : limitation des
émissions de GES et du réchauffement climatique ; synthèse de
biocarburants par les algues.
-
Inconvénients : procédés
énergétivores, risque de relargage lors du procédé par injection
et stockage.
► Équations des réactions de
conversion du charbon en « syngas » :
|
C
+
H2O
Carbone
Eau |
→ |
CO
+
H2 Monoxyde de
carbone
Dihydrogène
|
|
|
|
|
|
C
+
O2 Carbone
Dioxygène |
→ |
CO2 Dioxyde de
carbone |
|
|
|
|
|
CO2
+
C Dioxyde de
carbone
Carbone |
→ |
2 CO Monoxyde de
carbone |
|
|
|
|
|
CO
+
H2O Monoxyde de carbone
Eau |
→ |
CO2
+
H2 Dioxyde de
carbone
Dihydrogène |
2)- Calculer une économie d’atomes.
a)-
Énoncé :
-
Avant 1950, l’acrylonitrile était
fabriqué à partir d’acétylène et de cyanure d’hydrogène :
|
HC = CH |
+
HCN |
→ |
CH2
= CH –
CN |
(1) |
►
Le cyanure d’hydrogène :
|
CYANURE D’HYDROGÈNE |
HCN |
|
H225 : Liquide et vapeurs extrêmement inflammables H330 : Mortel par inhalation. H410 : Très toxique pour les organismes aquatiques, entraîne des effets néfastes à long terme. |
-
Le procédé de fabrication du
cyanure d’hydrogène était simple, mais inadapté à une production
importante, et celui de l’acétylène est cher.
-
Depuis 1957, l’acrylonitrile est
fabriqué à partir du propène :
|
2 CH2
= CH –
CH3 |
+ 2
NH3 |
+
O2 |
→ |
2 CH2
= CH –
CN |
+ 6 H2O |
(2) |
a)-
Questions :
-
L’économie d’atomes
EA est
définie comme le rapport de la masse molaire du (ou des)
produit(s) recherché(s), sur la somme des masses molaires des
réactifs (en tenant compte des nombres stœchiométriques) :
-

-
Avec ai et
bi
nombres stœchiométriques.
-
Calculer l’économie d’atomes des
réactions. Commenter.
-
En considérant que l’eau n’est
pas un déchet, quelle valeur prend l’économie d’atomes de la
réaction (2) ?
-
Rechercher les dangers du cyanure
d’hydrogène. Commenter l’abandon du procédé.
-
Une réaction parasite peut se
produire :
|
CH2
= CH –
CH3 |
+ 3
NH3 |
+3
O2 |
→ |
3 HCN |
+ 6 H2O |
(3) |
-
Doit-on nuancer les réponses
données aux questions précédentes ?
a)-
Réponses :
► Économie d’atomes de la réaction
(1) :
|
HC = CH |
+
HCN |
→ |
CH2
= CH –
CN |
(1) |
-

► Économie d’atomes de la réaction
(2) :
|
2 CH2
= CH –
CH3 |
+ 2
NH3 |
+ 3
O2 |
→ |
2 CH2
= CH –
CN |
+ 6 H2O |
(2) |
-

-
L’économie d’atomes est plus
grande pour le procédé (1).
► Si l’eau n’est pas comptée comme
déchets :
-

-
Si l’eau n’est pas comptée comme
déchet EA2 = 1,0
► Les dangers du cyanure
d’hydrogène :
-
Le cyanure d’hydrogène est
extrêmement inflammable, mortel par inhalation et très toxique
pour les organismes aquatiques.
-
Le procédé à partir du cyanure
d’hydrogène a été abandonné pour travailler dans des conditions
opératoires plus sûres et déduire ainsi les risques d’accidents.
► La réaction parasite :
- Cette réaction produit du cyanure d’hydrogène :
- C’est un déchet, donc la valeur de l’économie d’atomes EA2 prend de ce fait une valeur plus faible.
- De plus le cyanure d’hydrogène présente des dangers pour
l’homme et les organismes aquatiques.
3)- Exercices :
a)-
Exercice 5 page 452 : comprendre les enjeux de la chimie
durable.
b)-
Exercice 7 page 452 : utiliser des solvants alternatifs.
c)-
Exercice 8 page 452 : limiter les sources de pollution.
d)-
Exercice 9 page 453 : réduire l’émission de gaz à effet
de serre.
e)-
Exercice 11 page 453 : recycler les déchets.
f)-
Exercice 12 page 454 : privilégier les ressources
naturelles.
g)-
Exercice 13 page 454 : capter le dioxyde de carbone.
|
|










































