|
Synthèse d’une cétone : la propan–2–one Correction |
|
|
|
|
|
I-
Synthèse d’une cétone : la propan–2–one. (Séance de
travaux pratiques)
1)- L’acétone :
-
L’acétone, ou propan –
2– one (M
(Acétone) = 58,0 g / mol), est un solvant très utilisé dans l’industrie et dans
la vie de tous les jours.
-
Au laboratoire, on la
prépare à partir du propan–2–ol (M
(Alcool) = 60,0 g / mol).
2)- Principe de la synthèse.
-
On oxyde le
propan–2–ol par l’ion permanganate MnO4–
(aq) en milieu acide.
-
Le propan–2–ol est un
alcool secondaire qui par oxydation donne la propan–2–one.
3)- Données :
|
|
M g .mol–1 |
Densité d |
θéb °C |
Pictogrammes |
|
Propan-2-ol |
60,0 |
0,785 |
82,4 |
|
|
Propan-2-one |
58,0 |
1,05 |
56 |
|
|
Permanganate
de
potassium |
|
|
|
|
|
Acide
sulfurique |
|
|
|
|
4)-
Manipulation.
a)-
Montage et protocole :
-
Distillation
fractionnée. Réaliser le montage suivant.
-
Faire le schéma.
Pour synthétiser la
propan–2–one, on suit le protocole expérimental suivant :
-
On réalise le montage
à distiller ci-dessus.
-
Dans le ballon bicol,
on introduit un volume V = 10,0
mL de propan–2–ol (densité d
= 0,785) et on ajoute quelques grains de pierre ponce pour réguler l’ébullition.
-
Dans l’ampoule de
coulée, on introduit 140 mL d’une solution aqueuse à 0,40 mol / L de
permanganate de potassium et à 2,0 mol / L d’acide sulfurique.
-
On porte le mélange à
l’ébullition douce.
-
On introduit goutte à
goutte la solution oxydante tout en maintenant l’ébullition.
-
Lorsque l’addition de
la solution oxydante est terminée, on prolonge l’ébullition douce pendant une
dizaine de minutes.
-
Puis on augmente le
chauffage.
-
Les vapeurs montent
dans la colonne de Vigreux et atteignent le haut de la colonne.
-
On recueille le
distillat, dans un erlenmeyer préalablement pesé, tant que le thermomètre
affiche une température comprise entre 54 ° C et 58 ° C.
-
On arrête le chauffage
dès que la température s’élève, mais on conserve la circulation de l’eau dans le
réfrigérant.
-
On pèse à nouveau
l’erlenmeyer pour en déduire la masse m de distillat.
-
On réalise un test
caractéristique pour vérifier que le produit obtenu est bien la propan–2–one.
b)-
Rendement de la synthèse :
-
Le rendement d’une
synthèse, noté η,
est égal au quotient de la quantité de produit obtenu
nexp,
par la quantité maximale de produit attendu
nmax.
-
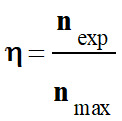
1)- La distillation fractionnée : Quel est le rôle de la
distillation fractionnée ?
-
Le
mélange réactionnel contient :
-
La
solution oxydante qui est une solution aqueuse acidifiée de permanganate de
potassium,
-
Le
propan–2–ol
-
Et la
propan–2–one lorsque la réaction a démarrée.
|
|
Températures
d’ébullition
sous la
pression atmosphérique |
|
Eau |
θeb
= 100 ° C |
|
Propan–2–ol |
θeb
= 82 ° C |
|
Propan–2–one |
θeb
= 56 ° C |
-
Les
trois liquides étant miscibles, pour les séparer, il faut utiliser la
distillation fractionnée.
-
De plus
leurs températures d’ébullition sont suffisamment différentes pour que l’on
puisse les séparer par distillation.
-
Au cours
de la distillation fractionnée, les réactifs et les produits se vaporisent et
montent dans la colonne à distiller.
-
Au cours
de l'ascension, le mélange s'enrichi en corps le plus volatil (ici la
propan–2–one).
-
En tête
de colonne, on obtient le corps le plus volatil pratiquement pur.
-
Le
distillat est ensuite condensé grâce au réfrigérant.
-
Donner la masse
mexp
de distillat obtenue :
- La masse de distillat obtenue est mexp = 7,0 g.
-
mexp
≈
2)- Écrire les demi-équations électroniques et l’équation
de la réaction :
|
MnO4–
(aq)+
8
H+ (aq) + 5
e –
|
|
|
|
5
|
3)- Donner le tableau d’avancement de la réaction :
-
En déduire le réactif
limitant et l’avancement maximal xmax .
-
Calculer les quantités
de matière initiales de chaque réactif.
-
Calculer la quantité
de matière de propanone obtenue : c’est la quantité maximale de propanone
attendue.
-
En déduire la valeur
du rendement η
de la réaction.
![]() Quantités de matière initiales :
Quantités de matière initiales :
-
Les ions
hydrogène
H +
(aq) sont en large excès.
-
Quantité de matière initiale d’alcool :
- 
-
n0
(Alcool) ≈ 0,131 mol
-
Quantité de matière initiale d’ions permanganate :
-
n0
(MnO4–) =
C · V
-
n0
(MnO4–) ≈ 140,0 × 10–
3 × 0,40
-
n0
(MnO4–) ≈ 0,056 mol
-
Tableau d’avancement :
|
Équa. |
5 |
+ 2 MnO4–
(aq) |
+
6
H+
(aq) |
→ |
5 |
+
2 Mn2+ (aq) |
+
8 H2O
(ℓ) |
|
|
mol |
mol |
mol |
|
mol |
mol |
mol |
|
État
i |
n0
(Alcool) ≈ 0,131 |
n0
(MnO4–)
≈ 0,056 |
Excès |
|
0 |
0 |
– |
|
État
x |
n0
(Alcool) – 5x |
n0
(MnO4–)
– 2x |
|
|
5
x |
2
x |
– |
|
État
max |
n0
(Alcool) – 5xmax |
n0
(MnO4–)
– 2 xmax |
|
|
5
xmax |
2
xmax |
– |
![]() Réactif limitant et avancement maximal :
Réactif limitant et avancement maximal :
-
Hypothèse 1 : l’alcool est le réactif limitant
-
Alors :
n0
(Alcool) – 5
xmax1 = 0
-
xmax1 =
n0
(Alcool) / 5
-
xmax1 ≈ 2,62 × 10–
2 mol
-
xmax1 ≈ 26,2 mmol
-
Hypothèse 2 : le réactif limitant est l’ion permanganate :
-
n0
(MnO4–) – 2 xmax2
= 0
-
xmax2 =
n0
(MnO4–)
/ 2
-
xmax2 ≈ 0,028 mol
-
xmax2 ≈ 28 mmol
-
Valeur de l’avancement maximal
xmax :
-
Il est égal à la plus petite des deux valeurs :
-
xmax =
xmax1 ≈ 26,2 mmol <
xmax2
≈ 28 mmol
-
Le réactif limitant est l’alcool.
- Maintenant, on peut compléter le tableau d’avancement : xmax ≈ 26,2 mmol
|
Équa. |
5 |
+
2 MnO4–
(aq) |
+
6
H+
(aq) |
→ |
5 |
+
2 Mn2+
(aq) |
+
8 H2O
(ℓ) |
|
|
mmol |
mmol |
mmol |
|
mmol |
mmol |
mmol |
|
État
i |
n0
(Alcool) ≈ 131 |
n0
(MnO4–)
≈ 56 |
Excès |
|
0 |
0 |
–– |
|
État
x |
n0
(Alcool) – 5 x |
n0
(MnO4–)
– 2 x |
|
|
5
x |
2
x |
– |
|
État mmax |
0 |
3,6 |
|
|
131 |
51,4 |
– |
![]() Quantité de
matière de propanone obtenue : c’est la quantité maximale de propanone attendue.
Quantité de
matière de propanone obtenue : c’est la quantité maximale de propanone attendue.
-
n (Propanone) ≈ 0,131 mol = 131 mmol
-
Masse de propanone attendue :
-
m (Propanone) = n (Propanone) . M (Propanone)
-
m (Propanone) ≈ 0,131 × 58,0
- mmax = m (Propanone) ≈ 7,60 g
- Rendement de la réaction :
- On a obtenu une masse mexp = 7,0 g.
-
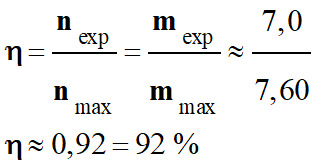
4)- Caractérisation du produit synthétisé :
-
Comment peut-on
caractériser le produit synthétisé ?
- Comment peut-on caractériser le produit synthétisé ?
-
On peut réaliser le test à la D.N.P.H.
-
On peut déterminer la valeur de sa densité d.