|
TP Chimie N° 10 |
Synthèse des Esters : Correction. |
|
|
Synthèse de l'éthanoate de 3-méthylbutyle III- Exploitation des données. |
|
|
|
Programme 2012 : Programme 2020 : |
|
Matériel : |
Chauffage à reflux, chauffe ballon, colonne de Vigreux, réfrigérant, ampoule à décanter, réfrigérant descendant, thermomètre, éprouvette graduée, des béchers. alcool isoamylique à 98 %, acide acétique à 99 %, pierre ponce, eau glacée, l'eau glacée salée, solution d'hydrogénocarbonate de sodium à 5 %, sulfate de magnésium anhydre, acide formique (acide méthanoïque), d'éthanol, acide sulfurique |
Synthèse de l'éthanoate de 3-méthylbutyle.
|
|
M g / mol |
densité |
θ
ébullition
°C |
Solubilité dans l'eau |
|
Acide éthanoïque |
60 |
1,05 |
118,2 |
Grande |
|
Alcool
isoamylique |
88 |
0,81 |
128 |
Faible |
|
Éthanoate
de 3-méthylbutyle |
130 |
0,87 |
142 |
Très
faible |
1)- Préparation de l'ester.
a)- Chauffage à reflux.
![]() Introduire dans le ballon :
Introduire dans le ballon :
- 15 mL d'alcool isoamylique à 98 % (3-méthylbutan-1-ol).
- 20 mL d'acide acétique à 99 % (acide éthanoïque).
- Quelques grains de pierre ponce ou quelques billes de verre.
- Adapter le réfrigérant et porter le mélange à l'ébullition douce pendant 45 min.
b)- Questions : pendant que la réaction s'effectue.
- Écrire l'équation de la réaction. Donner la classe de l'alcool utilisé.
- L'alcool utilisé est un alcool primaire.
- Calculer les quantités de matière de chacun des réactifs mis en jeu.
- Quantité de matière d'alcool isoamylique :
|
{ |
V1 = 15 mL |
|
d1 = 0,81 |
|
|
P1 % = 98 |
|
|
M1 = 88 g / mol |
|
n1 = |
V 1. μ0 . d1 . P1 % |
||
|
|
|||
|
100 M1 |
|||
|
|
15 x 1,00 x 0,81 x 98 |
||
|
n1 = |
|
||
|
|
100 x 88 |
||
|
|
|
||
|
n1 ≈ |
0,14 mol |
||
- Quantité de matière d'acide éthanoïque
|
{ |
V2 = 20 mL |
|
d2 = 1,05 |
|
|
P2 % = 99,5 |
|
|
M2 = 60 g / mol |
|
n2 = |
V2. μ0 . d2 . P2 % |
||
|
|
|||
|
100 M2 |
|||
|
|
20 x 1,00 x 1,05 x 99,5 |
||
|
n2 = |
|
||
|
|
100 x 60 |
||
|
|
|
||
|
n2 ≈ |
0,35 mol |
||
- L'un des réactifs est en excès. Lequel ? Pourquoi ? Que peut-on dire du rendement de la réaction d'estérification ?
- La réaction se faisant mole à mole, il y a un excès d'acide éthanoïque
(réactif le moins cher).
- On utilise un excès d'acide éthanoïque pour déplacer l'équilibre dans le sens de l'estérification.
- On est en présence d'un alcool primaire, en conséquence, le rendement est supérieur à 66 %.
- Le rendement se calcule
par rapport au réactif en défaut.
|
ρ = |
Quantité de produit formé |
||
|
|
|
|
|
|
Quantité de produit obtenu pour une réaction totale |
- La réaction est déplacée dans le sens de l'estérification :
|
n2 |
Rendement théorique |
||||
|
|
≈ |
2,5 |
=> |
ρ = 89 % |
|
|
n1 |
- Faire un schéma du dispositif. Qu'appelle-t-on chauffage à reflux ?
|
Chauffage
à Reflux
|
1-
réfrigérant.
2-
Ballon.
3-
Chauffe-ballon.
4-
Sortie de l’eau.
5-
Arrivée de l’eau.
6-
Mélange réactionnel. 7- Vallet (Support-élévateur) |
- Ce montage permet de maintenir le milieu réactionnel à une température constante, en l'occurrence la température d'ébullition du solvant.
- Les vapeurs sont condensées dans le réfrigérant et retournent à l'état liquide dans le ballon.
- Les réactifs et les produits restent dans le milieu réactionnel.
2)- Séparation de l'ester.
a)- Extraction liquide - liquide.
![]() Laisser refroidir à température ambiante, puis refroidir avec
un récipient contenant de l'eau glacée.
Laisser refroidir à température ambiante, puis refroidir avec
un récipient contenant de l'eau glacée.
- Verser le contenu du ballon dans un bécher (de 250 mL) contenant 50 mL d'eau froide. Rincer le ballon avec de l'eau distillée.
- Verser le mélange dans une ampoule à décanter.
- Ajouter 15 mL de solution d'hydrogénocarbonate de sodium à 5 %.
- Dégazer et attendre que l'effervescence cesse pour décanter. Recommencer plusieurs fois si nécessaire.
- Laver avec 20 mL d'eau salée glacée. Laisser décanter et séparer les deux phases.
- Verser la phase organique dans un bécher propre et sec et sécher avec environ 2 g de sulfate de magnésium anhydre.
b)- Filtration liquide - solide.
![]() Filtrer et mesurer le volume et la masse de l'ester formé :
VE
≈ 15,5
mL et
mE
≈
13,9
g
Filtrer et mesurer le volume et la masse de l'ester formé :
VE
≈ 15,5
mL et
mE
≈
13,9
g
c)- Questions :
![]() Pourquoi
est-il important de refroidir le milieu réactionnel avant d'ajouter de l'eau
?
Pourquoi
est-il important de refroidir le milieu réactionnel avant d'ajouter de l'eau
?
- On refroidit afin d'éviter l'hydrolyse de l'ester.
- Dans l'ampoule à décanter, où se trouvent la phase aqueuse et la phase organique ? Quelle est la phase qui contient pratiquement tout l'ester ?
- La phase organique est moins dense que l'eau, elle se trouve au-dessus de la phase aqueuse.
- L'ester se trouve principalement dans la phase organique car il est peu soluble dans l'eau.
- Dans la phase organique, on trouve aussi un peu d’acide éthanoïque qui est en excès.
- Il faut l’éliminer de la phase organique.
- Pourquoi propose-t-on d'ajouter une solution de chlorure de sodium pour améliorer la séparation ? Quel est le rôle de l'hydrocarbonate de sodium ?
- On donne : CO2, H2O / HCO3−, pKA1 = 6,4 ; HCO3− / CO32 − , pKA2 = 10,2
- L'hydrogénocarbonate de sodium est une solution basique,
- elle neutralise le milieu réactionnel et élimine l'acide éthanoïque restant en le solubilisant dans l'eau sous forme d'ions éthanoate.
- De façon générale,
les ions se retrouvent dans la phase aqueuse car l’eau est un solvant
polaire.
- Il se produit la réaction suivante :
CH3COOH (aq) + HCO3− (aq) = CH3COO − (aq) + (CO2, H2O) (aq)
- Le gaz qui se dégage est du dioxyde de carbone.
-
Il faut dégazer afin
d’éviter les projections.
- Faire un schéma des différentes extractions.
- Rôle de l’ampoule à décanter :
- elle
permet l’extraction par un solvant et elle permet aussi la séparation des
différentes phases non miscibles.
- L’éthanoate d’isoamyle (ester) est principalement présent dans la phase organique.
- Il est moins dense que l’eau et peu soluble dans l’eau.
- Schéma :
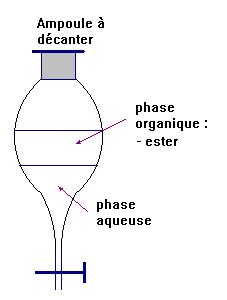
III- Exploitation des mesures.
![]() Déterminer
la densité de l'ester. Comparer la valeur trouvée à celle donnée dans le
tableau. Conclure.
Déterminer
la densité de l'ester. Comparer la valeur trouvée à celle donnée dans le
tableau. Conclure.
- Densité de l'ester :
|
mE ≈ 13,9 g |
=> |
ρ ≈ 0,90 g / mL |
=> |
d = 0,90 |
|
VE ≈ 15,5 mL |
- La valeur donnée dans le tableau est d ≈ 0,87.
- L'ester n'est pas pur, il contient un peu d'eau, il faudrait réaliser une
distillation fractionnée.
- Calculer la quantité d'ester obtenu.
- En déduire le pourcentage d'alcool et d'acide estérifié.
- Ce résultat vous semble-t-il convenable ? Justifier.
- Quantité d'ester obtenu :
|
nE = |
mE |
||
|
|
|
|
|
|
ME |
|||
|
|
13,9 |
||
|
nE = |
|
||
|
|
130 |
||
|
|
|
||
|
nE ≈ |
0,107 mol |
||
- Pourcentage d'acide estérifié :
|
% acide = |
0,107 |
||
|
|
|
x 100 |
|
|
0,35 |
|||
|
|
|
||
|
% acide ≈ |
31 % |
||
- Pourcentage d'alcool estérifié :
|
% alcool = |
0,107 |
||
|
|
|
x 100 |
|
|
0,14 |
|||
|
|
|
||
|
% alcool ≈ |
79 % |
||
- Calculer le rendement de la réaction.
- Rendement de la réaction.
- Il se calcule par rapport au réactif limitant :
|
ρ = |
0,107 |
||
|
|
|
|
|
|
0,14 |
|||
|
|
|
||
|
ρ ≈ |
79 % |
||
- Le pourcentage est supérieur à 66 %.
- Il y a pour cela deux
raisons.
- Le mélange n'est pas équimolaire, il y a un excès d'acide et l'équilibre
est déplacé dans le sens de l'estérification.
- Le produit n'est pas pur, il contient un peu de l'eau en outre.
- Il faudrait sécher l’ester avec du sulfate de cuivre anhydre ou du sulfate de magnésium anhydre.
- Donner les caractéristiques de l'ester obtenu.
- L’ester obtenu est un liquide de densité d ≈ 0,90.
- Il a une odeur de banane et une couleur jaune-clair.
Synthèse du méthanoate d'éthyle.
|
|
M g / mol |
densité |
θ
ébullition °C |
Solubilité dans l'eau |
|
Acide méthanoïque |
46 |
1,05 |
100,7 |
Grande |
|
éthanol |
46 |
0,81 |
78 |
grande |
|
Méthanoate
d'éthyle |
74 |
0,92 |
54,5 |
Faible |
|
eau |
18 |
1 |
100 |
----------- |
1)- Distillation :
a)- Matériel : on utilise :
![]() Un ballon de 250 mL.
Un ballon de 250 mL.
- Une colonne de Vigreux (colonne à distillée)
- Un réfrigérant descendant.
- Un thermomètre
- Une éprouvette pour recueillir le distillat.
b)- Réactifs :
- 20 mL d'acide formique (acide méthanoïque).
- 20 mL d'éthanol.
- Quelques gouttes d'acide sulfurique.
- Quelques grains de pierre ponce ou quelques billes de verre.
c)- Réaction : on porte à l'ébullition douce et on recueille le distillat dans l'éprouvette graduée.
2)- Mesures.
![]() Relever la température
θ
en tête de colonne
Relever la température
θ
en tête de colonne
- θ = 52 °C.
- Relever la valeur de la pression :
- P = 1001 hPa.
- Déterminer la masse et le volume de l'ester obtenu.
- En déduire la densité du produit obtenu.
- La comparer à la valeur donnée dans le tableau.
- Densité de l'ester :
|
mE ≈ 25,9 g |
=> |
ρ ≈ 0,925 g / mL |
=> |
d ≈ 0,925 |
|
VE ≈ 28,0 mL |
- La valeur donnée dans le tableau est d ≈ 0,92.
-
L'ester est pratiquement pur il a
été obtenu par distillation fractionnée.
![]() Écrire
l'équation de la réaction.
Écrire
l'équation de la réaction.
- Déterminer les quantités de matière de chacun des réactifs mis en jeu. Conclure.
- Quantité de matière d'acide méthanoïque :
|
{ |
V1 = 20 mL |
|
d1 = 1,05 |
|
|
P1 % = 99 |
|
|
M1 = 46 g / mol |
|
n1 = |
V 1. μ0 . d1 . P1 % |
||
|
|
|||
|
100 M1 |
|||
|
|
20 x 1,00 x 1,05 x 99 |
||
|
n1 = |
|
||
|
|
100 x 46 |
||
|
|
|
||
|
n1 ≈ |
0,45 mol |
||
- Quantité de matière d'éthanol
|
{ |
V2 = 20 mL |
|
d2 = 0,81 |
|
|
P2 % = 99 |
|
|
M2 = 46 g / mol |
|
n2 = |
V 2. μ0 . d2 . P2 % |
||
|
|
|||
|
100 M2 |
|||
|
|
20 x 1,00 x 0,81 x 99 |
||
|
n2 = |
|
||
|
|
100 x 46 |
||
|
|
|
||
|
n2 ≈ |
0,35 mol |
||
- Il y a un excès d'acide formique, l'équilibre est déplacé dans le
sens de l'estérification.
- Faire un schéma annoté du montage utilisé.
|
Distillation
fractionnée
|
1-
Chauffe-ballon.
2-
Mélange réactionnel.
3-
Colonne de Vigreux.
4-
Thermomètre
5-
Arrivée et sortie d’eau
6-
réfrigérant
7-
éprouvette graduée
8-
Distillat. |
- Qu'appelle-t-on distillation fractionnée ?
- Au cours de la distillation fractionnée, les réactifs et les produits se vaporisent et monte dans la colonne à distiller.
- Au cours de l'ascension, le mélange s'enrichi en corps le plus volatil (ici l'ester).
- En tête de colonne, on obtient le corps le plus volatil pratiquement pur.
- Le distillat est ensuite condensé grâce au réfrigérant.
- Déterminer la quantité d'ester obtenu.
- Quantité de matière d'ester obtenu :
|
nE = |
mE |
||
|
|
|
|
|
|
ME |
|||
|
|
25,9 |
||
|
nE = |
|
||
|
|
74 |
||
|
|
|
||
|
nE ≈ |
0,35 mol |
||
- Calculer le rendement de la réaction. Conclure.
- Rendement de la réaction : il se calcule par rapport au réactif limitant :
|
ρ = |
0,35 |
||
|
|
|
|
|
|
0,35 |
|||
|
|
|
||
|
ρ ≈ |
100 % |
||
- Le rendement est proche de 1, car on extrait l'ester au fur et à mesure qu'il se forme.
-
On déplace l'équilibre dans le sens de l'estérification.
- Donner les caractéristiques de l'ester obtenu.
- L'ester obtenu est pratiquement pur.
- C’est
un liquide incolore de densité d
≈
0,92
à l’odeur de rhum.