|
|
Transformations acido-basiques |
|
|
|
|
|
1)- Acide et base selon Bronsted.
|
|
c)-
La mesure et sa précision. 2)- Mesure du pH de différentes solutions
aqueuses.
QCM r
Pour s'auto-évaluer Réactions acido-basiques (Questy) |
|
Exercices : énoncé avec corrcetion
Préparation à l'ECE : Désamérisation des olives
1)- Exercice 04 page 22
Identifier un transfert d’ion hydrogène.
2)- Exercice 05 page 22 :
Identifier les couples acide-base.
3)- Exercice 06 page 22 :
Équation d’une réaction acide-base.
4)- Exercice 08 page 23 :
Calculer le
pH
d’une solution.
5)- Exercice 10 page 23 :
Il en voit de toutes les couleurs.
6)- Exercice 12 page 23 :
Les coraux face à l’acidification des océans.
7)- Exercice 14 page 24 :
Nettoyer à l’ammoniac.
8)- Exercice 17 page 25 :
9)- DS N° 01 : Exercice 19
page 26 : L’uréase dans le milieu réactionnel (30 min).
10)- Activité
expérimentale : Désamérisation des olives.
|
1)- Acide et base selon
Bronsted.
![]()
-
(Svante
Arrhenius chimiste
suédois 1859 – 1927)
-
Pour le chimiste
suédois, Arrhenius
(1887),
-
Un acide
AH est une
substance capable de fournir des protons H+
en solution aqueuse.
-
Une base
BOH est une
substance capable de fournir des ions hydroxyde
HO–
en solution aqueuse.
-
Remarque :
-
Cette définition ne fonctionne que
dans l’eau et ne
prend pas en compte toutes les réactions acide-base observées.
![]()
-
(Joannes Nicolaus
Bronsted :
chimiste danois 1879 – 1947) :
-
Pour
Bronsted (1922),
une base est une espèce chimique capable de capter un proton
H+.
-
Il s’agit d’un cas
particulier de la théorie de Lewis.
-
Le proton
H+
joue le rôle d’un acide de Lewis et l’ion hydroxyde
![]() joue le rôle de base de Lewis
joue le rôle de base de Lewis

-
Remarque :
-
Cette
définition est plus large que celle d’Arrhenius
et s’applique à d’autres milieux
que l’eau.
![]()
-
(Gilbert Newton
Lewis : chimiste
américain 1875 – 1946)
-
Selon
Lewis (1916) ) :
-
Un acide de Lewis est
une entité chimique dont l’un des atomes possède une lacune électronique.
-
Ainsi le trifluorure
de bore BF3
est un acide de Lewis.
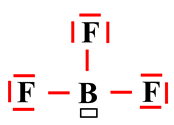
-
Il manque un doublet
d’électrons à l’atome de bore pour s’entourer de huit électrons (règle de
stabilité : règle de l’octet).
-
Il porte donc une
lacune électronique :
-
On ajoute une case
rectangulaire autour de l’atome de bore pour signaler la présence cette lacune
électronique.
-
Une base de Lewis est
une entité chimique dont l’un des atomes possède un doublet non liant.
-
La molécule d’ammoniac
NH3
est une base de Lewis.
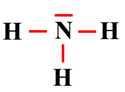
-
L’atome d’azote porte
un doublet non liant.
- La théorie de Lewis, formulée en 1923, est la plus générale des trois grandes définitions des acides et des bases.
-
Elle s’appuie non plus sur les
protons (H⁺) comme
chez Bronsted, mais sur les électrons.
-
Un acide
est une espèce chimique capable d’accepter une
paire d’électrons.
-
Une base
est une espèce chimique capable de donner une
paire d’électrons.
-
Exemple classique
:
-
La réaction entre
NH3
(ammoniac) et BF3
(trifluorure de bore)
-
NH3
possède un doublet libre : c’est une base de Lewis.
-
BF3
a une lacune électronique : c’est un acide de Lewis.
-
Ils forment ensemble un
complexe d’addition.
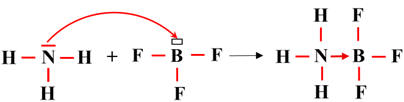
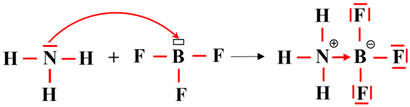
-
On obtient un complexe d’addition
d’ammoniac-trifluorure de bore : NH3
- BF3
-
Il existe une liaison covalente dative de coordination entre l’atome d’azote et
l’atome de bore.
-
Avantage de cette théorie :
-
Elle permet d'expliquer des réactions même sans ions H⁺ ou
OH⁻, en chimie
organique ou en phase gazeuse, par exemple.
-
Elle englobe et généralise les définitions précédentes.
-
Pour le chimiste
danois Joannes Nicolaus Bronsted un
transfert d’ion hydrogène H+
a lieu entre un acide et une base.
-
Un
acide
est une espèce chimique capable de céder
au moins un ion
hydrogène H+.
-
L’acide
AH
se transforme alors en sa base conjuguée
A–.
-
Écriture formelle :
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Une
base
est une espèce chimique capable de capter
au moins un hydrogène
H+.
-
La
base
A–
se transforme alors en son acide conjugué
AH.
-
Écriture formelle :
|
A–
(aq) |
+
|
H+ |
→ |
AH
(aq) |
|
Base |
|
ion hydrogène |
|
Acide |
-
Exemples :
-
L’acide éthanoïque :
|
CH3COOH
(aq) |
→ |
CH3COO–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
En cédant un
ion hydrogène
H+,
l’acide éthanoïque CH3COOH
(aq)
se transforme en ion éthanoate CH3COO–
(aq).
-
L’ion éthanoate :
|
CH3COO–
(aq) |
+
|
H+ |
→ |
CH3COOH
(aq) |
|
Base |
|
ion hydrogène |
|
Acide |
-
En captant un
ion hydrogène
H+,
l’ion éthanoate CH3COO–
(aq) se transforme
acide éthanoïque CH3COOH
(aq).
-
L’acide éthanoïque CH3COOH
(aq)
et
l’ion éthanoate CH3COO–
(aq) sont des espèces conjuguées.
-
L’acide
AH
et sa base conjuguée
A–
forment un couple acide-base
noté AH
/ A–.
-
IL est possible de
passer d’un à l’autre par transfert d’un ion hydrogène.
-
Écriture de la
demi-équation du couple acide-base :
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Signification :
-
Le signe  signifie
que le transfert d’ion hydrogène peut se produire dans les deux sens.
signifie
que le transfert d’ion hydrogène peut se produire dans les deux sens.
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou bien |
||||
|
A–
(aq) + H+
|
→ |
AH
(aq) |
|
|
- Quelques couples acide-base.
-
Tableau de quelques
couples acide-base
conjuguée
|
Acide |
Base conjuguée |
|
HCOOH
Acide formique
Acide méthanoïque |
HCOO –
Ion formiate
Ion méthanoate |
|
CH3COOH
Acide acétique
Acide éthanoïque |
CH3COO –
Ion acétate
Ion éthanoate |
|
C6H5COOH
Acide benzoïque
|
C6H5COO –
Ion benzoate
|
|
(CO2, H2O)
Dioxyde de
carbone
dissous dans
l’eau |
HCO3–
Ion
hydrogénocarbonate |
|
NH4+
Ion ammonium |
NH3
Ammoniac |
|
H3O
+
Ion oxonium |
H2O
Eau |
|
H2O
Eau |
HO –
Ion hydroxyde |
-
L’eau appartient à
deux couples acido-basiques.
-
L’ion H3O+
est l’acide du couple H3O+
(aq) / H2O
(ℓ)
-
L’ion HO–
(aq) est la base du couple H2O
(ℓ) / HO–
(aq).
-
L’eau est la
base du couple H3O+
(aq) / H2O
(ℓ) et l’acide du couple H2O
(ℓ) / HO–
(aq).
-
On dit que l’eau est
un ampholyte ou une espèce amphotère.
-
Espèce amphotère :
-
Une espèce amphotère
est à la fois l’acide
d’un couple et la base
d’un autre couple.
-
Exemple :
|
Acide |
Base |
|
H2O
(ℓ) |
/
HO–
(aq) |
|
H3O+
(aq) |
/
H2O
(ℓ) |
d)-
Retour
sur le schéma de Lewis.
|
- L’électronégativité χ d’un atome traduit sa capacité à attirer le doublet d’électrons
d’une liaison covalente dans laquelle il est engagé. - Une liaison A – B est
polarisée si χA –
χB ≥ 0,4
-
Si cette condition est vérifiée : - Alors, il apparaît une charge partielle
négative
|
-
Représentation :
|
|
|
|
►
Cas d’une molécule d’acide carboxylique :
-
Le schéma de Lewis de
l’entité acide ou basique permet de comprendre son processus de formation.
-
Considérons une
molécule d’acide carboxylique et la liaison oxygène –hydrogène qu’elle possède.
-
L’oxygène est plus
électronégatif que l’hydrogène :
-
χ
(O) =
3,4 et χ
(H) =
2,2
-
Il attire vers lui le
doublet de liaison : on dit que la liaison O –
H est polarisée.
-
Cette polarisation
fait apparaître :
-
Un excédent de charge
négative, noté –
q ou (![]() ),
sur l’atome d’oxygène (q
représente une charge partielle).
),
sur l’atome d’oxygène (q
représente une charge partielle).
-
Un excédent de charge
positive, noté +
q ou (![]() ),
sur l’atome d’hydrogène.
),
sur l’atome d’hydrogène.
-
Ceci favorise le
départ de l’atome d’hydrogène lié à l’atome d’oxygène.
-
Exemple : Le couple NH4+
/ NH3 :
-
Schéma de Lewis de la
molécule d’ammoniac :

-
Le doublet non liant
situé sur l’atome d’azote est un site donneur de doublet d’électrons.
-
Il permet de se lier à
l’ion hydrogène qui présente une lacune en électron.
-
On obtient ainsi l’ion
ammonium :
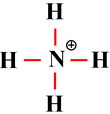
-
Du point de vue de
Bronsted :
|
NH4+
(aq) |
|
NH3
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
3)-
Solutions aqueuses acides et basiques.
a)-
L’ion oxonium (autrefois
hydronium) :
-
L'eau est capable de
dissoudre un certain nombre de substances solides, liquides et gazeuses.
-
On obtient des
solutions aqueuses.
-
L'eau est un solvant
polaire.
-
La molécule d'eau est
électriquement neutre, mais l'atome d'oxygène est plus électronégatif que
l'atome d'hydrogène ( H :
χ (H)
= 2,2 et O :
χ (O)
= 3,4).
-
En conséquence, il
apparaît une charge partielle négative 2 (– q)
sur l'atome d'oxygène et une charge partielle positive
+ q sur chaque
atome d'hydrogène.
-
Les deux liaisons
covalentes O – H
d’une molécule d’eau sont polarisées.
-
Dans l'eau, l'ion
hydrogène H+
joue un rôle très particulier du fait de sa petite taille (rH+
= 10–15 m).
-
Il est beaucoup plus
petit que toute autre espèce chimique.
-
Dépourvu d'électrons,
il peut s'approcher de très près d'une autre espèce chimique riche en électrons.
|
La molécule d’eau |
l’ion oxonium |
|
α ≈
105 °
|
|
-
Il crée une
association à la fois solide et de brève durée de vie avec une molécule d'eau
pour donner l'ion oxonium : H3O+.
- Page web : Réaction chimique par échange de proton
b)-
Les solutions aqueuses acides
et basiques :
-
On
solution aqueuse, l’ion hydrogène s’associe à une molécule d’eau pour former
l’ion oxonium H3O+.
-
Solutions aqueuse
acides :
|
Solutions
aqueuses
acides |
Notation |
Solutions
aqueuses
basiques |
Notation |
|
Acide
éthanoïque |
CH3COOH
(aq) |
Soude ou
Hydroxyde
de sodium |
Na+(aq) +
HO– (aq |
|
Acide
chlorhydrique |
H3O+(aq)
+
Cℓ– (aq) |
Ammoniac |
NH3
(aq) |
|
Acide
nitrique |
H3O+(aq)
+ NO3–
(aq) |
Éthanoate
de sodium |
Na+(aq) +
CH3COO–
(aq |
-
Solution aqueuse
d’acide éthanoïque :
-
Notation :
CH3COOH
(aq)
-
Solution aqueuse
d’acide chlorhydrique :
-
Notation :
H3O+(aq)
+
Cℓ– (aq)
-
Solution aqueuse
d’acide nitrique :
-
H3O+(aq)
+
NO3–
(aq)
-
Solution aqueuse
basiques :
-
Solution aqueuse de
soude (ou d’hydroxyde de sodium)
-
Na+(aq) + HO–
(aq)
-
Solution aqueuse
d’ammoniac :
-
NH3
(aq)
-
Remarque :
-
Les ions
Na+(aq),
Cℓ– (aq) et NO3– (aq) sont des ions spectateurs pour les réactions acide-base.
-
Ils n’ont aucun
caractère acide ou basique.
-
Au cours d’une
réaction acide-base, l’acide d’un couple réagit avec la base d’un autre couple.
-
Une réaction
acido-basique consiste à un transfert d'un proton entre l’acide
A1H d’un
couple sur la base A2–
d’un autre couple.
-
Couple acide / base 1
: A1H ![]() H+ +
A1–
H+ +
A1–
-
Couple acide / base 2
: A2H ![]() H+
+ A2–
H+
+ A2–
-
Équation de la
réaction :
-
On se place dans le
cas où l’acide A1H
réagit sur la base A2–
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
ou
A1H
+
A2–
→
A1–
+
A2H
-
L’équation s’écrit
avec
-
une double flèche
![]() si
la réaction est non totale ;
si
la réaction est non totale ;
-
une simple flèche
→ si la réaction est totale.
-
cette
réaction met en jeu les couples acide / base suivants :
A1H
/ A1–
et A2H /
A2–.
-
Réaction entre l’acide éthanoïque et
l’eau :
-
Cette réaction met en
jeu les couples suivants :
-
CH3COOH
(aq) /
CH3COO
–
(aq) :
CH3COOH
(aq) ![]() CH3COO
–
(aq) +
H+
CH3COO
–
(aq) +
H+
-
H3O+
(aq) /
H2O
(ℓ) :
H3O+
(aq)
![]() H2O
(ℓ) +
H+
H2O
(ℓ) +
H+
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
H2O
(ℓ) |
+ |
H+ |
|
H3O+ (aq) |
|
|
(2) |
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O+ (aq) |
(1) + (2) |
-
La double flèche
![]() indique
que la réaction n’est pas totale.
indique
que la réaction n’est pas totale.
-
Un transfert de
protons a lieu entre les deux couples acide / base.
-
Réaction entre l’acide
éthanoïque et l’ammoniac :
-
Cette réaction met en
jeu les couples suivants :
-
CH3COOH
(aq) /
CH3COO
–
(aq) :
CH3COOH
(aq)  CH3COO
–
(aq) +
H+
CH3COO
–
(aq) +
H+
-
NH4
+
(aq) /
NH3
(aq) :
NH4
+
(aq)  NH3 (aq)
+
H+
NH3 (aq)
+
H+
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
NH3
(aq) |
+ |
H+ |
|
NH4
+ (aq)
|
|
|
(2) |
|
CH3COOH
(aq) |
+ |
NH3
(aq) |
→ |
CH3COO
– (aq) |
+ |
NH4
+ (aq)
|
(1) + (2) |
-
La flèche →
indique que la réaction est totale.
-
Un transfert de
protons a lieu entre les deux couples acide / base.
-
Toutes les solutions
aqueuses contiennent les ions oxonium H3O+
(aq) et les ions hydroxyde HO–(aq).
-
L’eau distillée
contient des molécules d’eau H2O
(ℓ) (espèce majoritaire) mais aussi des ions oxonium
H3O+
(aq) et des ions hydroxyde HO–(aq).
-
Ces ions sont en
quantités égales et de très faibles concentrations.
-
À 25 ° C :
-
[H3O+]
= [HO–]
= 1,0 × 10–7 mol .L–1
-
Comme la valeur de la
concentration molaire [H3O+]
peut varier entre
-
quelques mol . L–1 et 10–14 mol
. L–1,
-
le chimiste danois
SORENSEN proposa une grandeur plus facile à manipuler, le
pH (1909).
-
La notation
pH est
l’abréviation de « potentiel d’Hydrogène ».
-
SORENSEN a compris que le facteur déterminant n’était pas la concentration en
acides, mais la concentration en ions hydrogène
H+
provenant de ces acides.
-
C’est
ainsi qu’il a été amené à définir le
pH.
-
Par la
suite, la définition du
pH a évolué pour faire intervenir les
ions oxonium H3O+
(aq), forme solvatée des ions hydrogène
H+.
2)- Définition du
pH d’une solution
aqueuse.
-
Le
pH
d’une solution est un indicateur d’acidité lié à la présence des ions oxonium
H3O+
(aq) en solution.
|
Pour une solution diluée, [H3O+]
< 0,050 mol . L–1,
Le pH
est défini par la relation suivante :
Cette relation
est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] : concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
Remarques :
-
On
écrit aussi : pH = – log [H3O+] (relation
utilisée jusqu’en 2010)
-
Le
pH
d’une solution est mesuré avec un
pH-mètre. (IV-1)-)
-
Le
pH
augmente si [H3O+] diminue
et inversement.
-
La
fonction « log » représente la fonction
logarithme décimal.
-
log 1 =
0 ; log 10 = 1 ; log 10n
= n
-
La
fonction log
est différente de la fonction logarithme népérien noté
ln.
-
C’est
la fonction réciproque de la fonction
f
(x)
= 10x
-
Ainsi :
log (10x) =
x
est équivalent à 10log
(10x)
= x
pour
x > 0
-
La connaissance du
pH permet de
calculer la concentration molaire en ions H3O+.
-
Exemple 1 :
-
pH
= 2,0 ;
-
[H3O+]
= C0
×10–
pH mol
. L–1
-
[H3O+]
= 1,0 × 10–
2 mol
. L–1
-
[H3O+]
= 1,0 × 10–
2 mol
. L–1
-
Le
pH augmente d’une
unité lorsque la concentration
[H3O+]
est divisée par dix.
-
Exemple 2 :
-
On donne l’équation de
la réaction de l’acide sulfurique sur l’eau :
-
H2SO4
(ℓ) + H2O (ℓ) → 2 H3O+
(aq) + SO42–
(aq)
-
Soit
C
la concentration en acide sulfurique (soluté apporté) :
-
C
= 2,0 ×10–2 mol . L–1
-
Quelle est la
concentration des différentes espèces chimiques dans la solution ?
-
En
déduire la valeur du pH de la solution :
|
|
H2SO4
(ℓ) |
+ H2O
(ℓ) |
→ |
2
H3O+
(aq) |
+
SO42–
(aq) |
|
Coefficient
stœchiométriques |
1 |
1 |
|
2 |
1 |
|
Concentration
|
C |
Solvant |
|
2 C |
C |
-
Concentration en ions
oxonium :
-
[H3O+]
=
2 C
= 2 × 2,0 ×10–2 mol . L–1
-
[H3O+]
=
4,0
×10–2 mol . L–1
-
Concentration en ions
sulfate :
-
[SO42–]
=
C = 2,0 ×10–2
mol . L–1
-
Valeur
du pH
de la solution :
-
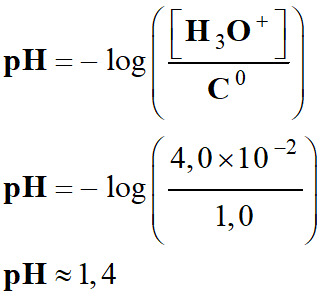
a)-
Les
indicateurs colorés et le papier
pH.
-
Comme
indicateurs colorés, on utilise, l'hélianthine,
le bleu de bromothymol (B.B.T) et
la phénolphtaléine.
- BBT :
- Formule brute : C27H28Br2O5S

- Les différentes teintes prises par le B.B.T suivant la valeur du pH de la solution :

-
Hélianthine :
-
Phénolphtaléine :
-
L'utilisation des
indicateurs colorés permet de déterminer un encadrement de la valeur du
pH d'une solution.
-
Le
papier pH :
-
Le papier
pH est imbibé d'un
mélange de plusieurs indicateurs colorés, il peut donner une valeur du
pH à 0,5 unité
près.
-
Il est constitué d’une
sonde de mesure reliée à un voltmètre électronique.
-
La sonde de mesure est
constituée d’une électrode de verre et d’une électrode de référence (les deux
électrodes peuvent être combinées ou séparées).
-
La tension
U qui apparaît aux
bornes de la sonde lorsqu’elle est plongée dans une solution aqueuse est une
fonction affine du pH :
-
U
= a pH
+ b.
-
Les grandeurs
a et
b sont des
coefficients positifs qui dépendent de la température de la solution et de
l’état des électrodes.
-
Il est nécessaire
d’étalonner le pH-mètre
avant toute mesure.
-
L’étalonnage du
pH-mètre nécessite
l’utilisation de deux solutions étalons (solutions tampons) de
pH connu.
-
Mesure du
pH :
-
Pour effectuer la
mesure du pH
d’une solution aqueuse, la sonde doit être rincée à l’eau distillée, essuyée
puis plongée dans la solution étudiée.
-
Après agitation et
stabilisation de la mesure, la valeur du pH
est relevée.




Montage permettant d'effectuer un
suivi pH-métrique
lors d'une réaction acido-basique.
(Exemple : on peut
réaliser un dosage
pH-métrique)

c)-
La mesure et sa précision.
-
Dans les conditions
habituelles, au lycée, on peut mesurer un pH,
au mieux, à 0,05 unité près (le plus souvent à 0,1 unité près).
|
Précision de la mesure :
|
-
Application :
-
Déterminer la valeur
de la concentration [H3O+]
sachant que le
pH de la solution
vaut :
-
pH
= 3,9 ;
-
[H3O+]
= C0
×10–
pH mol
. L–1
-
[H3O+]
=
1,0 ×
10–
3,9 mol
. L–1
-
[H3O+]
≈ 1,3 × 10–4 mol
. L–1
2)- Mesure du
pH de différentes
solutions aqueuses.
|
Concentration |
C
mol . L–1 |
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
|
Acide
éthanoïque |
pH |
2,9 |
3,4 |
3,9 |
4,5 |
5,2 |
6 |
6,79 |
6,98 |
|
Acide
chlorhydrique |
pH |
1,1 |
2 |
3 |
4 |
5 |
6 |
6,79 |
6,98 |
|
|
– log
C/C0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
-
Les solutions d'acide
éthanoïque sont nettement moins acides que celle de l'acide chlorhydrique de
même concentration.
-
la réaction entre
l'acide éthanoïque et l'eau est une réaction rapide mais limitée.
-
Une solution aqueuse
d'acide éthanoïque contient les espèces suivantes :
-
Espèce
majoritaire : CH3COOH
; espèces minoritaires : :
CH3COO–
; H3O+;
-
Espèce
ultra minoritaire : OH–
-
On
donne à la solution aqueuse la formule de l'espèce majoritaire :
CH3COOH
(aq).
QCM r
|
Exercices :
1)- Exercice 04 page 22
Identifier un transfert d’ion hydrogène.
2)- Exercice 05 page 22 :
Identifier les couples acide-base.
3)- Exercice 06 page 22 :
Équation d’une réaction acide-base.
4)- Exercice 08 page 23 :
Calculer le
pH
d’une solution.
5)- Exercice 10 page 23 :
Il en voit de toutes les couleurs.
6)- Exercice 12 page 23 :
Les coraux face à l’acidification des océans.
7)- Exercice 14 page 24 :
Nettoyer à l’ammoniac.
8)- Exercice 17 page 25 : Di
9)- DS N° 01 : Exercice 19
page 26 : L’uréase dans le milieu réactionnel (30 min).
10)- Activité
expérimentale : Désamérisation des olives.
|
|
|