|
Préparation à l’ECE : Désamérisation des olives
1.
Protocole
expérimental :
►
Dans un premier
temps : Préparation d’une solution d’acide chlorhydrique :
-
Une préparation
possible : on dissout du chlorure d’hydrogène gazeux dans de l’eau.
- Le
chlorure d’hydrogène est une gaz très soluble dans l’eau.
-
Réaction entre
HCℓ (g) et l’eau :
-
La transformation
est totale :
|
HCℓ
(g)
|
|
|

|
Cℓ –
(aq)
|
+
|
H+
|
(1)
|
|
H2O
(ℓ)
|
+
|
H+
|

|
H3O+
(aq)
|
|
|
(2)
|
|
HCℓ
(g)
|
+
|
H2O
(ℓ)
|
→
|
Cℓ–
(aq)
|
+
|
H3O+
(aq)
|
(1) + (2)
|
-
La solution d’acide
chlorhydrique se note : (H3O+
(aq) + Cℓ–
(aq))
-
Pour la solution
d’acide chlorhydrique S0 :
-
C = [H3O+]
= [Cℓ–] = 1,0 × 10–1
mol . L–1
►
Préparation de la
solution SA :
-
Solution fille :
-
Solution
SA d’acide
chlorhydrique :
-
Volume
V = 50 mL
-
CA = 1,0 × 10–2
mol . L–1 en ions oxonium.
-
Solution mère :
-
Solution
S0 d’acide
chlorhydrique
-
C = 1,0 × 10–1
mol . L–1
-
V0 = ?
-
Il s’agit d’une
dilution : le solvant est l’eau
►
Calcul
préparatoire :
-
Au cours d’une
dilution, il y conservation de la quantité de matière de soluté.
|
Solution
mère
Solution
S0
|
C
= 1,0 × 10–1 mol . L–1
|
|
Solution
fille
Solution
SA
|
CA
= 1,0 × 10–2 mol . L–1
|
|
V0
= ?
|
→
|
V
= 50 mL
|
|
Quantité
de matière
|
n
= C . V0
|
|
Quantité
de matière
|
n
= CA . V
|
-
Relation de
conservation : n =
C . V0 =
CA .
V
-
On peut calculer le
facteur de dilution :
-
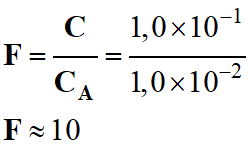
-
Volume de la
solution S0 nécessaire :
-
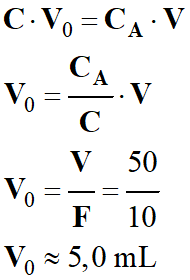
►
Protocole :
|
Première étape :
Verser
suffisamment
de solution Mère
dans un bécher
|
Deuxième étape :
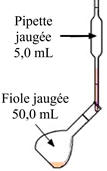
On
prélève le volume
nécessaire de solution
Mère à l’aide d’une
pipette jaugée munie
de sa propipette
|
Troisième
étape :
On
verse le volume
nécessaire de solution
dans la fiole jaugée de
volume approprié..
|
|
On
ne pipette jamais
directement dans le
flacon qui contient
la solution
Mère
|
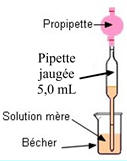
|
|
|
Quatrième étape :
On
ajoute de
l’eau distillée
et on agite
mélanger et
homogénéiser
|
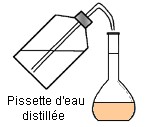
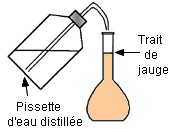
Cinquième étape :
On
complète
avec une pissette
d’eau distillée
jusqu’au trait
de
jauge.
|
Sixième
étape :
on
agite pour
homogénéiser.
La solution
est prête.
|
|
|
|


|
2.
Protocole pour
neutraliser la solution S de saumure.
-
La solution
S de saumure est une solution
aqueuse de chlorure de sodium :
-
Formule de la
solution : (Na+
(aq) + Cℓ–
(aq))
-
Les ions sodium et
les ions chlorure sont des ions indifférents du point de vue
acido-basique.
-
Le
pH de la solution de saumure
est égal 7,0.
-
Pour abaisser le
pH = 5,0 de la solution S,
il faut ajouter un volume V
de la solution SA
d’acide chlorhydrique.
-
À partir de la
connaissance de la valeur du pH,
- on peut calculer la valeur de la concentration en ions oxonium de la
solution obtenue :
-
Le pH d’une
solution est un indicateur d’acidité lié à la présence des ions oxonium
H3O+ (aq) en solution.
|
Pour une
solution
diluée, [H3O+]
< 0,050 mol . L–1,
Le pH
est défini par la relation suivante :
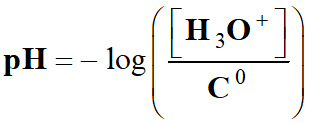
Cette
relation est équivalente à :
[H3O+]
= C0 . 10–pH
|
|
pH :
grandeur sans unité
|
|
[H3O+] : concentration en ions oxonium en mol . L–1
|
|
C0 :
concentration standard : C0 = 1,0 mol . L–1
|
-
[H3O+] =
C0 . 10–pH
-
[H3O+] ≈ 1,0 × 10–5
mol . L–1
-
On ne tient pas
compte de l’augmentation de volume lors de l’ajout de l’acide
chlorhydrique.
- On néglige la présence des ions oxonium dans la
solution S neutralisée.
-
Quantité de matière
d’ions oxonium présente dans la solution obtenue :
-
n (H3O+)
= [H3O+]
× V
-
n (H3O+)
≈ 1,0 × 10–5 × 1,0
-
n (H3O+)
≈ 1,0 × 10–5 mol
-
Volume
VA de solution
SA nécessaire :
-
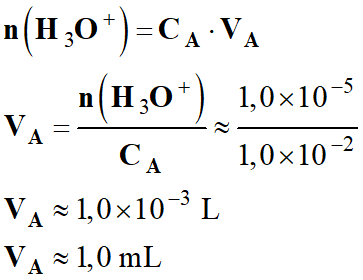
-
On peut négliger le
volume VA ≈ 1,0 mL devant le volume
V = 1,0 L.
3.
Lister les
éventuelles sources d’erreurs expérimentales.
-
Le
pH de la solution obtenue est
de 5,1.
-
Le
pH attendu est
pH = 5,0 :
-
Erreurs possibles :
-
Le pH-mètre est mal
étalonné.
-
Volume de l’acide
prélevé lors de la préparation de la solution
SA ?
-
Volume prélevé de
la solution SA ?
-
[H3O+] =
C0 . 10–pH
-
[H3O+] = 1,0 × 10–5,1
mol . L–1
-
[H3O+] = 7,9 × 10–6
mol . L–1
-
Quantité de matière
d’ions oxonium présente dans la solution obtenue :
-
n (H3O+)
= [H3O+]
× V
-
n (H3O+)
≈ 7,9 × 10–6 × 1,0
-
n (H3O+)
≈ 7,9 × 10–6 mol
-
Volume
V’A de solution
SA nécessaire dans
ce cas :
-
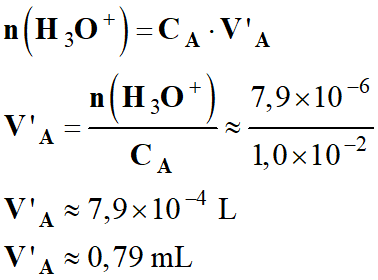
-
Erreur :
-
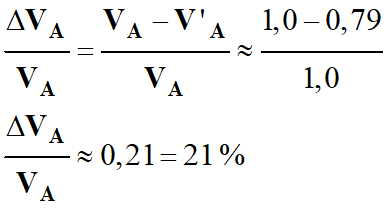
-
Erreur sur le
volume versé de 21 % environ (erreur importante).
-
Instruments mal
rincés.
►
Désamérisation des
olives.
-
Pour la
désamérisation des
olives à la soude, c'est la
lessive de soude qui doit être utilisée.
-
C'est cette
opération qui va ôter l'oleuropéine amère.
-
Le processus
consiste à tremper les olives
dans un mélange de lessive de soude et d'eau.
-
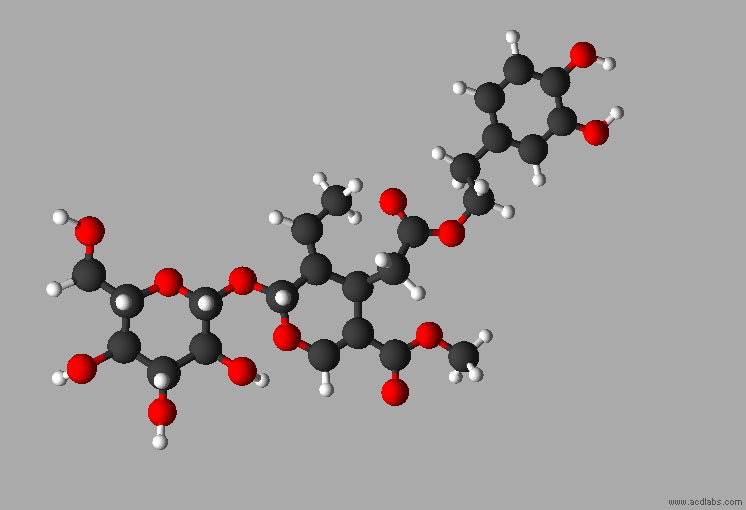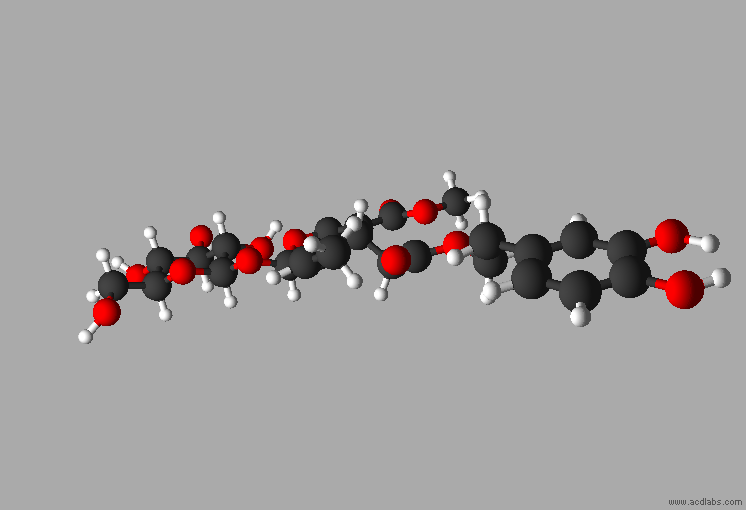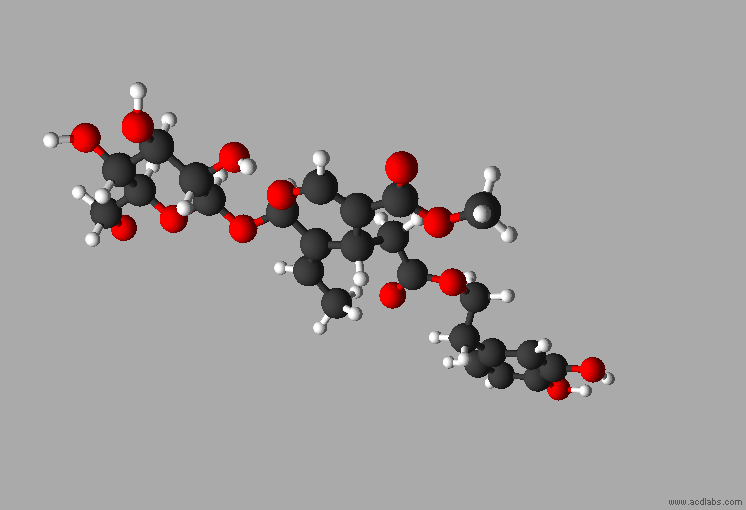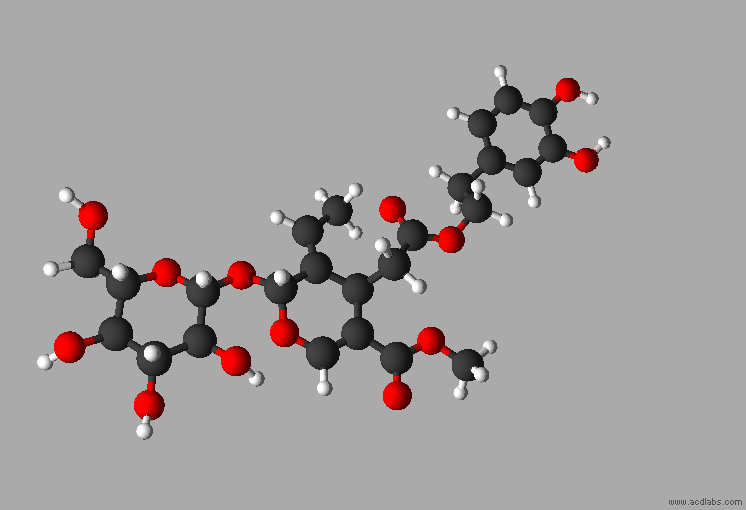
L'oleuropéine
est un composé phytochimique présent dans les feuilles d'olivier,
dans
l'olive crue et dans l'huile d'olive.
-
Formule brute :
C25H32O13
-
Masse molaire :
M = 540,5 g . mol–1
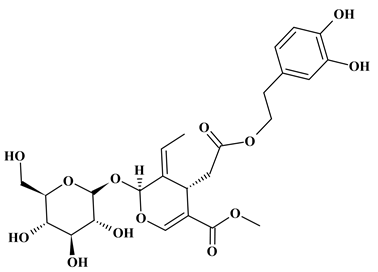
Nom :
- méthyl(4S,5E,6S)-4-[2-[2-(3,4-dihydroxyphényl)éthoxy]
-2-oxoéthyl]-5-éthylidène-6-[(2S,3R,4S,5S,6R)
-3,4,5-trihydroxy-6-(hydroxyméthyl)oxan-2-yl]oxy-4H-pyran-3-carboxylate
|