|
Les transformations acido-basiques |
|
|
|
|
|
|
QCM N° 01
Les transformations acido-basiques
Les acides et les bases
La réaction acide-base
Le pH d’une solution
Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’acide
méthanoïque HCOOH
(aq) est un acide au sens de
Bronsted :
|
Il capte
un ion
hydrogène H+. |
Il cède
un ion
hydrogène H+. |
Sa base
conjuguée
est HCOO– (aq) |
BC |
|
2 |
L’acide conjugué
de l’ion
hydrogénocarbonate HCO3–
(aq) est : |
CO32–
(aq) |
CO2,
H2O (aq) |
HCO3+
(aq) |
B |
|
3 |
Une espèce
amphotère : |
Est à la fois
un acide
et une base |
Appartient à
deux couples
acide-base
différents |
N’est ni
un acide,
ni une base |
AB |
|
4 |
L’ion
hydrogénosulfate HSO4–
(aq) appartient au(x) couple(s)
acide-base
suivant(s) : |
HSO4–
(aq) /
H2SO4 (ℓ) |
H2SO4
(ℓ) /
HSO4– (aq) |
HSO4–
(aq) /
SO42– (aq) |
BC |
|
5 |
H3O+
(aq) + NO3– (aq) désigne une
solution : |
D’acide
oxonium |
D’acide
éthanoïque |
D’acide
nitrique |
C |
|
6 |
Dans une
solution d’hydroxyde de
sodium Na+
(aq) + HO– (aq) : |
Les deux ions
sont des bases |
Seul l’ion
hydroxyde
HO–
(aq)
est une base |
Seul l’ion
sodium
Na+
(aq)
est une base |
B |
|
7 |
L’acide
cyanhydrique HCN
(aq) réagit avec l’ion hydroxyde
HO–
(aq). L’équation de la réaction
est : |
HCN (aq)
+ HO– (aq) ↓ CN– (aq)
+ H2O (ℓ) |
CN– (aq)
+ H2O (ℓ) ↓ HCN (aq)
+ HO– (aq) |
HCN (aq)
+ HO– (aq) ↓ CN– (aq)
+ H3O+ (aq) |
A |
|
8 |
Soit les
réactions opposées
d’équation : NH4+ (aq)
+ HS– (aq)
NH3 (aq)
+ H2S (aq) Les couples mis
en jeu sont :
|
NH4+
(aq) / HS– (aq)
Et
H2S
(aq) / NH3 (aq) |
NH4+
(aq) / NH3 (aq)
Et
H2S
(aq) / HS– (aq) |
NH3
(aq) / NH4+ (aq)
Et
HS–
(aq) / H2S (aq) |
B |
|
9 |
Le nom de l’ion
de formule H3O+
(aq) est : |
Ion oxonium |
Ion hydroxyde |
Ion hydrogène |
A |
|
10 |
Lorsqu’une
solution acide est
diluée, le pH : |
Augmente |
Diminue |
N’est
pas modifié. |
A |
|
11 |
Le pH
d’une solution de concentration
en ions oxonium
H3O+ (aq) est égale à
1,0 × 10–2
mol . L–1 est : |
pH
= 1,0 |
pH
= 2,0 |
pH
= 3,0 |
B |
|
12 |
Le pH-mètre
affiche pH
= 3,0. Cette solution a une
concentration en ions oxonium
H3O+ (aq) égale à :
|
1,0 × 10–3
mol . L–1 |
3,0 × 10–3
mol . L–1 |
1,0 × 103
mol . L–1 |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Acides et bases selon Bronsted :
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion
hydrogène |
|
A–
(aq) |
+
|
H+ |
→ |
AH
(aq) |
|
Base |
|
ion
hydrogène |
|
Acide |
Couple acide-base.
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion
hydrogène |
 signifie que
le transfert d’ion hydrogène peut se produire dans les deux sens.
signifie que
le transfert d’ion hydrogène peut se produire dans les deux sens.|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou bien |
||||
|
A–
(aq) + H+
|
→ |
AH
(aq) |
|
|
Quelques couples :
|
Acide |
Base conjuguée |
|
HCOOH
Acide formique
Acide méthanoïque |
HCOO –
Ion formiate
Ion méthanoate |
|
CH3COOH
Acide acétique
Acide éthanoïque |
CH3COO
–
Ion acétate
Ion éthanoate |
|
C6H5COOH
Acide benzoïque
|
C6H5COO
–
Ion benzoate
|
|
(CO2,
H2O)
Dioxyde de carbone
dissous dans l’eau |
HCO3–
Ion hydrogénocarbonate |
|
NH4+
Ion ammonium |
NH3
Ammoniac |
|
H3O
+
Ion oxonium |
H2O
Eau |
|
H2O
Eau |
HO
–
Ion hydroxyde |
Espèce amphotère :
|
Acide |
Base |
|
H2O
(ℓ) |
/
HO–
(aq) |
|
H3O+
(aq) |
/
H2O
(ℓ) |
L’ion oxonium (autrefois hydronium)
|
La molécule d’eau |
l’ion oxonium |
|
α ≈
105 °
|
|
Les solutions aqueuses acides et basiques :
|
Solutions
aqueuses
acides |
Notation |
Solutions
aqueuses
basiques |
Notation |
|
Acide
éthanoïque |
CH3COOH
(aq) |
Soude ou
Hydroxyde
de sodium |
Na+(aq)
+ HO–
(aq |
|
Acide
chlorhydrique |
H3O+(aq)
+
Cℓ–
(aq) |
Ammoniac |
NH3
(aq) |
|
Acide
nitrique |
H3O+(aq)
+ NO3–
(aq) |
Éthanoate
de sodium |
Na+(aq)
+ CH3COO–
(aq |
La réaction acide-base :
A1H
+ A2– ![]() A1–
+ A2H
A1–
+ A2H
ou
A1H
+ A2–
→ A1–
+ A2H
Exemple : Réaction entre l’acide éthanoïque et l’eau
|
CH3COOH
(aq) |
|
|
|
CH3COO –
(aq) |
+ |
H+ |
(1) |
|
H2O
(ℓ) |
+ |
H+ |
|
H3O
+ (aq) |
|
|
(2) |
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO –
(aq) |
+ |
H3O
+ (aq) |
(1)+ (2) |
Définition du pH d’une solution aqueuse.
|
Pour une solution
diluée, [H3O+] < 0,050 mol
. L–1, Le pH est
défini par la relation suivante :
Cette relation
est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] :
concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
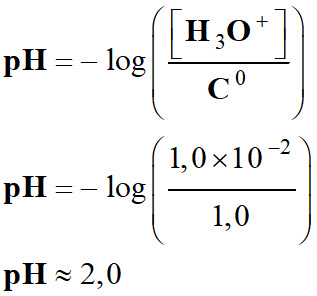
Échelle de pH
Exemple 1 :
Exemple 2 :
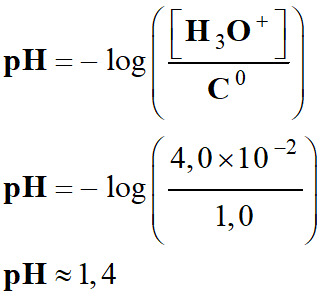
|
|