|
Réaction acido-basiques Acides - Bases |
|
|
|
|
|
|
QCM N° 01
Réactions acido-basiques
Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Lors d’une transformation chimique : |
De nouvelles espèces
chimiques
se forment |
Toutes les espèces
chimiques
du système
réagissent |
Tous les réactifs
sont
consommés |
A |
|
2 |
Lors d’une
transformation chimique, une espèce spectatrice : |
Est
entièrement
consommée |
Est
partiellement
consommée |
Ne
réagit
pas |
C |
|
3 |
On trempe un
morceau de craie CaCO3 (s) dans une solution d’acide chlorhydrique
(H+
(aq) + Cℓ– (aq)). Du dioxyde de carbone gazeux CO2 (g), des ions calcium Ca2+ (aq) et de l’eau H2O (ℓ) sont formés. Pour cette
transformation : |
Les réactifs
sont
CaCO3
(s)
H+
(aq)
Cℓ–
(aq) |
Les produits s
ont :
CO2
(g)
Ca2+
(aq)
H2O
(ℓ)
Cℓ–
(aq) |
Les ions
Cℓ–
(aq)
sont
spectateurs |
C |
|
4 |
On trempe une
lame de fer Fe (s) dans une solution d’acide chlorhydrique (H+
(aq) + Cℓ– (aq)) Du dihydrogène
H2 (g) et des ions fer Fe2+
(aq) sont formés. L’équation de la
réaction qui se produit est : |
Fe (s)
+ H+ (aq) +
Cℓ– (aq) → H2 (g)
+ Fe2+ (aq) +
Cℓ– (aq) |
Fe(s) + 2 H+(aq) → H2(g) + Fe2+(aq) |
H2(g) + Fe2+(aq) → Fe(s) + 2 H+(aq) |
B |
|
5 |
La masse volumique d’une espèce chimique :
|
Est égale
au quotient de la masse de cette
espèce par
son volume |
Est égale
au produit de la masse de cette
espèce par
son volume |
Peut
s’exprimer
sans unité |
A |
|
6 |
On considère une solution aqueuse de chlorure de sodium |
Il s’agit d’un
mélange
homogène |
Le soluté est
le chlorure
de sodium |
Le solvant est le
chlorure
de sodium |
AB |
|
7 |
Une solution aqueuse de chlorure de sodium est préparée en réalisant la dissolution de 5,85 g de chlorure de sodium dans
l’eau. On obtient 500
mL de solution. Donnée : M
(NaCℓ) = 58,5 g . mol–1 |
La concentration
en masse du
soluté dans
cette solution est de 2,93 g.L–1 |
Cette solution contient
0,10 mol
de soluté |
La concentration
en quantité de matière desoluté
dans cette
solution est
50 mol . L–1 |
B |
|
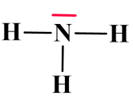
8 |
L’ammoniac a pour schéma de Lewis :
|
Cette molécule
comporte quatre
doublets |
L’atome
d’hydrogène
possède
un doublet
non liant |
L’atome
d’azote
possède un
doublet liant |
A |
|
9 |
Le
diméthylformamide (DMF) est un solvant organique très utilisé. Son modèle moléculaire est le suivant :
|
Les atomes
d’hydrogène forment
seulement
un doublet
liant chacun |
Les atomes
de carbone
et d’azote
forment
quatre
doublets
liants
chacun |
L’atome
d’oxygène
doit posséder
un doublet
non liant
pour respecter
la règle
de l’octet |
A |
|
10 |
L’acide malique
est un acide naturellement
présent dans certains fruits comme les pommes ou les raisins. Sa formule semi-développée est la suivante :
|
Pour obtenir
la formule
développée
de cette
molécule,
il suffit
de faire
apparaître les
liaisons avec les atomes
d’hydrogène |
Pour obtenir
le schéma
de Lewis de
cette molécule,
il suffit de
faire apparaître
les doublets
non liants |
Pour obtenir
le schéma
de Lewis de
cette molécule,
il suffit de
faire apparaître
les liaisons
avec les atomes
d’hydrogène |
A |
|
11 |
Une liaison est
polarisée si les atomes
qu’elle relie : |
Sont
différents |
Possèdent
des charges
électriques
partielles |
Ont une différence
d’électronégativité
inférieure à 0,4 |
B |
|
12 |
Parmi les
liaisons suivantes, laquelle ou lesquelles sont polarisés ? |
C
– H |
N – H |
C = O |
BC |
|
13 |
Le schéma de
Lewis de la molécule de
méthanol est le suivant :
|
Les liaisons C
– H
de la molécule
ne sont pas
polarisées |
Si la liaison O
– H venait à rompre,
l’oxygène
porterait une
charge négative
et l’hydrogène
une charge
positive |
La molécule
ne comporte
qu’une liaison
polarisée |
AB |
|
14 |
Si la différence
d’électronégativité entre deux atomes est
égale à 0,3 : |
L’atome le plus
électronégatif
porte une
charge partielle
négative δ–
et l’autre une
charge partielle
positive δ+. |
La liaison
covalente
n’est pas
polarisée |
Les atomes
ne portent
pas de
charge
partielle |
BC |
L’atome le plus électronégatif porte une charge partielle négative δ− et l’autre une charge partielle positive δ+.
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Réactions acido-basiques :
La notation
AH / A–
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion
hydrogène |
|
Acide |
Base |
|
H2O
(ℓ) |
/
HO–
(aq) |
|
H3O+
(aq) |
/
H2O
(ℓ) |
Les solutions aqueuses acides et basiques :
|
Solutions
aqueuses
acides |
Notation |
Solutions
aqueuses
basiques |
Notation |
|
Acide
éthanoïque |
CH3COOH
(aq) |
Soude ou
Hydroxyde
de sodium |
Na+(aq)
+ HO–
(aq |
|
Acide
chlorhydrique |
H3O+(aq)
+
Cℓ–
(aq) |
Ammoniac |
NH3
(aq) |
|
Acide
nitrique |
H3O+(aq)
+ NO3–
(aq) |
Éthanoate
de sodium |
Na+(aq)
+ CH3COO–
(aq |
|
Acide nitrique |
H3O+(aq)
+ NO3–
(aq) |
La transformation chimique ou réaction chimique :
|
Réactifs |
Transformation chimique |
Produits |
|
(
… ) + ( … ) |
→ |
(
… ) + ( … ) |
Équation bilan de la réaction :
CaCO3 (s) + 2 H+
(aq) → CO2 (g) + H2O (ℓ) + Ca2+
(aq)
Masse volumique d’une espèce chimique :
|
|
|
|
m |
Masse de l’espèce
chimique en kilogramme (kg) |
|
V |
Volume de l’espèce
chimique en mètre cube (m3) |
|
ρ |
Masse volumique en
kilogramme par mètre cube (kg . m–3) |
|
|
|
n
: quantité de matière de l’espèce chimique (mol) |
|
m :
masse de l’espèce chimique (g) |
|
M :
masse molaire de l’espèce chimique (g . mol–1) |
Les solutions aqueuses :
|
|
H2O |
|
|
|
|
NaCℓ (s) |
→ |
Na+
(aq) |
+ |
Cℓ–
(aq) |
|
n |
|
n |
|
n |
|
C= n / V |
|
C= n / V |
|
C= n / V |
|
|
|
|
m |
Masse de l’espèce
chimique en gramme (g) |
|
V |
Volume de la
solution en litre (L) |
|
t |
Concentration en
masse en gramme par litre (g . L–1) |
|
|
|
C :
concentration en quantité de matière (mol . L –1) |
|
n
: quantité de matière de l’espèce chimique (mol) |
|
Vsolution :
Volume molaire de l’espèce chimique gazeuse (L) |
|
|
|
C :
concentration en quantité de matière (mol . L –1) |
|
t
: concentration en masse (g. L –1) |
|
M :
masse molaire de l’espèce chimique (g. mol –1) |
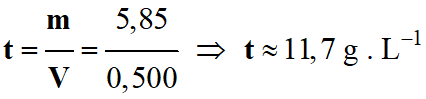
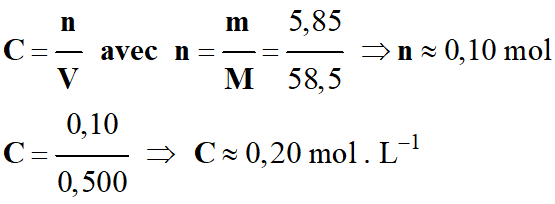
Schéma de Lewis :
Schéma de Lewis d’un atome :
Schéma de Lewis d’une molécule.
Schéma de Lewis de la molécule d’ammoniac :
Schéma de Lewis de la molécule d’ammoniac :
Application : Schéma de Lewis de la molécule de CO2.

Valence d’un atome :
 )
)
Diméthylformamide :
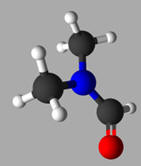
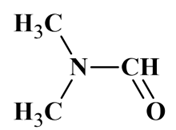
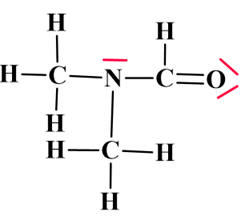
Les différentes représentations d’une molécule :

CH3 – CH2 – CH2 – CH3
ou


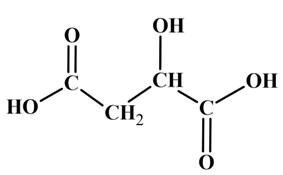
Acide 2- hydroxybutanedioïque
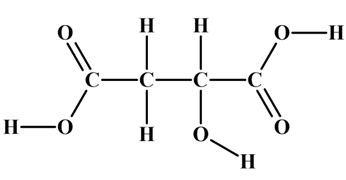
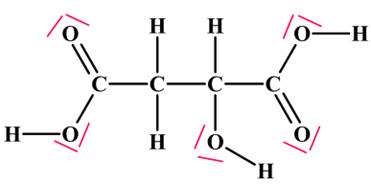
Polarisation d’une liaison :
Les notations :
|
|
|
|
Cas de la liaison C – H.
![]()
![]()
Molécule de méthanol :
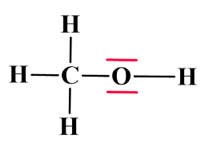
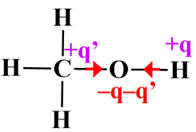
|
|
|
|
|
|