|
Efficacité d'une solution tampon |
|
|
|
|
|
|
Efficacité d’une solution tampon
Efficacité d’une solution tampon |
Efficacité d’une solution tampon :
- Les biochimistes utilisent fréquemment des
solutions tapons pour préparer les milieux de culture cellulaire.
- Ils les caractérisent par leur
pH et par
leur pouvoir tampon.
- Cette grandeur, noté
β, est une indication
de l’efficacité d’une solution tampon.
- Un biochimiste souhaite comparer l’efficacité de
deux solutions tampon S1 et
S2 de même
pH,
égal à 5,0.
- Une quantité
n d’acide chlorhydrique est ajoutée à un échantillon de volume
V de chaque solution ;
- Le
pH
du mélange est mesuré.
- Les résultats de trois essais sont donnés dans le
tableau ci-dessous.
|
Essai
N° |
V
en mL |
n
en mmol |
pH
mesuré |
|
|
1 |
2 |
|||
|
1 |
500 |
5,0 |
4,8 |
4,6 |
|
2 |
100 |
5,0 |
4,0 |
3,0 |
|
3 |
100 |
2,0 |
4,6 |
4,2 |
- Donnée :
- Le pouvoir tampon : ![]() avec ΔpH la variation de
pH.
avec ΔpH la variation de
pH.
- Question :
identifier la solution tampon la plus efficace.
- Une solution tampon est une solution aqueuse dont
le pH varie peu lors de l’addition :
en faible quantité :
- D’un acide ou d’une base
- Ou lorsque l’on la dilue faiblement.
- Préparation d’une solution tampon :
- Les solutions tampons peuvent être préparer en
utilisant un mélange équimolaire d’un acide faible et de sa base conjuguée.
- Un exemple
de solution tampon :
- Couple acide éthanoïque / ion éthanoate : CH3COOH (aq) / CH3COO
– (aq) :- CH3COOH
(aq) ![]() CH3COO
–
(aq) +
H+
CH3COO
–
(aq) +
H+
- Réaction entre l'acide éthanoïque et l'eau :
|
CH3COOH
(aq) |
|
|
|
CH3COO
– (aq) |
+ |
H+ |
(1) |
|
H2O
(ℓ) |
+ |
H+ |
|
H3O+ (aq) |
|
|
(2) |
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O+ (aq) |
(1) + (2) |
- Équation générale :
|
AH
(aq)
+ H2O (ℓ) |
|
H3O+ (aq)
+ A–
(aq) |
- La réaction entre l'acide éthanoïque et l'eau n'est pas totale. C'est une réaction limitée.
- On obtient un équilibre chimique.
- Cette réaction est caractérisée par une constante d'équilibre : la constante d'acidité de l'acide éthanoïque
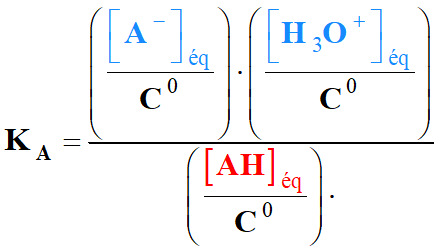
- Constante d’acidité :
|
|
|
|
KA |
Constante
d’acidité (sans unité) |
|
[AH]éq |
Concentration
de l’acide à l’équilibre (mol . L–1) |
|
[A–]éq
|
Concentration
de la base conjuguée (mol . L–1) |
|
[H3O+]éq |
Concentration
en ions oxonium (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
- Notation simplifiée :
- 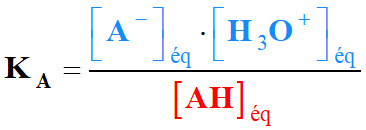
- pKA
= – log KA soit :
KA
= 10–pKA
- L’acide éthanoïque est un acide faible dans
l’eau :
- Valeur du
pKA de l’acide éthanoïque :
- pKA
= 4,8
- Relation :
- 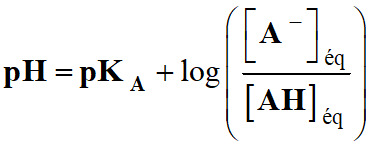
- Pour un mélange équimolaire d’acide éthanoïque et
d’ions éthanoate :
- pH =
pKA = 4,8
-
Exemple : couple CH3COOH (aq) / CH3COO – (aq) de pKA = 4,8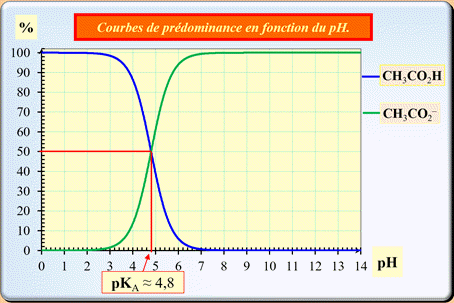
- Diagramme
de prédominance : cas général pour un acide faible
- représentation
sur un axe horizontal : couple AH /
A –.
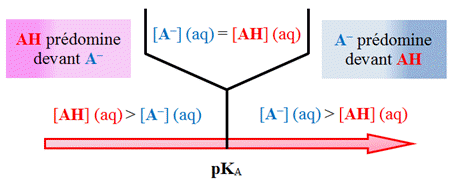
- Efficacité
d’une solution tampon :
- Le pouvoir tampon d’une solution est donné par
l’expression suivante :
- ![]()
- La variation de
pH, noté ΔpH, intervient
au dénominateur de l’expression de β.
- Si
ΔpH
↑, alors le pouvoir tampon β ↓.
- Le pouvoir tampon est une grandeur
caractéristique d’une solution tampon.
- À chaque solution tampon correspond une seule
valeur du pouvoir tampon.
- Une solution tampon est d’autant plus efficace
que son pouvoir tampon est élevée et que la variation de
pH est faible.
- On calcule le pouvoir tampon de chaque solution :
|
Essai
N° |
V
en mL |
n
en mmol |
pH
mesuré |
|
|
1 |
2 |
|||
|
1 |
500 |
5,0 |
4,8 |
4,6 |
|
2 |
100 |
5,0 |
4,0 |
3,0 |
|
3 |
100 |
2,0 |
4,6 |
4,2 |
- Calcul effectué avec le tableur
Excel :
|
|
||||||||
|
|
Pouvoir tampon : |
|
|
|
|
unité de β
: mmol , mL-1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
Valeur du pH initial de la solution tampon |
5,0 |
|
|
||||
|
Solution tampon |
S1 |
S2 |
||||||
|
Essai N° |
V
(mL) |
n
(mmoL) |
pH |
ΔpH |
β
(mmol.mL-1) |
pH |
ΔpH |
β
(mmol.mL-1) |
|
1 |
500 |
5,0 |
4,8 |
0,2 |
0,050 |
4,6 |
0,4 |
0,025 |
|
2 |
100 |
5,0 |
4,0 |
1,0 |
0,050 |
3,0 |
2,0 |
0,025 |
|
3 |
100 |
2,0 |
4,6 |
0,4 |
0,050 |
4,2 |
0,8 |
0,025 |
-
En conclusion :
-
Comme le pouvoir tampon de la solution
S1 est supérieur à celui
de la solution S2, on en
déduit que la solution tampon S1
est plus efficace.