|
|
Force des acides
et des bases |
|
|
|
|
|
Préparation à l’ECE : Étude d’un comprimé d’aspirine 1)- Exercice 03
page 164 :Associer une constante d’équilibre à une équation de réaction. 2)- Exercice 05
page 164 : Déterminer la composition finale d’une solution. 3)- Exercice 07
page 164 : Justifier le caractère fort d’un acide. 4)- Exercice 09
page 165 : Écrire une constante d’acidité. 5)- Exercice 10
page 165 : Calculer une constante d’acidité. 6)- Exercice 12
page 165 : Comparer la force de trois bases dans l’eau. 7)- Exercice 13
page 165 : Tracer un diagramme de prédominance. 8)- Exercice 14
page 165 ; Exploiter un diagramme de distribution. 9)- Exercice 15
page 165 : Justifier le choix d’un indicateur coloré. 10)- Exercice 17
page 166 : Reconnaître un effet tampon. 11)- Exercice 20
page 166 : Les couleurs des hortensias. 12)- Exercice
23 page 167 : Indicateur coloré adapté à un titrage. 13)- Exercice 22
page 167 : Résoudre une équation du second degré. 14)- DS 01 : Une
astuce culinaire (60 min) : Exercice 31 page 170. |
|
QCM r
Force des acides et des
bases. La réaction d’un acide
ou d’une base avec l’eau.
|
1)- Acide et base selon
Bronsted.
-
Un
acide
est une espèce chimique capable de
céder
au moins un
ion hydrogène
H+.
-
L’acide
AH
se transforme alors en sa base conjuguée
A–.
-
Écriture formelle :
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Une
base
est une espèce chimique capable de
capter
au moins un
hydrogène
H+.
-
La
base
A–
se transforme alors en son acide conjugué
AH.
-
Écriture formelle :
|
A–
(aq) |
+ |
H+ |
→ |
AH
(aq) |
|
Base |
|
ion hydrogène |
|
Acide |
-
Exemples :
-
L’acide éthanoïque :
|
CH3COOH
(aq) |
→ |
CH3COO–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
En cédant un
ion hydrogène
H+,
l’acide éthanoïque CH3COOH
(aq)
se transforme en ion éthanoate CH3COO–
(aq).
-
L’ion éthanoate :
|
CH3COO–
(aq) |
+
|
H+ |
→ |
CH3COOH
(aq) |
|
Base |
|
ion hydrogène |
|
Acide |
-
En captant un
ion hydrogène
H+,
l’ion éthanoate CH3COO–
(aq) se transforme
acide éthanoïque CH3COOH
(aq).
-
L’acide éthanoïque CH3COOH
(aq)
et
l’ion éthanoate CH3COO–
(aq) sont des espèces conjuguées.
►
La
notation AH
/ A–
-
L’acide
AH
et sa base conjuguée
A–
forment un couple
acide-base
noté
AH
/
A–.
-
Il est possible de
passer d’un à l’autre par transfert d’un ion hydrogène
H+.
-
Écriture de la
demi-équation du couple acide-base :
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Signification :
-
Le signe
![]() signifie
que le transfert d’ion hydrogène
H+
peut se produire dans les deux sens.
signifie
que le transfert d’ion hydrogène
H+
peut se produire dans les deux sens.
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou bien |
||||
|
A–
(aq) + H+
|
→ |
AH
(aq) |
|
|
►
Quelques couples.
-
Tableau de quelques
couples
acide-base
conjuguée
|
Acide |
Base conjuguée |
|
HCOOH
Acide formique
Acide méthanoïque |
HCOO–
Ion formiate
Ion méthanoate |
|
CH3COOH
Acide acétique
Acide éthanoïque |
CH3COO–
Ion acétate
Ion éthanoate |
|
C6H5COOH
Acide benzoïque
|
C6H5COO–
Ion benzoate
|
|
(CO2,
H2O)
Dioxyde de carbone
dissous dans l’eau |
HCO3–
Ion hydrogénocarbonate |
|
NH4+
Ion ammonium |
NH3
Ammoniac |
|
H3O+
Ion oxonium |
H2O
Eau |
|
H2O
Eau |
HO–
Ion
hydroxyde |
-
L’eau appartient à
deux couples acido-basiques.
-
L’ion
H3O+
est l’acide du couple
H3O+
(aq) / H2O
(ℓ)
-
L’ion
HO–
(aq) est la base du couple
H2O
(ℓ) / HO–
(aq).
-
L’eau est la
base du couple
H3O+
(aq) / H2O
(ℓ) et l’acide du couple
H2O (ℓ) /
HO–
(aq).
-
On dit que l’eau est
un ampholyte
ou une espèce amphotère.
-
Espèce amphotère :
-
Une espèce amphotère
est à la fois l’acide
d’un couple et la
base
d’un autre couple.
-
Exemple :
|
Acide |
Base |
|
H2O
(ℓ) |
/
HO– (aq) |
|
H3O+
(aq) |
/
H2O
(ℓ) |
-
Une réaction
acido-basique consiste à un transfert d'un proton
H+
entre l’acide
A1H d’un
couple sur la base
A2–
d’un autre couple.
-
Couple acide / base 1
:
A1H ![]() H+
+ A1–
H+
+ A1–
-
Couple acide / base 2
:
A2H ![]() H+
+
A2–
H+
+
A2–
-
Équation de la
réaction :
-
On se place dans le
cas où l’acide
A1H réagit sur la base
A2–
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
ou
A1H
+
A2–
→
A1–
+
A2H
-
L’équation s’écrit
avec
-
une double flèche
![]() si
la réaction est non totale : on est en présence d'un équilibre chimique
si
la réaction est non totale : on est en présence d'un équilibre chimique
-
une simple flèche
→ si la
réaction est totale.
-
cette
réaction met en jeu les couples acide / base suivants :
A1H
/
A1–
et A2H /
A2–.
II-
La réaction d’un acide
et d’une base sur l’eau.
1)- Produit ionique de
l’eau,
Ke.
a)-
Application : Autoprotolyse
de l’eau :
-
À
-
Comment peut-on
expliquer la présence des ions oxonium dans l’eau pure ?
-
Déterminer la valeur
de la concentration des ions oxonium dans l’eau pure à 25 ° C.
-
dresser
le tableau d’avancement de la réaction.
-
Déterminer la valeur
du taux d’avancement final de la réaction.
-
Calculer les quantités
de matière et les concentrations des différentes espèces chimiques à l’équilibre
chimique. Conclusion.
-
Donner l’expression du
quotient de la réaction.
-
En déduire la valeur
de la constante d’équilibre Ke
de cette réaction.
![]() Réponses :
Réponses :
-
L’eau pure contient
des ions oxonium H3O+
(aq).
-
L’eau pure est
partiellement ionisée.
-
Il se produit une
réaction acido-basique entre deux molécules d’eau.
-
Il y a un échange de
protons
H+
entre deux molécules d’eau.
H2O
(ℓ)
+ H2O
(ℓ) ![]() H3O+
(aq) +
HO–
(aq)
(1)
H3O+
(aq) +
HO–
(aq)
(1)
-
La
réaction (1) est appelée
autoprotolyse de l’eau.
-
Concentration des ions
oxonium :
-
Elle peut se déduire
de la définition du pH
d’une solution aqueuse diluée :
-
Le
pH
d’une solution est un indicateur d’acidité lié à la présence des ions oxonium
H3O+
(aq) en solution.
|
Pour
une solution diluée, [H3O+]
< 0,050 mol . L–1, Le pH
est défini par la relation suivante :
Cette relation
est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] : concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
La concentration des
ions oxonium peut se déduire de la définition du pH d’une solution aqueuse
diluée :
-
[H3O+
]éq
= C0
. 10–pH
-
[H3O+
]éq
= 1,0 × 10–
7,0
-
[H3O+
]éq
≈ 1,0 × 10–7
mol
. L–1
-
Tableau d’avancement
de la réaction :
|
Équation |
2 H2O
(ℓ) |
|
H3O+
(aq) |
+
HO–
(aq) |
|
|
état |
Avancement
x
(mol) |
(mol) |
|
(mol) |
(mol) |
|
État initial
(mol) |
0 |
ni
= 55,6 |
0 |
0 |
|
|
Au cours de la
transformation |
x |
ni –
2 x |
x |
x |
|
|
Avancement
final |
xf |
ni –
2 xf |
xf |
xf |
|
|
Avancement
maximal |
xmax |
ni –
2 xmax
= 0 |
xmax |
xmax |
|
-
Taux d’avancement
final de la réaction :
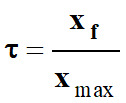
-
Il faut
déterminer les valeurs de l’avancement final
xf
et de l’avancement maximal
xmax.
-
Valeur de l’avancement
final :
-
xf
=
[H3O+
]éq .
V
-
xf
≈
1,0 × 10–7
×
1,00
-
xf
≈
1,0 × 10–7
mol
-
Valeur
de l’avancement maximal :
xmax
-
Masse molaire d’une
molécule d’eau : M
(H2O)
= 18,0 g . mol–1
-
La masse de
V = 1,00 L d’eau
est m = 1,00
kg.
-
Quantité de matière
initiale d’eau ni :
- 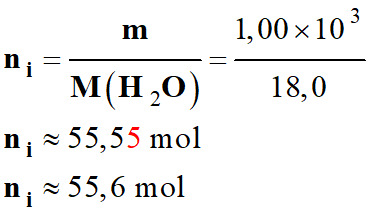
-
ni
– 2 xmax
=
0
=>
xmax
≈
27,8 mol
-
Valeur
du taux d’avancement final de la
réaction :
-
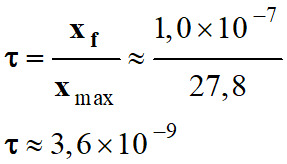
-
Quantités de matière
des différentes espèces chimiques à l’équilibre chimique (état final) :
|
Équation |
2 H2O
(ℓ) |
|
H3O+
(aq) |
+
HO– (aq) |
|
|
état |
Avancement
x
(mol) |
(mol) |
|
(mol) |
(mol) |
|
État initial
(mol) |
0 |
ni
= 55,6 |
0 |
0 |
|
|
Au cours de la
transformation |
x |
ni –
2 x |
x |
x |
|
|
Avancement
final |
xf |
néq ≈
55,6 |
1,0 × 10–7 |
1,0 × 10–7 |
|
-
Conclusions :
-
La réaction
d’autoprotolyse de l’eau est une réaction très limitée.
-
La réaction inverse de
l’autoprotolyse de l’eau est quasi totale.
-
Seulement 2 molécules
d'eau sur 556 millions participent à la formation des ions.
-
Expression du quotient
de la réaction d’autoprotolyse de l’eau :
-
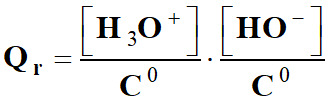
-
Expression
simplifiée :
-
Qr =
[ H3O+
]
. [HO
–]
-
Valeur
de la constante d’équilibre
Ke de
cette réaction :
-
Lorsque l’équilibre
chimique est atteint :
-
Qr,éq =
[ H3O+
]éq
. [HO
–]éq
=
K
-
Valeur
numérique de Ke :
à
-
Qr,éq =
[ H3O+
]éq
. [HO
–]éq
=
Ke
≈ 1,0 × 10–14
b)-
Produit ionique de l’eau :
-
Considérons la
réaction suivante :
|
Sens direct :
Autoprotolyse de l’eau |
||
|
H2O
(ℓ) +
H2O (ℓ) |
|
H3O+ (aq) +
HO–
(aq) |
|
Sens inverse |
||
-
La constante
d’équilibre associée à cette équation est nommée produit ionique de l’eau :
-
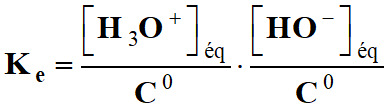
-
Cette relation est
valable dans toutes les solutions aqueuses.
-
L’autoprotolyse de
l’eau a lieu dans toute les solutions aqueuses.
-
La valeur du produit
ionique de l’eau Ke
dépend de la température.
-
Elle croît avec la
température.
►
Remarque :
-
Pour
des raisons de commodité, on utilise le
pKe.
-
pKe=
– log Ke.
=>
Ke =
10–pKe
-
Tableau :
|
Température
(en ° C) |
Ke |
pKe |
|
0° |
1,1
× 10–15 |
14,96 |
|
25° |
1,0
× 10–14 |
14,00 |
|
40° |
3,0
× 10–14 |
13,53 |
|
60° |
9,5
× 10–14 |
13,02 |
|
80° |
2,5
× 10–13 |
12,60 |
|
100° |
5,5
× 10–13 |
12,26 |
c)-
Les
solutions aqueuses et le produit ionique de l’eau.
-
Dans toutes les
solutions aqueuses,
-
Ke
= [H3O+
]éq
. [HO–]éq
-
En utilisant le
pK
e, on
peut écrire :
-
pKe
= – log
[H3O+]éq
– log [HO
–]éq
-
pKe
= pH
– log [HO–]éq
-
pH
= pKe
+ log
[HO–]éq
-
Ne pas oublier que
l’on omet de l’expression la grandeur C0.
-
[HO
–]éq
=
C0
. 10
pH –
pKe
-
Ke
est indépendant de la présence et de la nature des
substances dissoutes.
-
Ke
ne dépend que de la température de la solution.
-
Pour
une solution aqueuse à
-
Ke = [H3O+]éq
. [HO–]éq
≈ 1,0 × 10
– 14
►
Application :
-
Le
pH d'une solution
S
à
-
Une
solution aqueuse S1
porte l’indication :
[H3O+]éq
= 6,5
× 10–5
mol
. L–1
-
Une
solution aqueuse S2
porte l’indication :
[HO
–]éq
= 5,5
× 10–10
mol
. L–1
- Que peut-on déduire de ces différentes valeurs ?
![]() Étude de la solution S.
Étude de la solution S.
-
pH
= 2,0
-
Par définition :
-
[H3O+
]éq
= C0
. 10–pH
-
[H3O+
]éq
= 1,0 × 10
– 2
-
[H3O+
]éq
≈ 1,0 × 10
– 2 mol
. L–1
-
D'autre part :
-
Ke = [H3O+]éq
. [HO
–]éq
= 1,0 × 10–14
-
[HO
–]éq
=
C0
. 10
pH
– pKe
-
[HO
–]éq
≈
1,0 × 10–12 mol
. L–1
![]() Étude de la solution S1.
Étude de la solution S1.
-
On peut
calculer la valeur du
pH de la solution et la valeur de la
concentration en ions hydroxyde.
-
Valeur
du pH
de la solution S1.
-
pH
= – log [H3O+]éq
-
pH ≈
– log (6,5 × 10–5)
-
pH ≈
4,2
-
Concentration en ions
hydroxyde.
-
[HO
–]éq
=
C0
. 10
pH –
pKe
-
[HO
–]éq
=
1,0 ×10
4,2– 14
-
[HO
–]éq
≈
1,6 × 10–10
mol
. L–1
![]() Étude de
la
solution S2.
Étude de
la
solution S2.
-
On peut
calculer la valeur de la concentration en ions oxonium puis la valeur du
pH
de la solution.
-
Concentration en ions
oxonium.
-
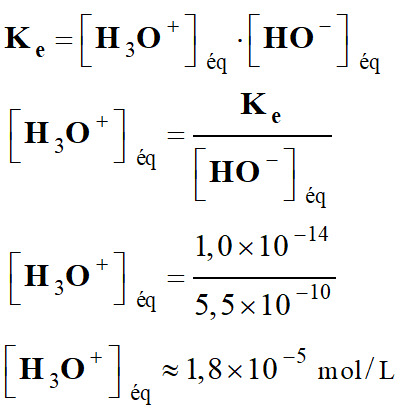
-
Valeur
du pH
de la solution S3.
-
On peut utiliser
l’expression suivante :
-
pH
= pKe
+ log [HO
–]éq
-
pH
=
14 + log (5,5 × 10–10 )
-
pH
≈
4,7
-
Deuxième méthode :
-
pH
= – log [H3O+]éq
-
pH ≈
– log (1,8 × 10–5)
-
pH ≈
4,7
d)-
Solutions neutre, acide,
basique.
►
Solution neutre :
-
Une
solution neutre contient autant d'ions oxonium
H3O+ que d'ions
hydroxyde HO
–.
-
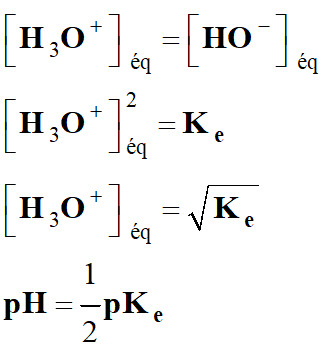
►
Solution acide :
-
Une
solution acide contient plus d'ions oxonium
H3O+
que d'ions hydroxyde
HO
–.
-
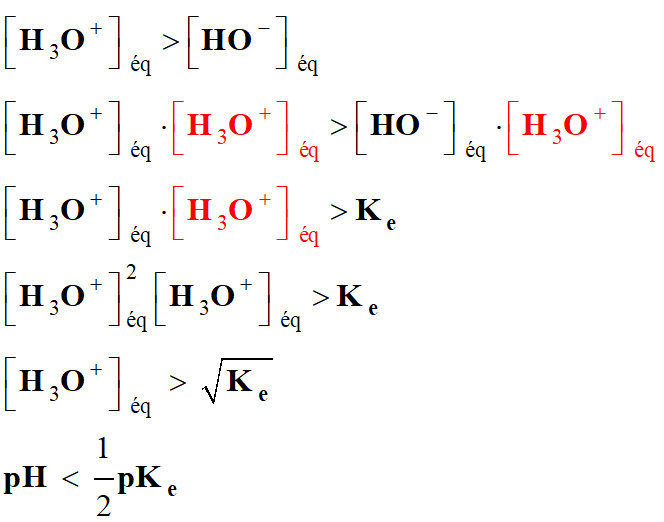
►
Solution basique :
-
Une
solution basique contient moins d'ions oxonium
H3O+ que d'ions
hydroxyde HO
–.
-
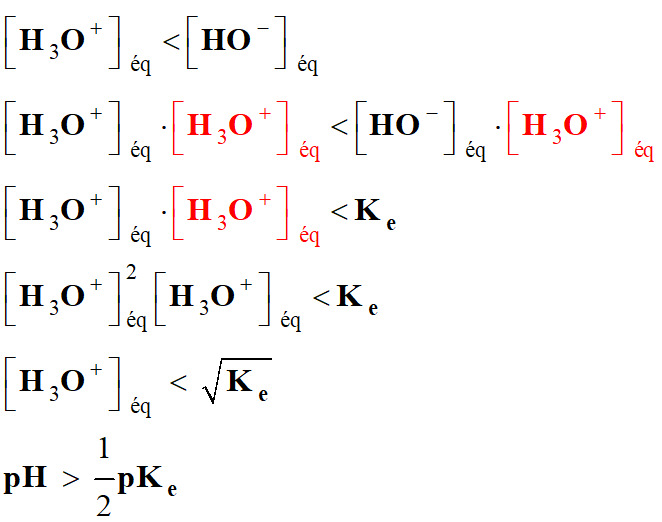
-
Diagramme de
prédominance :
-
À 25° C,
pKe
=
14
-
pH
< 7
pour les solutions acides.
-
pH
= 7 pour les solutions neutres.
-
pH
> 7
pour les solutions basiques.
-
La transformation
modélisée par la réaction entre l’acide AH
(aq) et l’eau H2O
(ℓ) n’est pas totale :
-
En conséquence :
-
Le taux d’avancement
de la réaction : τ
< 1
-
L’écriture de la
réaction est la suivante :
|
AH
(aq)
+ H2O (ℓ) |
|
H3O+ (aq)
+ A–
(aq) |
-
La concentration en
ions oxonium à l’équilibre :
-
[H3O+]éq
= [H3O+]f
< C
-
C
représente la concentration
en acide apporté.
-
La transformation
modélisée par la réaction entre la base A–
(aq) et l’eau H2O
(ℓ) n’est pas totale :
-
En conséquence :
-
Le taux d’avancement
de la réaction : τ
< 1
-
L’écriture de la
réaction est la suivante :
|
A–
(aq) +
H2O (ℓ) |
|
HO–
(aq) +
AH
(aq) |
-
La concentration en
ions hydroxyde à l’équilibre :
-
[HO–]éq
= [HO–]f
< C
-
C
représente la concentration
en base apportée.
►
Un acide faible :
l’acide éthanoïque.
|
Une solution aqueuse d’acide éthanoïque CH3COOH (aq), de volume V = 100,0 mL
et de concentration C
= 1,0 × 10–2 mol . L–1
en soluté apporté, a un pH
égal à 3,4.
-
Établir le tableau
d’avancement de la réaction entre l’acide éthanoïque et l’eau.
-
Calculer la valeur du
taux d’avancement τ
de la réaction entre l’acide éthanoïque et l’eau.
-
Déterminer le bilan
des quantités de matière du système chimique à l’équilibre.
-
Conclure.
|
![]() Étude de la solution aqueuse d’acide éthanoïque.
Étude de la solution aqueuse d’acide éthanoïque.
-
Tableau d’avancement
de la réaction entre l’acide éthanoïque et l’eau :
|
Équation |
CH3COOH
(aq)
|
+ H2O (ℓ) |
|
CH3COO–
(aq)
|
+
H3O+ (aq) |
|
|
état |
Avancement
x
(mol) |
n (CH3COOH)
|
|
|
n
(CH3COO–) |
n
(H3O+) |
|
État initial
(mol) |
0 |
n = C . V |
solvant |
0 |
0 |
|
|
Au cours de la
transformation |
x |
n
– x |
solvant |
x |
x |
|
|
Avancement
final |
xf |
n
– xf |
solvant |
xf |
xf |
|
|
Avancement
maximal |
xmax
|
n
– xmax |
solvant |
xmax |
xmax |
|
-
Quantité de matière
n en acide
éthanoïque apporté :
-
n
= C .
V
-
n
= 1,0 × 10–2 × 100,0 × 10–3
-
n
≈ 1,0 × 10–3 mol
-
Valeur
de l’avancement maximal
xmax
de la réaction :
-
L’avancement maximal
xmax serait atteint
si l’acide éthanoïque était totalement consommé.
-
Dans ce cas :
-
n
– xmax
= 0
-
xmax
≈ 1,0
× 10–3
mol
-
Valeur de l’avancement
final xf
de la réaction :
-
On
calcule la valeur de
xf à
partir de la valeur du
pH de la solution :
-
D’après de tableau
d’avancement de la réaction, on peut écrire que :
-
xf
= nf
(H3O+)
-
D’autre
part : pH
= 3,4 qui
est équivalent à [H3O+]f
= C0
× 10–
pH mol
. L–1
-
Avec C0 :
Concentration standard :
C0 =
1,0 mol .
L–1
-
xf
= nf
(H3O+)
= [H3O+]f
. V1
-
xf
≈ 1,0 ×
10–
3,4 ×
100,0 × 10–3
-
xf
≈ 3,98
× 10–5 mol
-
xf
≈ 4,0 × 10–5 mol
-
On
constate que : xf
<
xmax
-
La réaction entre
l’acide éthanoïque et l’eau est instantanée, mais n’est pas totale.
-
Le réactif limitant
n’ayant pas totalement réagi, les réactifs et les produits coexistent dans le
mélange réactionnel à l’état final.
-
On peut compléter le
tableau d’avancement de la réaction :
|
Équation
|
CH3COOH
(aq)
|
+ H2O
(ℓ) |
|
CH3COO–
(aq)
|
+ H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(CH3COOH) |
|
|
n
(CH3COO–) |
n (H3O+)
|
|
État initial
(mol) |
0 |
n = C . V
n
≈ 1,0 × 10–3 mol |
solvant |
0 |
0 |
|
|
Au cours de la
transformation
|
x |
n
– x |
solvant |
x |
x |
|
|
Avancement
final |
xf
|
9,6 × 10–4 |
solvant |
4,0 × 10–5 |
4,0 × 10–5 |
|
|
Avancement
maximal
|
xmax
|
0 |
solvant |
1,0
× 10–3 |
1,0
× 10–3 |
|
-
Valeur
du taux d’avancement
τ de la réaction entre l’acide
éthanoïque et l’eau :
-
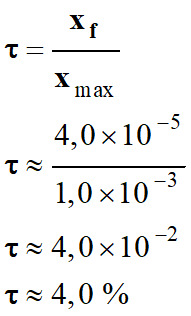
-
La transformation
n’est pas totale : τ
< 1
-
Les réactifs et les
produits coexistent dans l’état final d’équilibre.
►
Exemple : une base
faible : l’ammoniac.
|
Une solution aqueuse d’ammoniac NH3 (aq), à 25 ° C, de volume V = 100,0 mL
et de concentration C = 1,0
× 10–2 mol . L–1
,en soluté apporté, a un pH
égal à 10,6.
-
Établir le tableau
d’avancement de la réaction entre l’acide ammoniac et l’eau.
-
Calculer la valeur du
taux d’avancement de la réaction entre l’ammoniac et l’eau.
-
Déterminer le bilan de
quantité de matière du système chimique à l’équilibre.
-
Conclure.
|
![]() Étude de la solution aqueuse d’ammoniac.
Étude de la solution aqueuse d’ammoniac.
-
Tableau d’avancement
de la réaction entre l’ammoniac et l’eau :
|
Équation
|
NH3
(aq)
|
+ H2O
(ℓ) |
|
NH4+
(aq)
|
+ HO– (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(NH3) |
|
|
n
(NH4+) |
n (HO–)
|
|
État initial
(mol) |
0 |
n = C . V |
solvant |
0 |
0 |
|
|
Au cours de la
transformation
|
x |
n
– x |
solvant |
x |
x |
|
|
Avancement
final |
xf
|
n
– xf |
solvant |
xf |
xf |
|
|
Avancement
maximal
|
xmax
|
n
– xmax |
solvant |
xmax |
xmax |
|
-
Quantité de matière
n en
ammoniac apportée :
-
n
= C .
V
-
n
= 1,0 × 10–2 × 100,0 × 10–3
-
n
≈ 1,0 × 10–3 mol
-
Valeur
de l’avancement maximal
xmax
de la réaction :
-
L’avancement maximal
xmax serait atteint
si l’ammoniac était totalement consommée.
-
Dans ce cas :
-
n
– xmax
= 0
-
xmax
≈ 1,0
× 10–3
mol
-
Valeur de l’avancement
final xf
de la réaction :
-
On
calcule la valeur de
xf à
partir de la valeur du
pH de la solution :
-
D’après de tableau
d’avancement de la réaction, on peut écrire que :
-
xf
= nf
(HO–)
-
On donne le
pH de la solution
aqueuse d’ammoniac à 25 °C : pH
= 10,6
-
Dans toutes les
solutions aqueuses,
-
Ke
= [H3O+
]éq
. [HO–]éq
-
En
utilisant le pKe,
on peut écrire :
-
pKe
= – log
[H3O+]éq
– log [HO
–]éq
-
pKe
= pH
– log [HO–]éq
-
pH
= pKe
+ log
[HO–]éq
-
[HO
–]éq
=
[HO
–]f =
C0
. 10
pH
– pKe
-
[HO
–]f
=
1,0 × 1010,6 – 14
-
[HO
–]f
≈
3,98
× 10–4
mol . L–1
-
[HO
–]f
≈
4,0 × 10–4
mol . L–1
-
Quantité de matière
d’ions hydroxyde présent dans la solution à l’état final d’équilibre.
-
n
f (HO
–
) = [HO –]f
.
V
-
n
f (HO
–
) ≈ 4,0 × 10–4
×100,0 × 10–4
-
n
f (HO
–
) ≈ 4,0 × 10–5
mol
-
xf
= nf
(HO–)
≈ 4,0 × 10–5
mol
-
On
constate que xf
<
xmax
-
La réaction entre
l’ammoniac et l’eau est instantanée, mais n’est pas totale.
-
Le réactif limitant
n’ayant pas totalement réagi, les réactifs et les produits coexistent dans le
mélange réactionnel à l’état final.
-
On peut compléter le
tableau d’avancement de la réaction :
|
Équation
|
NH3
(aq)
|
+ H2O
(ℓ) |
|
NH4+
(aq)
|
+ HO– (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(NH3) |
|
|
n
(NH4+) |
n (HO–)
|
|
État initial
(mol) |
0 |
n = C . V
n
≈ 1,0 × 10–3 mol |
solvant |
0 |
0 |
|
|
Au cours de la
transformation
|
x
|
n
– x |
solvant |
x |
x |
|
|
Avancement
final |
xf
|
9,6 × 10–4 |
solvant |
4,0 × 10–5 |
4,0 × 10–5 |
|
|
Avancement
maximal
|
xmax
|
0 |
solvant |
xmax |
xmax |
|
- Valeur du taux d’avancement τ de la réaction entre l’ammoniac et l’eau :
-
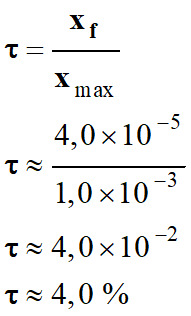
-
La transformation
n’est pas totale : τ
< 1
-
Les réactifs et les
produits coexistent dans l’état final d’équilibre.
-
La transformation
modélisée par la réaction entre l’acide AH
(aq) et l’eau H2O
(ℓ) est totale :
-
En conséquence :
-
Le taux d’avancement
de la réaction : τ
= 1
-
L’écriture de la
réaction est la suivante :
|
AH
(aq)
+ H2O (ℓ) |
→ |
H3O+ (aq)
+ A–
(aq) |
-
La concentration en
ions oxonium :
-
[H3O+]f
= [H3O+]max
= C
-
C
représente la concentration
en acide apporté.
-
pH
de la solution obtenue :
-
pH =
– log [H3O+]f
-
Le
pH
d’une solution diluée d’acide fort, de concentration
C
en soluté apporté, est :
|
pH = –
log C |
Valable pour
10–2 mol . L–1 ≤ C ≤ 10–6
mol . L–1 |
-
La transformation
modélisée par la réaction entre la base A–
(aq) et l’eau H2O
(ℓ) est totale :
-
En conséquence :
-
Le taux d’avancement
de la réaction : τ
= 1
-
L’écriture de la
réaction est la suivante :
|
A–
(aq) + H2O
(ℓ) |
→ |
HO–
(aq) + AH (aq) |
-
La concentration en
ions hydroxyde :
-
[HO–]f
= [HO–]max
= C (C
représente la concentration
en base apportée )
-
Le
pH
d’une solution diluée de base forte, de concentration
C
en soluté apporté, est :
|
pH = 14 +
log C |
Valable pour
10–2 mol . L–1 ≤ C ≤ 10–6
mol . L–1 |
►
Le chlorure
d’hydrogène est un acide fort dans l’eau.
|
HCℓ
(g) + H2O (ℓ) |
→ |
Cℓ–
(aq) + H3O+ (aq) |
-
Tableau :
|
Concentration |
C mol / L |
10–1 |
10–2 |
10–3 |
10–4 |
10–5 |
10–6 |
10–7 |
10–8 |
|
Acide
chlorhydrique |
pH |
1,1 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
6,79 |
6,98 |
|
|
- log C |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
-
Formule de l’acide
chlorhydrique : {H3O+
(aq) + Cℓ–
(aq)} (solution aqueuse de chlorure d’hydrogène)
![]() Application :
Application :
-
On
dissout n
= 1,0 × 10–2 mol
de chlorure d’hydrogène
HCℓ (g) dans un 1,0 L d’eau.
-
Quel
est le pH
de la solution obtenue ?
-
Le chlorure
d’hydrogène est une acide fort.
-
La
concentration en soluté apporté :
C = 1,0 × 10–2 mol
. L–1.
-
pH
= – log C
-
pH
≈ – log 1,0 × 10–2
-
pH
≈ 2,0.
►
Exemples de bases
fortes :
-
La solution aqueuse
d’hydroxyde de sodium ou soude, la solution aqueuse d’hydroxyde de potassium,
l’ion éthanolate en solution aqueuse.
-
Donner les équations
bilans des réactions de ces bases avec l’eau.
-
Solution aqueuse
d’hydroxyde de sodium :
NaOH (s) +
H2O
(ℓ)
→ (Na+,
H2O)
(aq)
+ OH– (aq)
-
Cela revient à la
dissolution d’un composé ionique dans l’eau que l’on peut écrire plus
simplement :
|
|
Eau |
|
|
|
|
NaOH
(s) |
→ |
Na+
(aq) |
+ |
HO
–
(aq) |
-
formule
de la soude : {Na+ (aq)
+ HO– (aq)}
(solution aqueuse d’hydroxyde de sodium)
-
Solution aqueuse
d’hydroxyde de potassium :
|
|
Eau |
|
|
|
|
KOH
(s) |
→ |
K+
(aq) |
+ |
HO
–
(aq) |
-
L’ion éthanolate en
solution aqueuse :
|
CH3CH2O– (aq)
+ H2O (ℓ) |
→ |
CH3CH2OH
(aq) + OH– (aq) |
III-
La constante d’acidité d’un couple acide-base.
1)- Constante d’acidité
KA
et
pKA.
-
La constante d’acidité
du couple acide / base AH
(aq) / A–
(aq) est la constante d’équilibre associée à l’équation :
|
AH
(aq)
+ H2O (ℓ) |
|
H3O+
(aq) +
A–
(aq) |
|
|
|
|
KA |
Constante
d’acidité (sans unité) |
|
[AH]éq |
Concentration
de l’acide à l’équilibre (mol . L–1) |
|
[A–]éq
|
Concentration
de la base conjuguée (mol . L–1) |
|
[H3O+]éq |
Concentration
en ions oxonium (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
-
On peut simplifier
l’écriture cette expression :
-
On omet
de mettre la concentration standard
C0.
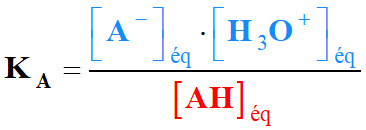
-
Mais, il ne faut pas
oublier que la constante d’acidité
est une grandeur
sans unité.
-
On définit aussi :
-
pKA
= – log KA
soit : KA
= 10–pKA
b)- Exemple : cas de l'acide éthanoïque.
►
Constante d’acidité de
l’acide éthanoïque étudié précédemment :
|
Équation |
CH3COOH
(aq)
|
+ H2O
(ℓ) |
|
CH3COO–
(aq)
|
+ H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(CH3COOH) |
|
|
n
(CH3COO–) |
n (H3O+)
|
|
État initial
(mol) |
0 |
n = C . V
n
≈ 1,0 × 10–3 mol |
solvant |
0 |
0 |
|
|
Au cours de la
transformation
|
x |
n
– x |
solvant |
x |
x |
|
|
Avancement
final |
xf
|
9,6 × 10–4 |
solvant |
4,0 × 10–5 |
4,0 × 10–5 |
|
|
Avancement
maximal
|
xmax
|
0 |
solvant |
1,0
× 10–3 |
1,0
× 10–3 |
|
-
Comme on connaît le
volume de la solution, V
= 100,0 mL, on peut en déduire la concentration des différentes espèces
chimiques présentes à l’équilibre chimique :
-
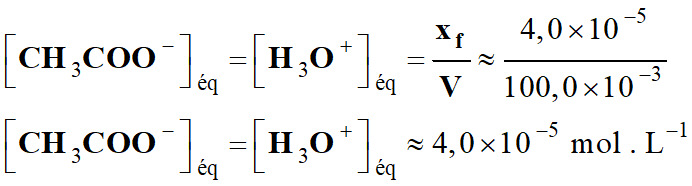
-
Concentration en acide
éthanoïque à l’équilibre chimique :
- 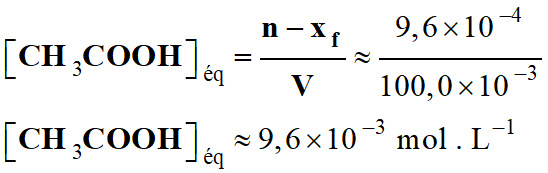
-
Expression simplifiée
de la constante d’acidité :
-
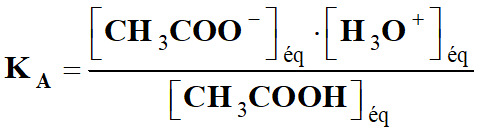
-
Application
numérique :
- 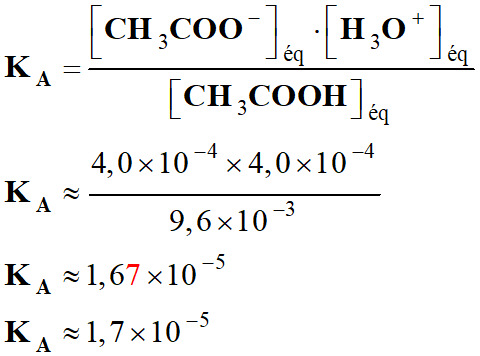
-
Valeur du
pKA :
-
pKA
= – log KA
-
pKA
≈ – log (1,7 × 10–5)
-
pKA
≈ 4,8
2)- Forces comparées des
acides et des bases dans l’eau.
-
Dans une solution
d'acide fort ou de base forte, le seul équilibre qui intervient et celui entre
les ions : H3O+
et OH–.
H3O+
+ OH–
![]() 2 H2O
pKe = 14 à
25 ° C.
2 H2O
pKe = 14 à
25 ° C.
-
On dit que l'eau a un
effet nivelant.
-
Dans l'eau, il
n'existe pas d'acide plus fort que H3O+
et de base plus forte que OH–.
-
Les
pKA
des couples acide / base sont compris entre ceux des couples de l’eau.
-
Quel est le
pKA
du couple H3O+/
H2O
?
-
H3O+
+
H2O
![]() H3O+
+
H2O
(1)
=>
pKA1
= 0
H3O+
+
H2O
(1)
=>
pKA1
= 0
-
Quel est le
pKA
du couple H2O
/ OH –?
-
H2O
+
H2O ![]() H3O+
+
OH–
(2)
=>
KA2
= Ke
= [H3O+]
. [OH–]
H3O+
+
OH–
(2)
=>
KA2
= Ke
= [H3O+]
. [OH–]
-
pKA2
= pKe
= 14
-
Les valeurs des
pKA
des couples acide / base sont compris entre 0 et 14.
b)-
Forces comparées des acides et
des bases :
-
Un acide
AH (aq) est
d’autant plus fort
dans l’eau que le pKA
du couple auquel il appartient est
petit (ou son
KA
grand)
-
Une base
A–
(aq) est d’autant plus forte
dans l’eau que le pKA
du couple auquel elle appartient est
grand (ou son
KA
petit).
-
Soit la réaction suivante :
|
AH
(aq)
|
+ H2O
(ℓ) |
|
A–
(aq) |
+ H3O+
(aq) |
-
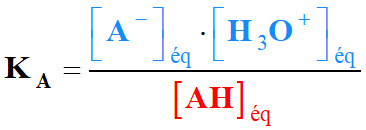
-
Concentration en acide apporté AH (aq) : [AH]app
= C
-
Volume de la solution : V
-
Expression de KA en fonction de τ et C.
-
Tableau d’avancement de la réaction :
|
Équation |
AH
(aq) |
+ H2O (ℓ) |
|
A–
(aq) |
+
H3O+ (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(AH) |
|
|
n
(A–) |
n
(H3O+) |
|
État initial
(mol) |
0
|
n
= C . V |
solvant |
0
|
0 |
|
|
Au cours de la
transformation |
x |
n
–
x |
solvant |
x |
x |
|
|
Avancement
final |
xf |
n
–
xf |
solvant |
xf |
xf |
|
|
Avancement
maximal |
xmax
|
n
–
xmax |
solvant |
xmax |
xmax |
|
-
Avec : xmax = C . V et xf
= nf (A–) = nf (H3O+)
-
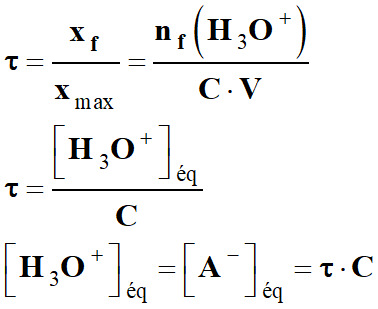
-
Conservation de la matière :
-
[AH]éq + [A–]éq = [AH]app
= C
-
[AH]éq = C – [A–]éq
-
[AH]éq = C – [A–]éq
-
[AH]éq = C – τ . C
-
[AH]éq = C . (1 – τ)
-
Expression de la constante d’acidité en fonction de taux :
-
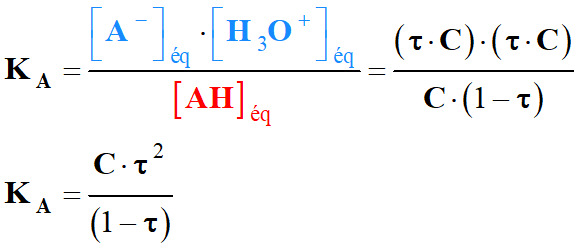
-
Au plus τ → 1, au plus KA ↑ est
grand et l’acide est fort et la base conjuguée est faible.
►
Remarque :
-
En toute rigueur :
-
Il ne faut pas oublier la réaction d’autoprotolyse de l’eau.
-
La solution aqueuse contient des ions hydroxyde HO–
(aq).
-
Électroneutralité de la solution aqueuse :
-
[H3O+]éq =
[A–]éq + [HO–]éq
-
Tant que :
-
10–2 mol . L–1 ≤ C ≤ 10–6
mol . L–1
-
Et en milieu acide :
-
[HO–]éq << [H3O+]éq
-
Alors : [H3O+]éq ≈
[A–]éq
-
En milieu basique, c’est [H3O+]éq
qui est négligeable devant [HO–]éq.
►
Exemple : Cas d’une base faible l’ammoniac
NH3
(aq).
-
Équation de la réaction :
|
NH3
(aq) |
+ H2O (ℓ) |
|
NH4+
(aq) |
+
HO– (aq) |
-
Constante d’équilibre KB de cette réaction :
-
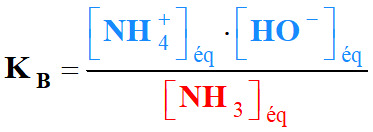
-
Concentration en base apportée NH3 (aq) : [NH3]app
= C
-
Volume de la solution : V
-
Expression de KB en fonction de τ et C.
-
Tableau d’avancement de la réaction :
|
Équation |
NH3
(aq) |
+ H2O (ℓ) |
|
NH4+
(aq) |
+
HO– (aq) |
|
|
état
|
Avancement
x
(mol) |
n
(NH3) |
|
|
n
(NH4+) |
n
(HO–) |
|
État initial
(mol) |
0
|
n
= C . V |
solvant |
0
|
0 |
|
|
Au cours de la
transformation |
x |
n
–
x |
solvant |
x |
x |
|
|
Avancement
final |
xf |
n
–
xf |
solvant |
xf |
xf |
|
|
Avancement
maximal |
xmax
|
n
–
xmax |
solvant |
xmax |
xmax |
|
-
Avec : xmax = C . V et xf
= nf (NH4+) = nf
(HO–)
-
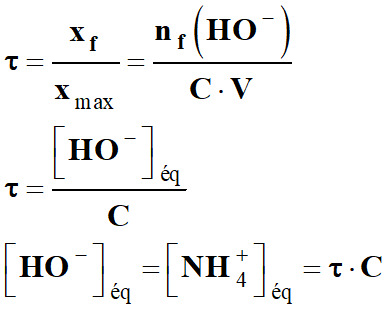
-
Conservation de la matière :
-
[NH3]éq + [NH4+]éq
= [NH3]app = C
-
[NH3]éq = C – [NH4+]éq
-
[NH3]éq = C – [NH4+]éq
-
[NH3]éq = C – τ . C
-
[NH3]éq = C . (1 – τ)
-
Expression de la constante d’équilibre KB en
fonction de taux τ :
-
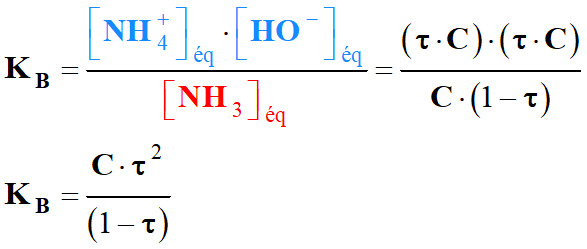
-
Remarque :
-
En toute rigueur :
-
Il ne faut pas oublier la réaction d’autoprotolyse de l’eau.
-
La solution aqueuse contient des ions oxonium H3O+
(aq).
-
Électroneutralité de la solution aqueuse :
-
[NH4+]éq + [H3O+]éq
= [HO–]éq
-
Tant que :
-
10–2 mol . L–1 ≤ C ≤ 10–6
mol . L–1
-
Et en milieu basique,
-
C’est [H3O+]éq qui
est négligeable devant [HO–]éq.
-
[NH4+]éq ≈
[HO–]éq
-
[HO–]éq>> [H3O+]éq
-
Pour aller plus loin :
-
L’ammoniac NH3 est la base conjuguée de l’ion
ammonium NH4+.
-
Couple acide / base : NH4+
(aq) / NH3 (aq) :
-
Réaction associée :
|
NH4+
(aq) |
+ H2O (ℓ) |
|
NH3
(aq) |
+
H3O+ (aq) |
-
Expression de la constante d’acidité :
-
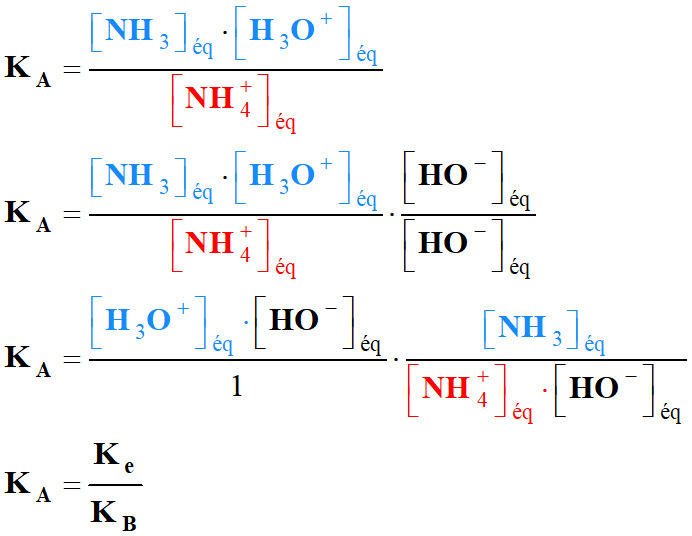
-
Or :
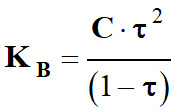
-
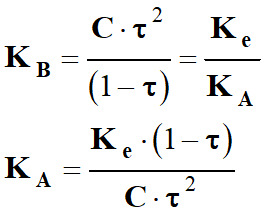
-
Au plus τ → 1, au plus KA ↓ est petit et
l’acide est faible et la base conjuguée est forte.
3)- Espèce prédominante
d’un couple.
-
Étude
du couple AH
(aq) / A–
(aq) :
-
À ce couple est
associée la réaction suivante :
|
AH
(aq) |
+ |
H2O
(ℓ) |
|
A– (aq) |
+ |
H3O+
(aq) |
-
On associe à cette
réaction la constante d’acidité :
-
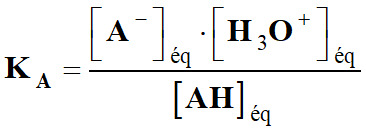
-
En
utilisant pKA
= – log KA
-
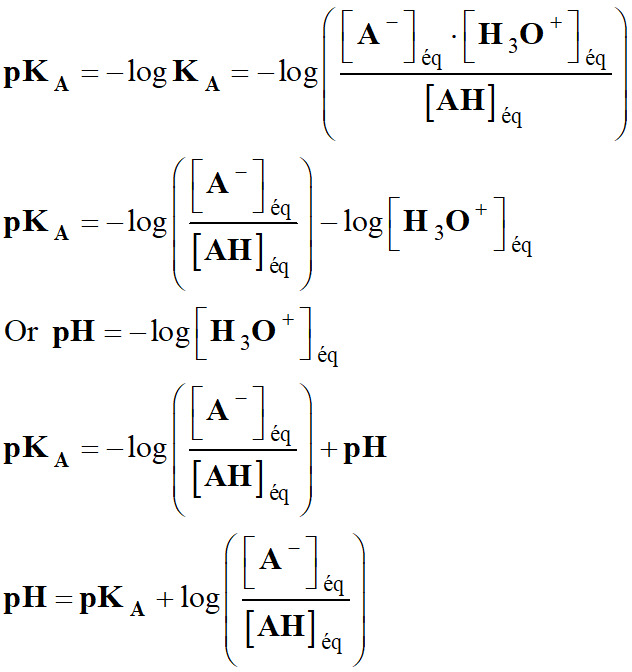
-
La relation :
-
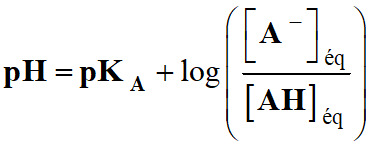
-
Permet de considérer
trois cas :
►
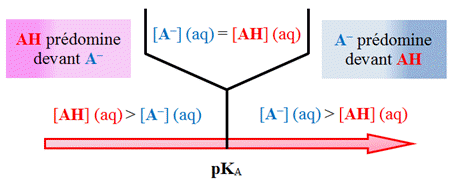
Premier cas :
-
Si
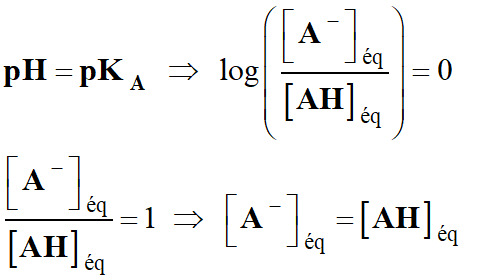
-
L'acide et la base
conjuguée ont la même concentration.
►
Deuxième cas :
-
Si
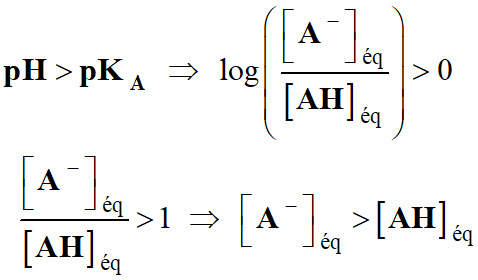
-
La base
A– est l'espèce prédominante
►
Troisième cas :
-
Si
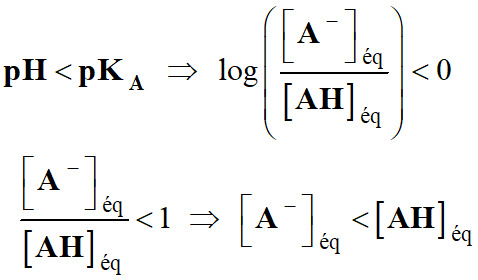
-
L’acide
AH
est l’espèce prédominante.
b)-
Diagramme de distribution et
de prédominance.
►
Diagramme de
distribution :
-
Exemple : couple
CH3COOH
(aq) /
CH3COO
– (aq) de
pKA
= 4,8
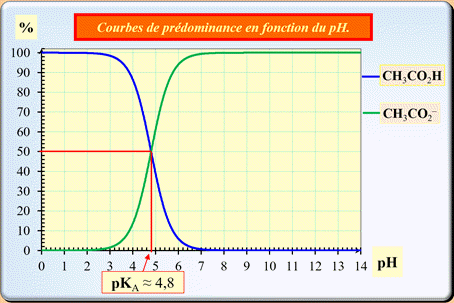
►
Diagramme de
prédominance :
-
représentation
sur un axe horizontal : couple
AH
/
A
–.
c)-
Indicateur coloré
acido-basique.
-
Les indicateurs
colorés sont constitués par des couples acide faible / base faible dont les
espèces conjuguées ont des teintes différentes.
-
Écriture symbolique :
|
Hind (aq) |
+ |
H2O
(ℓ) |
|
Ind–
(aq) |
+ |
H3O+
(aq) |
|
Teinte (1) |
|
|
|
Teinte (2) |
|
|
-
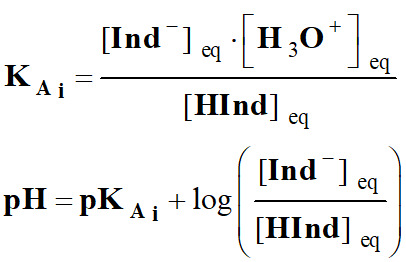
-
On admet, de façon
générale, que l'indicateur coloré prend sa
teinte acide si :
-
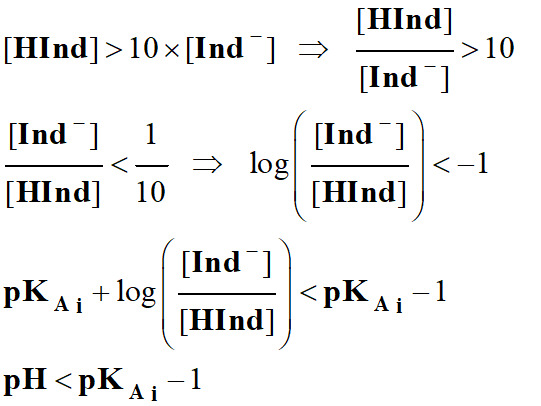
-
On admet, de façon
générale, que l'indicateur prend sa teinte
basique si :
-
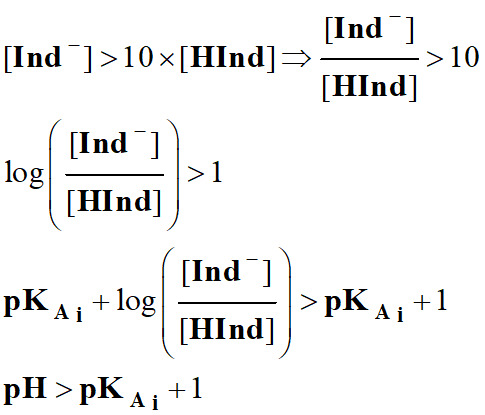
-
Dans la
zone de pH,
comprise entre :
-
pKAi
–1 ≥ pH
≥
pKAi
+1, l’indicateur coloré prend sa teinte
sensible.
-
Les couleurs des
teintes acide et basique se superposent.
-
Cette zone est appelée
zone de virage de l’indicateur coloré.
|
pKAi
– 1
pKAi
pKAi
+ 1
|
||
|
Couleur de
InH….. |
Zone de Virage
.. |
Couleur de In–… |
|
Teinte acide |
Teinte sensible |
Teinte
basique |
►
Cas du bleu de
bromothymol :
B.B.T.

|
|
6,0
7,6 |
||
|
B.B.T |
Jaune….. |
Zone de Virage..
vert |
Bleu……
|
-
Domaine de
prédominance :
:
zone de virage : 6,0 -
7,6.

-
Remarque : la zone de virage est inférieure à 2 unités
pH car la teinte acide est
jaune et la teinte basique est bleue.
-
L’œil peut bien
distinguer les deux couleurs.
-
Il se peut que la zone
de virage soit supérieure à 2 unités pH
si l’œil a du mal à distinguer les deux couleurs.
-
Un indicateur coloré
acido-basique est adapté à un titrage si la zone de virage de l’indicateur
coloré contient le pH
à l’équivalence pHE
du titrage.
-
L’utilisation d’un
indicateur coloré permet de repérer visuellement l’équivalence d’un titrage
acido-basique grâce au changement de teinte du mélange réactionnel.
-
Tableau des
indicateurs colorés utilisés au Lycée.
|
|
3,1 4,4 |
||
|
Hélianthine |
rouge |
Zone de
Virage
orange |
Jaune |
|
|
6,0
7,6 |
||
|
B.B.T |
Jaune….. |
Zone de Virage..
vert |
Bleu……
|
|
|
8,2 10 |
||
|
Phénolphtaléine |
Incolore |
Zone de virage Rose très pâle |
Rose |
►
Titrage acido-basique
avec un indicateur coloré :
-
Dosage de l’acide
méthanoïque par la soude :
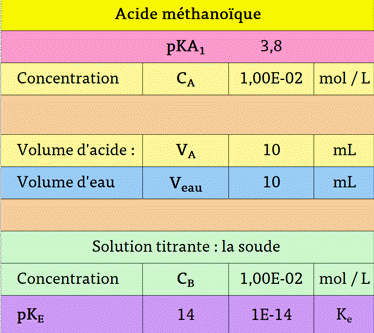
-
Le
B.B.T est un
indicateur coloré adapté pour ce titrage.
-
Le
pH à l’équivalence
pHE
appartient à la zone de virage.
-
La
phénolphtaléine convient aussi, bien que le pH
à l’équivalence n’appartienne pas à la zone de virage, car le saut de
pH est vertical et
grand.
-
L’hélianthine vire
avant l’équivalence.
4)- Solution tampon et
contrôle du
pH.
-
Une solution tampon
est une solution dont le pH
varie faiblement lors de l’addition modérée :
-
D’un acide,
-
D’une base,
-
Ou par une dilution
modérée.
-
Une telle solution
contient un acide faible et sa base conjuguée en concentrations voisines.
-
Le
pH d’une telle
solution est voisin du pKA
du couple acide / base considéré.
-
L’étalonnage du
pH-mètre nécessite
l’utilisation de deux solutions étalons (solutions tampons) de
pH connu.
-
Un
acide α-aminé contient les groupes caractéristiques carboxyle
– COOH
et amine – NH2.
-
Ces groupes
caractéristiques sont portés par le même atome de carbone.
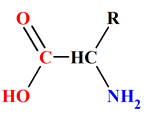
-
Le groupement amino
–
NH2,
a un comportement basique, alors que le groupement carboxyle
– COOH
a un comportement acide.
b)-
Acide α-aminés en solution
aqueuse.
-
En solution aqueuse,
un acide α-aminé existe essentiellement sous forme d’ions dipolaires appelés
amphions ou
zwitterions.
-
Un
amphion résulte du transfert interne d’un proton
H+
du groupe carboxyle vers le groupe amine de l’acide α-aminé.
-
On est en présence
d’une réaction acido-basique intramoléculaire.
|
|
|
|
|
Acide α-aminé |
|
Amphion ou
zwitterion |
-
Remarque :
-
L’amphion est un
ampholyte
comme la molécule d’eau.
-
C’est une espèce
amphotère.
-
C’est l’acide du
couple amphion / anion :
|
H3N+
– CHR – COO–
(aq) |
|
H2N – CHR – COO– (aq) |
+ |
H+ |
|
Amphion |
|
Anion |
|
|
-
C’est la base du
couple cation / amphion :
|
H3N+ – CHR – COOH
(aq) |
|
H3N+ – CHR – COO–
(aq) |
+ |
H+ |
|
Cation |
|
Amphion |
|
|
-
pKA
de quelques acides α-aminés :
|
Acide
α-aminé |
pKA1
cation / amphion |
pKA2
amphion / anion |
|
Glycine |
2,4 |
9,8 |
|
Alanine |
2,4 |
9,9 |
|
Valine |
2,3 |
9,4 |
-
Tableau :
|
Acide
α-aminé |
Nom |
Abréviation
|
Formule brute |
Formule
topologique |
|
Glycine |
Acide
aminoéthanoïque |
Gly
G |
C2H5NO2 |
|
|
Alanine |
Acide
2-aminopropanoïque |
Ala
A |
C3H7NO2 |
|
|
Valine |
Acide
2-amino-
3-méthylbutanoïque |
Val
V |
C5H11NO2 |
|
►
Cas de la glycine :
-
Diagramme de
prédominance :
-
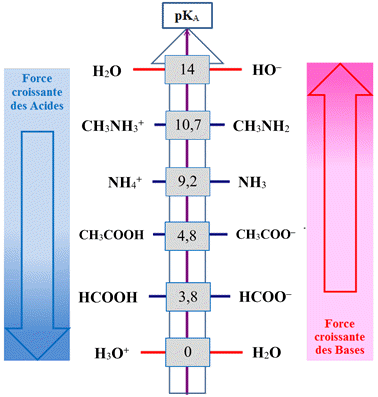
Valeurs
des pKA
pour quelques couples acide / base dans l’eau :
►
Remarques :
-
Pour une même
concentration en soluté apporté :
-
Un
acide est d’autant plus fort qu’il cède facilement un proton et donc que son
pKA
du couple auquel il appartient est
petit
ou que son KA
est grand.
-
Une
base est d’autant plus forte qu’elle capte facilement un proton et donc que son
pKA
du couple auquel elle appartient est
grand
ou son KA
est petit.
-
En
solution aqueuse, l’acide le plus fort est l’ion oxonium
H3O+
(aq) et la base la plus forte l’ion hydroxyde
HO–
(aq).
►
Exploitation de l’échelle des
pKA :
-
L’acide
éthanoïque (pKA
= 4,8) est situé au –dessus de l’acide méthanoïque (pKA
= 3,8)
-
L’acide
méthanoïque HCOOH
(aq) est un acide plus fort que l’acide éthanoïque
CH3COOH
(aq).
-
En
revanche, l’ion éthanoate
CH3COO–
(aq) (base conjuguée de l’acide
éthanoïque) est une base plus forte que l’ion méthanoate
HCOO–
(aq) (base conjuguée de l’acide
méthanoïque).
|
QCM r
Force des acides et des
bases. La réaction d’un acide
ou d’une base avec l’eau.
|
|
Préparation à l’ECE : Étude d’un comprimé d’aspirine 1)- Exercice 03
page 164 :Associer une constante d’équilibre à une équation de réaction. 2)- Exercice 05
page 164 : Déterminer la composition finale d’une solution. 3)- Exercice 07
page 164 : Justifier le caractère fort d’un acide. 4)- Exercice 09
page 165 : Écrire une constante d’acidité. 5)- Exercice 10
page 165 : Calculer une constante d’acidité. 6)- Exercice 12
page 165 : Comparer la force de trois bases dans l’eau. 7)- Exercice 13
page 165 : Tracer un diagramme de prédominance. 8)- Exercice 14
page 165 ; Exploiter un diagramme de distribution. 9)- Exercice 15
page 165 : Justifier le choix d’un indicateur coloré. 10)- Exercice 17
page 166 : Reconnaître un effet tampon. 11)- Exercice 20
page 166 : Les couleurs des hortensias. 12)- Exercice
23 page 167 : Indicateur coloré adapté à un titrage. 13)- Exercice 22
page 167 : Résoudre une équation du second degré. 14)- DS 01 : Une
astuce culinaire (60 min) : Exercice 31 page 170. |
|
|