|
|
Les transformations acido-basiques Exercices |
|
|
|
|
|
QCM r
|
1)- Exercice 04 page 22 : Identifier un transfert d’ion hydrogène :
|
Identifier un transfert d’ion hydrogène : Les espèces chimiques suivantes sont des acides ou des bases
selon la théorie de Bronsted : HCO3– (aq) ; CH3COOH
(aq) ; CO2, H2O ; NH3
(aq) ; HO– (aq) ; H3O+
(aq) ; CH3COO– (aq) ; NH4+ (aq) ;
H2O (ℓ). 1.
Définir un acide et une base selon la
théorie de Bronsted. 2.
Former les couples acide -base à partir des
formules chimiques données ci-dessus. 3.
Écrire les demi-équations acide-base
associées aux couples formés. 4.
Justifier que l’eau est une espèce
amphotère. 5. Représenter le schéma de Lewis et la formule semi-développée de l’acide éthanoïque en entourant l’hydrogène
acide. |
|
Identifier un transfert d’ion hydrogène : Les espèces chimiques suivantes sont des acides ou des bases
selon la théorie de Bronsted : HCO3– (aq) ; CH3COOH
(aq) ; (CO2, H2O) (aq) ;
NH3 (aq) ; HO– (aq) ; H3O+
(aq) ; CH3COO– (aq) ; NH4+ (aq) ;
H2O (ℓ).
1.
Définir un acide et une base selon la
théorie de Bronsted. - Pour le chimiste danois Joannes Nicolaus Bronsted un transfert d’ion hydrogène H+ a lieu entre un acide et une base.
-
Un
acide est une espèce chimique capable de céder au
moins un ion hydrogène H+.
-
L’acide
AH se transforme alors en
sa base conjuguée A–.
-
Une
base est une espèce chimique capable de capter au
moins un hydrogène H+.
-
La
base A–
se transforme alors en son acide conjugué
AH. 2.
Les différents couples acide -base à partir
des formules chimiques données ci-dessus.
-
Tableau :
3.
Demi-équations acide-base associées aux
couples formés.
4.
Espèce
amphotère :
-
Une espèce amphotère est à la fois l’acide
d’un couple et la base
d’un autre couple.
-
Cas de l’eau :
-
L’eau appartient à deux couples
acido-basiques.
-
L’ion
H3O+
(aq) est l’acide du couple
H3O+
(aq) / H2O
(ℓ)
-
L’ion
HO–
(aq) est la base du couple H2O
(ℓ) / HO–
(aq).
-
L’eau est la base du couple
H3O+
(aq) / H2O
(ℓ) et l’acide du couple H2O
(ℓ) / HO–
(aq).
-
On dit que l’eau est un
ampholyte ou une espèce
amphotère. 5.
Schéma de Lewis et la formule
semi-développée de l’acide éthanoïque.
-
Schéma de Lewis :
-
Formule semi-développée :
|
|||||||||||||||||||||||||||||||||||||||||
2)- Exercice 05 page 22 : Identifier les couples acide-base :
|
Les couples : MnO4– (aq) / Mn2+
(aq) ; NH3 (aq) / NH4+ (aq) SO42– (aq) / HSO3–
(aq) ; O2 (g) / H2O2
(aq) ; HCOOH (aq) / HCOO– (aq) 1.
Parmi les couples ci-dessus, identifier les
couples acide-base. 2.
Écrire les demi-équation des couples
acide-base. 3.
L’ion hydrogénosulfate : a.
L’ion hydrogénosulfate HSO4–
(aq) est une espèce
amphotère. Définir ce terme. b.
Écrire les deux couples acide-base formés
par l’ion hydrogénosulfate. 4.
Justifier le caractère basique de l’ammoniac
à partir du schéma de Lewis de sa molécule. |
|
Identifier les couples acide-base : Les couples : MnO4– (aq) / Mn2+
(aq) ; NH3 (aq) / NH4+ (aq) SO42– (aq) / HSO3
(aq) ; O2 (g) / H2O2
(aq) ; HCOOH (aq) / HCOO– (aq) 1.
Identification les couples acide-base.
-
Les couples acide-base :
-
Couples oxydant-réducteur :
- Demi-équation électronique :
-
Le couple suivant ne représente pas
un couple acide-base :
-
SO42–
(aq) / HSO3–
(aq)
-
L’ion hydrogénosulfite n’est pas la
base conjuguée de l’ion sulfate
SO42–
(aq).
-
L’ion hydrogénosulfite
HSO3– (aq) est l’acide conjugué de l’ion
sulfite :
-
HSO3–
(aq) / SO32–
(aq)
-
Ou, l’acide sulfureux
(SO2,
H2O)
(aq) est
l’acide conjuguée de l’ion hydrogénosulfite.
-
(SO2,
H2O)
(aq) / HSO3–
(aq)
2.
Demi-équation des couples acide-base.
3.
L’ion hydrogénosulfate : a.
L’ion hydrogénosulfate HSO4–
(aq) :
-
Une espèce amphotère est à la fois l’acide
d’un couple et la base
d’un autre couple.
-
L’ion hydrogénosulfate est
la base
du couple H2SO4
(ℓ) /
HSO4–
(aq)
-
L’ion hydrogénosulfate est
l’acide du couple
HSO4–
(aq) / SO42–
(aq) b.
Les couples acide-base formés par l’ion
hydrogénosulfate.
4.
Caractère
basique de l’ammoniac à partir du schéma de Lewis de sa molécule.
-
La molécule d’ammoniac NH3
est une base de Lewis.
-
L’atome d’azote porte un doublet non
liant.
-
Une base de Lewis est une entité
chimique dont l’un des atomes possède un doublet non liant.
-
Un acide de Lewis est une entité
chimique dont l’un des atomes possède une lacune électronique.
-
Le proton H+ joue
le rôle d’un acide de Lewis, il porte une lacune électronique. |
||||||||||||||||||||||||||||||||||||||||||||||||
3)- Exercice 06 page 22 : Équation d’une réaction acide-base :
|
Équation d’une réaction acide-base : En mélangeant une solution d’hydrogénocarbonate de sodium [Na+ (aq) + HCO3– (aq)] avec du vinaigre (solution contenant de l’acide éthanoïque), une réaction se produit. On observe une effervescence.
1.
Donner la formule chimique de l’acide
éthanoïque. 2.
Écrire les couples acide-base mis en jeu au
cours de la transformation. 3.
Deux réactions opposées ont lieu. Écrire
l’équation sachant que la transformation est non totale. 4.
Justifier l’effervescence observée. |
Équation d’une réaction acide-base : 1.
Formule chimique de l’acide éthanoïque.
-
L’acide éthanoïque (acide acétique :
acetum : vin aigre) est un acide carboxylique.
-
Les acides carboxyliques possèdent en
commun le groupe caractéristique :
– COOH.
-
Le nom de l'acide carboxylique dérive
de celui de l'alcane de même squelette carboné en remplaçant le
e final par la terminaison
oïque, le tout étant précédé du mot acide.
-
Le carbone fonctionnel est toujours
en bout de chaîne et porte le numéro
1.
-
L'acide éthanoïque dérive donc de
l’éthane C2H6.
-
CH3 –
COOH
-
Le vinaigre est obtenu par
fermentation de l'éthanol contenu dans le vin.
-
Cette fermentation se produit au
contact de l'air et en présence de microorganismes.
-
Il apparaît alors un voile à la
surface du liquide.
-
On observe ainsi l'oxydation ménagée
de l'éthanol, en éthanal, puis en acide éthanoïque. 2.
Couples acide-base mis en jeu au cours de la
transformation. Couples acide-base
Acide
Base
conjuguée (CO2,
H2O) (aq) Dioxyde de
carbone dissous
dans l’eau HCO3– (aq) Ion
hydrogénocarbonate CH3COOH
(aq) Acide
éthanoïque CH3COO–
(aq) Ion
éthanoate 3.
Équation
de la transformation est non totale.
CH3COOH
(aq)
CH3COO
– (aq)
+
H+
(1) HCO3– (aq)
+
H+ (CO2,
H2O) (aq)
(2)
CH3COOH
(aq)
+
CH3COO
– (aq)
+ (CO2,
H2O) (aq)
(1) + (2) 4.
Justification de l’effervescence observée.
-
Tableau d’avancement : Équation
CH3COOH
(aq)
+
HCO3– (aq)
CH3COO
– (aq)
+
(CO2, H2O)
(aq)
État du
système
Avancement
n (CH3COOH)
n (HCO3–)
n (CH3COO
–)
n
(CO2)
État initial
(mol)
x =
0
n1
=
n2
=
0
0
État
intermédiaire
0 ≤ x ≤ xf
n1 – x
n2 – x
x
x
État final
(mol)
x = xf
n1 – xf
n2 – xf
xf
xf
-
La réaction est non totale : xf
< xmax
-
Au cours de la réaction, il se forme
du dioxyde de carbone CO2
(g).
-
En milieu acide, les ions
hydrogénocarbonate se transforment en dioxyde de carbone
CO2 (g).
-
La solubilité du dioxyde de carbone
dans l’eau à 25 °C est de l’ordre de 0,10 mol / L.
-
Comme la limite de solubilité est
vite atteinte, on observe un dégagement de dioxyde de carbone
CO2 (g)
(effervescence).


![]()
![]()
![]()
4)- Exercice 08 page 23 : Calculer le pH d’une solution :
|
Calculer le pH d’une
solution : Pour ne pas irriter la peau, l’eau d’une piscine doit avoir un
pH compris entre 7,2 et 7,4. La détermination de la concentration en ions oxonium d’une eau
d’une piscine donne : [H3O+] = 3,2 × 10–7
mol . L–1. 1.
L’eau de la piscine peut-elle provoquer des
irritations ? 2.
Calculer les concentrations en ions oxonium
correspondantes à l’intervalle de pH préconisé. 3.
Préciser la nature acide ou basique de
l’espèce à ajouter pour retrouver une eau de piscine acceptable. |
Calculer le pH d’une
solution : 1.
Qualité de l’eau de la piscine :
-
On connait la concentration en ions
oxonium de l’eau de la piscine.
-
On peut en déduire la valeur du
pH de l’eau de la
piscine.
-
Le
pH d’une solution est un
indicateur d’acidité lié à la présence des ions oxonium H3O+
(aq) en solution. Pour une solution diluée, [H3O+]
< 0,050 mol . L–1, Le
pH est défini par la relation suivante :
Cette relation est équivalente à :
pH :
grandeur sans unité [H3O+] : concentration en ions oxonium en mol . L–1
C0 :
concentration standard : C0 = 1,0 mol
. L–1
-
-
La valeur du
pH de l’eau de la piscine est inférieure à 7,2.
-
Cette eau peut provoquer des
irritations. 2.
Concentrations en ions oxonium
correspondantes à l’intervalle de pH préconisé.
-
Pour ne pas irriter la peau, l’eau
d’une piscine doit avoir un
pH compris entre 7,2 et 7,4 :
-
On utilise la relation équivalente :
-
Pour
pH =
7,2
-
[H3O+] =
C0 ×10–
pH mol . L–1
-
[H3O+] =
1,0 × 10–
7,2 mol . L–1
-
[H3O+] =
6,30 × 10– 8 mol
. L–1
-
[H3O+] =
6,3 × 10–
8 mol . L–1
-
Pour
pH = 7,4
-
[H3O+] =
C0 ×10–
pH mol . L–1
-
[H3O+] =
1,0 × 10–
7,4 mol . L–1
-
[H3O+] =
3,98 × 10– 8 mol
. L–1
-
[H3O+] =
4,0 × 10–
8 mol . L–
-
Encadrement
de la valeur de la concentration en ions oxonium de l’eau d’un
piscine : 4,0 × 10–
8 mol . L–1 ≤
[H3O+]
≤ 6,3 × 10–
8 mol . L–1 3.
Nature acide ou basique de l’espèce à
ajouter pour retrouver une eau de piscine acceptable.
-
Comme la concentration en ions
oxonium est trop élevée, il faut ajouter une espèce basique pour
faire diminuer la concentration en ion oxonium
[H3O+] et ainsi faire
augmenter la valeur du pH
de l’eau de la piscine.
-
Exemple : On peut ajouter de la soude
(solution aqueuse d’hydroxyde de sodium), du carbonate de sodium, de
l’hypochlorite de sodium,…
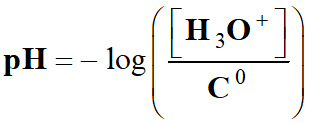
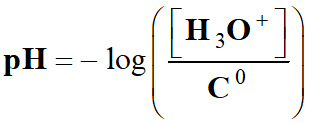
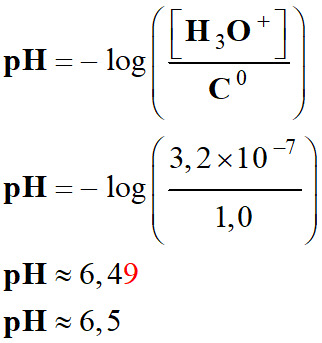
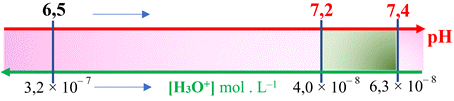
![]()
5)- Exercice 10 page 23 : Il en voit de toutes les couleurs :
|
Il en voit de toutes les couleurs : Le bleu de bromophénol se présente sous deux formes différentes : l’une colore la solution en jaune lorsque le pH est inférieur à 3,0, l’autre la colore en bleu lorsque le pH est supérieur à 4,6. Une solution S est obtenue en versant de l’acide nitrique HNO3 (ℓ) et quelques gouttes de bleu de bromophénol pur dans un volume d’eau La solution obtenue est verte. 1.
Écrire l’équation de la réaction acide-base
entre l’acide nitrique et l’au sachant que la transformation est
totale. 2.
Donner un encadrement de la concentration en
quantité de matière d’ions oxonium présents dans la solution S. 3.
Préciser la démarche à suivre pour que la
couleur de la solution vire au jaune. 4.
Solution d’hydroxyde de sodium : a. On ajoute de l’hydroxyde de sodium dans la solution S. Écrire l’équation de la réaction entre les ions hydroxyde et les ions oxonium présents
dans la solution S. La transformation est totale. b.
Justifier que les ions sodium Na+
(aq) sont spectateurs. c.
Indiquer la couleur de la solution si l’on
continue d’ajouter de l’hydroxyde de sodium à la solution S.
-
Données :
-
Formule topologique du bleu de
bromophénol :
-
Formule brute : :
C19H10Br4O5S |
|
Il en voit de toutes les couleurs : 1.
Équation de la réaction acide-base entre
l’acide nitrique et l’eau : -
Les
couples acide-base mis en jeu : -
HNO3 (ℓ) / NO3– (aq) et H3O+
(aq) / H2O (ℓ)
-
La
réaction chimique :
2.
Encadrement de la concentration en quantité
de matière d’ions oxonium présents dans la solution S : -
La
solution obtenue est verte. -
Le
bleu de bromophénol est un indicateur coloré qui est l’acide d’un
couple acide-base. -
Notation simplifiée : -
La
forme acide est notée InH et la forme basique In– -
Couple acide-base : InH (aq) / In– (aq) -
Teinte de la forme acide du bleu de bromophénol InH (aq)
: jaune. - Teinte de la forme
basique du bleu de bromophénol In– (aq) :
bleu. -
Teinte de la zone de virage : vert. -
Dans
ce cas : [InH] ≈ [In–] -
Schéma :
-
On
utilise la relation équivalente : -
Pour pH = 3,0 -
[H3O+]
= C0 ×10–
pH mol
. L–1 -
[H3O+]
= 1,0 × 10– 3 mol
. L–1 -
Pour
pH = 4,6 -
[H3O+]
= C0 ×10–
pH mol
. L–1 -
[H3O+]
= 1,0 × 10– 4,6 mol
. L–1 -
[H3O+]
= 2,51 × 10–
5 mol . L–1 -
[H3O+]
= 2,5 × 10– 5 mol
. L– -
Encadrement de la valeur de
la concentration en ions oxonium de l’eau d’un piscine : 2,5
× 10– 5 mol
. L–1 ≤
[H3O+]
≤ 1,0 × 10–
3 mol . L–1 3.
La solution vire au jaune : -
Schéma :
-
Dans
ce cas, le pH de la solution doit diminuer. -
Il
faut augmenter la concentration en ions oxonium
[H3O+] -
[H3O+]
> 1,0 × 10– 3 mol
. L–1 -
Il
faut ajouter de l’acide nitrique HNO3 (ℓ) dans la
solution S. 4.
Solution d’hydroxyde de sodium : a.
Équation de la réaction entre les ions
hydroxyde et les ions oxonium présents dans la solution S : -
La
solution aqueuse d’hydroxyde de sodium : Na+ (aq)
+ HO– (aq) -
Cette réaction met en jeu les couples suivants : -
H2O
(ℓ) /
HO – (aq) :
H2O
(ℓ)
-
H3O
+ (aq) /
H2O
(ℓ) :
H3O
+ (aq)
b.
Les ions sodium Na+ (aq)
sont spectateurs. -
Dans l’état actuel d’avancement du programme : -
Les
ions Na+(aq) n’ont aucun caractère acide ou basique. -
Les
ions Na+(aq) sont des ions spectateurs pour les réactions acide-base. c.
Couleur de la solution si l’on continue
d’ajouter de l’hydroxyde de sodium à la solution S. - Si on ajoute la solution aqueuse d’hydroxyde de sodium à la solution S, la concentration en ions oxonium diminue
et le pH de la solution obtenue augmente. -
Car
il se produit la réaction suivante : H3O +
(aq) + HO –
(aq) →
2 H2O (ℓ) -
Lorsque [H3O+]
< 2,5 × 10– 5 mol
. L–1 -
Le
pH > 4,6 -
La
solution prend une
teinte bleue. -
Additif : -
Domaines
de prédominance (2000). -
Domaines de prédominance
(2004). -
Domaine de prédominance (2010).
-
Forme 1 que l’on note
BBPH2 qui est de teinte jaune.
-
La forme 2 que l’on note
BBPH– qui est de teinte bleue.
-
La forme 3 que l’on note
BBP2– qui est incolore.
-
pKA des
couples acide-base mis en jeu.
-
pKA (BBPH2 /
BBPH–)
= 4,1 et pKA (BBPH– / BBP2–)
= 7,3
-
Si le
pH < 3, la forme jaune
est prédominante.
-
Si le pH > 5 c’est la forme bleue qui
est prédominante.
-
Le passage d’une forme à l’autre et
quasi-instantanée et renversable.
-
Le passage de la forme bleue à la
forme incolore est en revanche particulièrement lente.
-
On ne l’observe avec une vitesse
notable qu’en milieu vraiment basique.
-
Cette réaction de décoloration peut
être utilisée pour l’étude cinétique d’une réaction chimique. |
6)- Exercice 12 page 23 : Les coraux face à l’acidification des océans :
|
Le pH moyen des eaux de mers et des océans était de 8,15 avant l’ère industrielle, et se situe désormais autour de 8,05. Les coquilles ou les exosquelettes des crustacé et des coraux formés essentiellement de carbonate de calcium CaCO3 (s) ont plus de difficultés à se former dans les eaux acides.
1. Le dioxyde de carbone dissout {CO2, H2O }(aq) réagit avec l’eau selon une réaction non totale. Écrire l’équation de la réaction. 2.
Pourquoi le pH des eaux de mers et
des océans diminue-t-il depuis l’ère industrielle ? 3. Montrer que la diminution constatée du pH depuis le début de l’ère industrielle correspond à une augmentation
de 30 % des ions oxonium dans les océans. 4.
Soient les réactions opposées dont
l’équation est donnée ci-dessous. CaCO3 (s) + H3O+
(aq) Ca2+
(aq) + HCO3– (aq) + H2O
(ℓ)
-
En déduire pourquoi les coraux sont
menacés par les activités humaines.
-
Donnée : -
|
|
Les coraux face à l’acidification des océans : 1.
Équation
de la réaction. {CO2, H2O
}(aq) + H2O (ℓ)
-
D’autre part : HCO3– (aq) + H2O
(ℓ)
-
L’ion hydrogénocarbonate est une
espèce amphotère.
-
Couples acide-base : {CO2,
H2O }(aq) /
HCO3–
(aq) et HCO3–
(aq) / CO32–
(aq) 2.
Le pH des eaux de mers et des océans
diminue depuis l’ère industrielle :
-
L’activité industrielle produit du
dioxyde de carbone CO2
(g).
-
C’est un gaz à effet de serre
important.
-
Ce dioxyde de carbone est
partiellement soluble dans l’eau (solubilité du dioxyde de carbone
dans l’eau à 20 ° C : 1,688 g . L–1) - La dissolution du dioxyde de carbone atmosphérique entraîne l’acidification de l’eau de mer et des océans
du fait de la formation des ions oxonium
H3O+
(aq) lors de la réaction (1) 3.
Diminution constatée du pH depuis le
début de l’ère industrielle.
-
Le
pH moyen des eaux de mers
et des océans était de
8,15 avant l’ère industrielle, et se situe désormais autour de 8,05.
-
On peut calculer la concentration en
ions oxonium H3O+
(aq) pour chaque valeur du pH :
-
Pour
pH1 = 8,15
-
[H3O+]1
= C0 ×10– pH1 mol
. L–1
-
[H3O+]1
= 1,0 × 10–
8,15 mol . L–1
-
[H3O+]1
= 7,07 × 10– 9 mol . L–1
-
[H3O+]1
= 7,1 × 10–
9 mol . L–1
-
Pour
pH2 = 8,05
-
[H3O+]2
= C0 ×10– pH2 mol
. L–1
-
[H3O+]2
= 1,0 × 10–
8,05 mol . L–1
-
[H3O+]2
= 8,91 × 10– 9 mol . L–1
-
[H3O+]2
= 8,9 × 10–
9 mol . L–1
-
Diagramme :
-
On peut calculer la variation
relative de la concentration en ions oxonium :
-
-
L’augmentation de la concentration
des ions oxonium dans les mers et océans est proche de 30 %.
-
Autre méthode :
-
-
[H3O+]2 ≈ 1,26 [H3O+]1
-
Cela correspond à une augmentation
d’environ 26 % (proche de 30 %). 4.
Les coraux sont menacés par les activités
humaines. CaCO3 (s) + H3O+
(aq)
-
La présence d’un excès de dioxyde de
carbone, entraîne la formation d’ions oxonium.
-
Ceci entraîne la dissolution du
carbonate de calcium CaCO3
(s).
-
La réaction entre le carbonate de
calcium CaCO3
(s) et déplacé dans le sens de la formationdes ions calcium
Ca2+ (aq) et
des ions hydrogénocarbonate
HCO3– (aq).
-
L’acidification des mers et océans
réduit la concentration des carbonates dans l’eau de mer tout en
augmentant celle des ions hydrogénocarbonates.
-
La coquille des organismes marins va
devenir plus fine, et les coraux risquent de disparaître. |
7)- Exercice 14 page 24 : Nettoyer à l’ammoniaque :
|
Nettoyer à l’ammoniaque : Une solution aqueuse commerciale S1 contenant de l’ammoniac NH3 (aq) peut être utilisée, après dilution, comme produit nettoyant
(éviers, lavabos, etc.) ou comme produit détachant (moquette, tapis). Une solution aqueuse S2 est obtenue après
dilution de la solution S1.
-
Présentation :
1.
Lister la
verrerie nécessaire pour réaliser une dilution, ainsi que les
consignes de sécurité. 2.
Réaction chimique : a.
L’ammoniac NH3 (aq) réagit
avec l’eau selon une transformation non totale. Écrire l’équation. b.
Écrire les couples acide-base mis en jeu. 3.
Le pH de la solution S2
est égal à 10,5. Préciser la nature (basique, neutre, acide) de la
solution. 4.
Déterminer la concentration en ions oxonium
[H3O+] de la solution S2. 5.
Justifier le caractère acide ou basique
d’une solution d’ammoniac à partir du schéma de Lewis de la
molécule. 6.
À partir du schéma de Lewis de l’ion
ammonium, justifier que l’ion ammonium ne peut pas être une espèce
amphotère. |
|
Nettoyer à l’ammoniaque : 1.
Verrerie nécessaire pour réaliser une
dilution, ainsi que les consignes de sécurité.
-
Verrerie de précision : Fiole jaugée
avec son bouchon, pipette jaugée munie de sa propipette
-
Verrerie : béchers
-
Pissette d’eau distillée
-
Éléments de sécurité : Blouse, gants,
lunette, hotte aspirante.
2.
Réaction chimique : a.
Équation de la réaction entre l’ammoniac
NH3 (aq) et l’eau
b.
Couples acide-base mis en jeu.
3.
Nature (basique, neutre, acide) de la
solution.
-
Le
pH de la solution
S2 est égal à
10,5.
-
Le
pH de la solution est
supérieur à 7 : la solution est basique. 4.
Concentration en ions oxonium [H3O+]
de la solution S2.
-
pH = 10,5
-
[H3O+] =
C0 ×10–
pH mol . L–1
-
[H3O+] =
1,0 × 10–
10,5 mol . L–1
-
[H3O+] =
3,16 × 10– 11 mol
. L–1
-
[H3O+] =
3,2 × 10–
11 mol . L–1 5.
Caractère acide ou basique d’une solution
d’ammoniac à partir du schéma de Lewis de la molécule.
-
La molécule d’ammoniac NH3
est une base de Lewis.
-
L’atome d’azote porte un doublet non
liant.
-
Le doublet non liant situé sur
l’atome d’azote est un site donneur de doublet d’électrons.
-
Il permet de se lier à l’ion
hydrogène qui présente une lacune en électron.
-
On obtient ainsi l’ion ammonium : 6.
L’ion ammonium ne peut pas être une espèce
amphotère.
-
Schéma de Lewis de l’ion ammonium :
-
L’ion ammonium
NH4+
(aq) est l’acide conjugué de l’ammoniac
NH3 (aq).
-
Pour être une espèce amphotère, l’ion
ammonium doit être une base d'un autre couple.
-
L’ion ammonium ne possède pas de
doublet non liant et ne peut pas se lier avec un ion hydrogène
H+.
-
De plus il est chargé positivement
comme l’ion hydrogène H+.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
8)- Exercice 17 page 25 : Discuter un modèle :
|
Discuter un modèle : Partie I : Étude de solutions
fortement concentrées en ions oxonium. On mesure le pH de trois solutions aqueuses de différentes
concentration en ion oxonium. Tableau :
1.
Commenter le nombre de chiffres
significatifs affichés par le pH-mètre. b.
Calculer le pH de chaque solution à
l’aide de cette relation. 3.
Comparer avec les valeurs expérimentales et
expliquer les écarts observés. Partie II : Étude de solutions
faiblement concentrées en ions oxonium. Dans un deuxième temps, on mesure le pH de solutions aqueuses diluées d’acide chlorhydrique de différentes concentrations
C en soluté apporté.
-
Graphe :
-
Complément scientifique : - Outre les molécules d’eau, l’eau distillée contient des ions oxonium H3O+ (aq) et des ions HO–
(aq) en très faibles quantités :
-
[H3O+] =
[HO–]
= 1,0 × 10–7
mol . L–1 4.
Écrire la formule des espèces présentes dans
une solution d’acide chlorhydrique. 5.
Justifier que les ions chlorure sont
spectateurs. 6.
Sachant que la relation
proposer une explication au fait
que la relation
pour une concentration C inférieure
à 1,0 × 10–6
mol . L–1 |
Discuter un modèle : Tableau :
[H3O+]
(mol . L–1)
0,10
0,50
1,0
pH
1,13
0,42
0,16 1.
Nombre de chiffres significatifs affichés
par le pH-mètre.
-
La première mesure est donnée avec 3
chiffres significatifs.
-
Les deux autres mesures sont données
avec 2 chiffres significatifs.
-
b.
pH de chaque solution à l’aide de
cette relation.
[H3O+]
(mol . L–1)
0,10
0,50
1,0
pH
1,13
0,42
0,16 3.
Comparaison avec les valeurs
expérimentales :
-
Les valeurs calculées sont
inférieures aux valeurs expérimentales.
-
Au plus la solution est concentrée,
au plus l’écart avec la valeur expérimentale est grand. 4.
Formule des espèces présentes dans une
solution d’acide chlorhydrique.
-
Solutions aqueuse acides : Solutions
aqueuses
acides
Notation
Acide
chlorhydrique
H3O+(aq)
+
Cℓ– (aq)
-
La
réaction entre le chlorure d’hydrogène gazeux est l’eau est une
réaction totale :
HCℓ
(g)
Cℓ –
(aq)
+
H+
(1)
H2O
(ℓ)
+
H+
H3O
+ (aq)
(2)
HCℓ
(g)
+
H2O
(ℓ)
→
Cℓ –
(aq)
+
H3O
+ (aq)
(1)+ (2) 5.
Les ions chlorure sont spectateurs.
-
Les ions chlorure, Cℓ–
(aq) sont des ions spectateurs pour les réactions acide-base.
-
Ils n’ont aucun caractère acide ou
basique. 6.
La relation
-
Tableau de valeurs : pH C
mol , L-1
- log (C /
C0) [H3O+]
-log ([H3O+]/C0) mol . L-1 mol . L-1 1,0 1,00E-01 1,0 1,00E-01 1,00 1,5 3,16E-02 1,5 3,16E-02 1,50 2,0 1,00E-02 2,0 1,00E-02 2,00 2,5 3,16E-03 2,5 3,16E-03 2,50 3,0 1,00E-03 3,0 1,00E-03 3,00 3,5 3,16E-04 3,5 3,16E-04 3,50 4,0 1,00E-04 4,0 1,00E-04 4,00 4,5 3,16E-05 4,5 3,16E-05 4,50 5,0 1,00E-05 5,0 1,00E-05 5,00 5,5 3,16E-06 5,5 3,16E-06 5,50 6,0 1,00E-06 6,0 1,01E-06 6,00 6,5 3,16E-07 6,5 3,45E-07 6,46 7,0 1,00E-07 7,0 1,62E-07 6,79 7,5 3,16E-08 7,5 1,17E-07 6,93 8,0 1,00E-08 8,0 1,05E-07 6,98
-
Graphe :
-
Pour
C < 6,5 × 10–6
mol . L–1
-
-
À partir de cette concentration, les
ions oxonium provenant de l’autoprotolyse de l’eau ne sont plus
négligeables.
-
On remarque que pour une solution
d’acide chlorhydrique de concentration
C telle que : 6,5 × 10–6
mol . L–1 <
C < 1,0 × 10–1 mol . L–1 Alors
Autoprotolyse de l’eau.
-2004 :
-
2010 :
-
La réaction d’autoprotolyse de l’eau a lieu dans toute solution aqueuse et notamment dans l’eau pure.
-
Des mesures précises réalisées en
laboratoire ont montré qu’à 25 ° C, le
pH de l’eau pure est égal
à 7,0.
-
Dans l’eau pure : [H3O+]
= [HO–] = 1,0 × 10–7 mol .L–1 H2O (ℓ)
+ H2O
(ℓ)
-
Cette réaction porte le nom
d'autoprotolyse de l'eau.
-
C'est une réaction non totale (limitée).
-
Seulement 2 molécules d'eau sur 550 millions participent
à la formation des ions :
-
Considérons 1,0 L d'eau pure à 25° C :
-
n (H2O) ≈
55,6 mol
-
n (H3O+)
≈ 1,0 × 10–7 mol
-
n (OH–)
≈ 1,0 × 10–7 mol
-
Il existe une réaction inverse à la réaction
d'autoprotolyse de l'eau,
-
C'est
la réaction acido-basique : réaction totale
(quasi-totale)
H3O+
(aq) + HO–
(aq) →
H2O (ℓ)
+
H2O (ℓ)
(2)
-
Il existe dans l'eau deux réactions inverses qui se
produisent simultanément.
-
Elles annulent mutuellement leurs effets.
-
On
arrive à un équilibre dynamique.
H2O
(ℓ) +
H2O (ℓ)
-
sens direct (1) :
autoprotolyse de l'eau : réaction non totale (réaction
limitée)
-
sens inverse (2):
réaction acido-basique : réaction totale (réaction
quasi-totale).
-
Si on
continue à diluer la solution d’acide chlorhydrique, le
pH de la solution obtenue
tend vers 7,0.
-
Dans l'eau pure, on trouve : une
espèce majoritaire, l'eau H2O
(ℓ) et des espèces ultra minoritaires, les ions oxonium
H3O+
(aq) et les ions hydroxyde HO–
(aq).
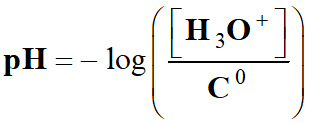
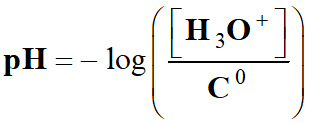
1,0
0,30
0,0


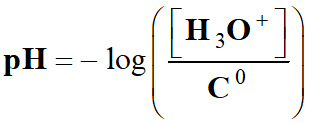 pour les solutions diluées :
pour les solutions diluées :
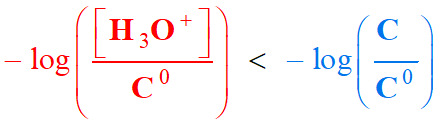 ou
ou
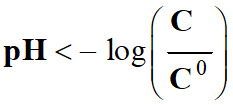
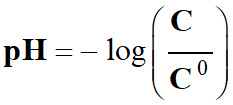
![]() H3O+
(aq) + HO–
(aq) (1)
H3O+
(aq) + HO–
(aq) (1)![]() H3O+ (aq)
+ HO– (aq)
(1)
H3O+ (aq)
+ HO– (aq)
(1)![]()
|
|