|
Chim
N° 03 : |
|
|
|
I- Étude d'un acide faible : l'acide éthanoïque.
- L'acide éthanoïque dont le nom commun est acide acétique de formule CH3COOH
porte le groupement — COOH caractéristique des acides carboxyliques.
- Dans les conditions normales de températures et de pression, c'est un liquide incolore d'odeur piquante et caustique.
- il brûle la peau. Il ne conduit pas le courant.
- Sa densité est voisine de celle de l'eau : d ≈ 1,049.
- Il est miscible à l'eau en toutes proportions.
2)- Étude de la solution aqueuse d'acide éthanoïque.
- La solution aqueuse d'acide éthanoïque conduit le courant électrique, en conséquence, elle contient des ions.
- D'autre part, la solution est acide, elle fait virer au jaune le bleu de bromothymol.
- La dissolution de l'acide éthanoïque dans l'eau est une réaction chimique.
3)- pH des solutions aqueuses d'acide éthanoïque.
- Les solutions d'acide éthanoïque sont nettement moins acides que celle de l'acide chlorhydrique de même concentration.
- tableau.
|
Coefficient de dissociation de l'acide éthanoïque |
α % |
1,25 |
3,9 |
12 |
33 |
70 |
94 |
99 |
99,4 |
|
Concentration |
C mol / L |
10 –1 |
10 –2 |
10 –3 |
10 –4 |
10 –5 |
10 –6 |
10 –7 |
10 –8 |
|
Acide éthanoïque |
pH |
2,9 |
3,4 |
3,9 |
4,5 |
5,2 |
6 |
6,79 |
6,98 |
|
Acide chlorhydrique |
pH |
1,1 |
2 |
3 |
4 |
5 |
6 |
6,79 |
6,98 |
|
|
– log C |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
- Exploitation de la mesure du pH.
![]() Application 1 :
Application 1 :
-
Déterminer la concentration des différentes espèces présentes pour
C = 10–2 mol
/ L.
- Donner les espèces majoritaires, minoritaires et ultra minoritaires.
- Calculer le coefficient de dissociation ou d'ionisation ou le degré d'ionisation α :
|
α = |
Quantité de matière de molécules dissociées |
|
―——————————————————— |
|
|
Quantité de matière de molécules mises en solution |
► Solution :
-
Inventaire des espèces présentes : CH3COOH
; CH3COO– ;
H3O+
; OH – et le solvant H2O.
- Pour
C = 1,0
× 10–2 mol / L, pH
= 3,4.
- On peut
négliger la réaction d'autoprotolyse de l'eau devant la réaction de dissolution
de l'acide éthanoïque.
- Mesure du
pH :
pH = 3,4
- Par
définition :
- pH = –
log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+]
= 10– 3,4 mol.L–1
-
[H3O+]
≈ 4,0
× 10–4 mol / L.
-
produit ionique de l'eau :
- pKe
= 14 à 25 °C
-
[OH–] = 10 pH – pKe mol.L–1
-
[OH–] =
10 3,4
– 14 mol.L–1
-
[OH–] ≈ 2,5
× 10–11 mol.L–1
-
équation d'électroneutralité :
- [H3O+]
= [CH3COO–] + [OH–]
- Or [H3O+]
>> [OH–]
- (voir
au-dessus : [H3O+]
≈ 4,0
× 10–4 mol / L et [OH –] ≈ 2,5
× 10–11 mol.L–1)
-
[H3O+]
≈ [CH3COO
–] ≈ 4,0
× 10–4 mol / L
-
équation de conservation de la
matière :
- L'acide
éthanoïque dissous, se trouve sous deux formes, soit sous forme de molécule
d'acide éthanoïque, soit sous forme d'ion éthanoate.
-
[CH3COOH]
+ [CH3COO–] = C
-
[CH3COOH]
= C – [CH3COO–]
-
[CH3COOH]
≈ 1,0
× 10–2 –
4,0
× 10–4
-
[CH3COOH]
≈ 9,6
× 10–3 mol / L
- Espèce
majoritaire : CH3COOH;
espèces minoritaires : CH3COO– ; H3O+;
- Espèce
ultra minoritaire : OH–.
► Coefficient de dissociation :
|
Équation bilan |
CH3COOH |
+ H2O |
→ |
CH3COO
– |
+ H3O+ |
|
À, t = 0 s |
n |
Solvant |
|
0 |
0 |
|
Équilibre chimique |
n – n . α |
Excès |
|
n . α |
n . α |
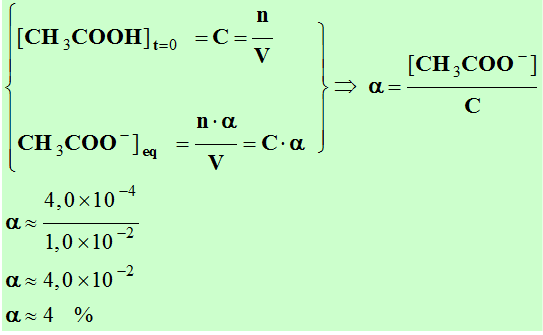
|
α = |
Quantité de matière de molécules dissociées |
|
―——————————————————— |
|
|
Quantité de matière de molécules mises en solution |
► Application 2 :
- On dilue
100 fois une solution d'acide éthanoïque de concentration
C = 1,0
× 10–2 mol / L ;
- Le pH de la solution obtenue est égal à 4,5.
- Calculer le coefficient d'ionisation de l'acide.
► Solution :
-
Inventaire des espèces présentes : CH3COOH
; CH3COO– ; H3O+
; OH–
- Pour
C’ = 1,0
×
10– 4 mol / L, pH
= 4,5.
- On peut
négliger la réaction d'autoprotolyse de l'eau devant la réaction de dissolution
de l'acide éthanoïque.
- Mesure du
pH :
pH = 4,5
- Par
définition :
- pH
= – log [H3O+]
cette relation est équivalente à [H3O+]
= 10– pH mol.L–1
-
[H3O+]
= 10– 4,5 mol.L–1
-
[H3O+]
≈ 3,2
× 10–5 mol / L.
-
produit ionique de l'eau :
- pKe
= 14 à 25 °C
-
[OH –] = 10 pH – pKe mol.L–1
-
[OH–] =
10 4,5
– 14 mol.L–1
-
[OH–] ≈ 3,2
× 10–10 mol.L–1
-
équation d'électroneutralité :
- [H3O+]
= [CH3COO–] + [OH–]
- Or [H3O+]
>> [OH –] (voir
au-dessus )
- [H3O+]
≈ [CH3COO
–] ≈ 3,2
× 10–5 mol / L
-
équation de conservation de la
matière :
- L'acide
éthanoïque dissous, se trouve sous deux formes, soit sous forme de molécule
d'acide éthanoïque, soit sous forme d'ion éthanoate.
-
[CH3COOH]
+ [CH3COO–] = C’
-
[CH3COOH]
= C’ – [CH3COO –]
-
[CH3COOH]
≈ 1,0
× 10–4 –
3,2
× 10–5
-
[CH3COOH]
≈ 6,8
× 10–5 mol / L
- Espèce
majoritaire : CH3COOH;
espèces minoritaires : CH3COO– ; H3O+;
- Espèce
ultra minoritaire : OH–.
- Coefficient d'ionisation :
-
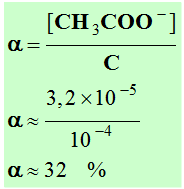
-
la réaction entre l'acide
éthanoïque et l'eau est une réaction rapide mais limitée.
- Une
solution aqueuse d'acide éthanoïque contient les espèces suivantes :
- Espèce
majoritaire : CH3COOH
; espèces minoritaires : :
CH3COO– ; H3O+;
-
Espèce ultra minoritaire : OH–
- On donne
à la solution aqueuse la formule de l'espèce majoritaire :
CH3COOH
-
L'acide éthanoïque est un acide faible.
II- Étude d'une base faible : l'ion éthanoate.
- L'éthanoate de sodium est un solide ionique blanc de formule statistique CH3COONa.
- équation bilan de la réaction de dissolution de l'éthanoate de sodium dans l'eau :
|
|
|
eau |
|
|
|
Équation bilan |
CH3COONa |
→ |
CH3COO
– |
+ Na+ |
- Cette réaction est totale tant que la solution n'est pas saturée ce qui est le cas en terminale car :
1,0
× 10–1 mol / L <
C
< 1,0
× 10–6 mol / L.
2)- Basicité de la solution aqueuse d'éthanoate de sodium.
- Tableau de valeurs :
|
Coefficient de
protonation l'ion
éthanoate |
α % |
0,0079 |
0,025 |
0,078 |
0,23 |
0,49 |
0,61 |
0,63 |
0,67 |
|
Concentration |
C mol / L |
10 –1 |
10 –2 |
10 –3 |
10 –4 |
10 –5 |
10 –6 |
10 –7 |
10 –8 |
|
Éthanoate de sodium |
pH |
8,9 |
8,4 |
7,9 |
7,4 |
7,1 |
8 |
7 |
7 |
|
Soude |
pH |
12.9 |
12 |
11 |
10 |
9 |
8 |
7,2 |
7 |
|
14 + log C |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
- Exploitation du tableau :
- Les solutions d'éthanoate de sodium sont basiques mais moins basiques que les solutions de soude de même concentration.
- La réaction de l'ion éthanoate sur l'eau est très limitée.
- L'ion éthanoate est une base faible.
3)- Composition de la solution aqueuse d'éthanoate de sodium.
► Application 3 :
- Une solution d'éthanoate de sodium de concentration C = 1,0 × 10–2 mol / L a un pH = 8,4.
- Calculer la concentration des différentes espèces présentes et les qualifier.
- Que peut-on dire de la réaction entre l'ion éthanoate et l'eau ?
- Calculer le coefficient de protonation α de l'ion éthanoate.
► Solution :
- Inventaire
des espèces présentes : CH3COOH ; CH3COO
– ; H3O+ ; OH – ;
Na+ et le solvant H2O.
- Pour
C = 1,0
× 10–2 mol / L, pH = 8,4.
-
On peut négliger la réaction
d'autoprotolyse de l'eau devant la réaction entre l'ion éthanoate et l'eau.
-
Équation bilan de la réaction : on met
le signe égal : = car la réaction avec l'eau n'est pas totale, elle est limitée.
|
Équation bilan |
CH3COO
– |
+ H2O |
= |
CH3COOH |
+ OH– |
- Concentration des ions sodium :
- [Na+] = C =
1,0
× 10–2 mol / L
- Mesure du pH : pH =
8,4
- Par définition :
- pH = – log [H3O+]
cette relation est équivalente à [H3O+] = 10
– pH mol.L–1
- [H3O+]
= 10– 8,4 mol.L–1
- [H3O+]
≈ 4,0
× 10–9 mol / L.
-
produit ionique de l'eau :
- pKe = 14 à 25 °C
- [OH–] =
10 pH – pKe mol.L–1
- [OH–] =
10 8,4 – 14 mol.L–1
- [OH–] ≈ 2,5
× 10–6 mol.L–1
-
équation d'électroneutralité :
- [H3O+]
+ [Na+] = [CH3COO –]
+ [OH –] (1)
- Or [H3O+]
<< [OH –] << [Na+] (voir au-dessus )
- On peut négliger la concentration
des ions hydroxyde et des ions hydronium devant la concentration des ions
sodium.
- [Na+] ≈ [CH3COO–] ≈ 1,0
× 10 –2 mol / L
-
équation de conservation de la
matière :
- [CH3COOH] + [CH3COO–] = C
- [CH3COO –]
= C - [CH3COOH] (2)
- En combinant (1) et (2).
- [H3O+]
+ [Na+] ≈ C – [CH3COOH] + [OH–] or [Na+] = C = 1,0
× 10–2 mol
/ L
- [H3O+]
≈ [OH–] – [CH3COOH]
- [CH3COOH]
≈ [OH–] – [H3O+]
- [CH3COOH]
≈ 2,5
× 10–6 – 4,0
× 10–9
- [CH3COOH]
≈ 2,5
× 10–6 mol.L–1
- Coefficient de protonation α :
|
Équation bilan |
CH3COO
– |
+ H2O |
→ |
CH3COOH |
+ OH– |
|
À, t = 0 s |
n |
solvant |
|
0 |
0 |
|
Équilibre
chimique |
n – n . α |
excès |
|
n . α |
n . α |
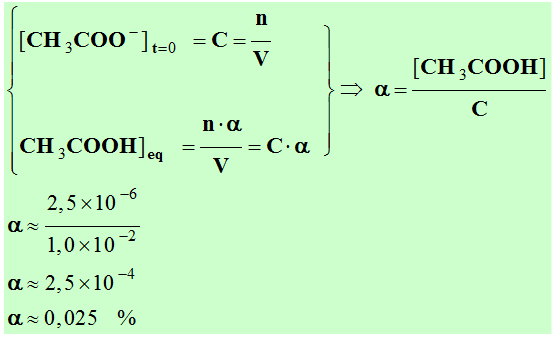
- Espèces majoritaires : CH3COO– ; Na+ ; espèces minoritaires : CH3COOH ;
OH–; espèce ultra minoritaire : H3O+
III- Équilibre chimique de dissociation.
![]() Application 4 :
Application 4 :
- On réalise l'expérience suivante
► Interprétation du phénomène :
- Quelles sont les espèces présentes dans les solutions A et B ?
- Calculer la concentration des différentes espèces dans les deux solutions A et B. Les qualifier.
- Que se passe-t-il au cours de la réaction I ? écrire l'équation bilan de la réaction.
- Que se passe-t-il au cours de la réaction II ? écrire l'équation bilan de la réaction.
- Conséquences.
► Solution :
-
Inventaire des espèces présentes :
- CH3COOH
; CH3COO– ; H3O+
; OH –; Na+; Cl–.
- Les solutions A et B contiennent les mêmes espèces chimiques.
- Concentration des différentes espèces chimiques.
Attention : il faut tenir compte de
l'augmentation du volume de la solution.
-
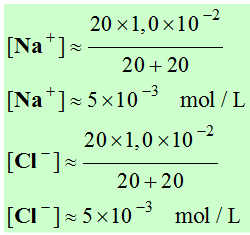
- Mesure du pH : pH = 3,5
- Par définition :
- pH = – log [H3O+]
cette relation est équivalente à [H3O+] = 10– pH mol.L–1
-
[H3O+]
= 10– 3,5 mol.L–1
-
[H3O+]
≈ 3,2
× 10–4 mol / L.
-
produit ionique de l'eau :
- pKe = 14 à 25 °C
-
[OH –] = 10 pH – pKe mol.L–1
-
[OH –] = 10 3,5 – 14 mol.L–1
-
[OH –] ≈ 3,2
× 10–11 mol.L–1
-
équation d'électroneutralité :
-
[H3O+]
+ [Na+] = [CH3COO–]
+ [OH–] + [Cl–] (1)
- Or + [Na+] =
[Cl–] et [H3O+] >> [OH–]
(voir au-dessus )
- On peut négliger la concentration
des ions hydroxyde devant la concentration des ions hydronium.
-
[H3O+]
≈ [CH3COO –] ≈ 3,2
× 10–4 mol
/ L
- équation de conservation de la matière
-
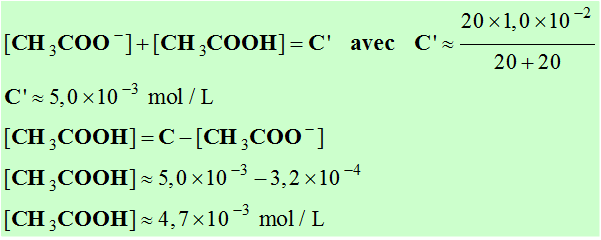
- Qualificatifs :
- Espèces majoritaires : CH3COOH
; CH3COO– ; H3O+
; Na+; Cl–.
- Espèce ultra minoritaire : OH–
- Équation bilan de la réaction I :
- Au cours de la réaction, des ions hydronium ont disparu.
- Les ions sodium et les ions chlorure ne participent pas à la réaction, ce sont des ions spectateurs.
- Les ions hydronium réagissent avec les ions éthanoate :
|
|
|
(2) |
|
|
|
CH3COO– |
+ H3O+
|
→ |
CH3COOH |
+ H2O |
- équation bilan de la réaction II :
- c'est une dilution, elle favorise l'ionisation de l'acide éthanoïque.
- Les ions sodium et les ions chlorure ne participent pas à la réaction, ce sont des ions spectateurs.
|
|
|
(1) |
|
|
|
CH3COOH |
+ H2O
|
→ |
CH3COO– |
+ H3O+
|
- Les réactions (1) et (2) sont inverses l'une de l'autre et se produisent simultanément.
- Elles limitent leurs effets.
- On est en présence d'un équilibre chimique dynamique.
- En conséquence, on écrit :
|
CH3COOH |
+ H2O |
= |
CH3COO
– |
+ H3O+ |
- Cet équilibre existe : quel que soit le pH, quelles que soient les autres espèces présentes dans la solution.
- On peut déplacer l'équilibre dans le sens direct en ajoutant de l'eau.
- On peut déplacer l'équilibre dans le sens inverse si l'on verse des ions hydronium.
1)- L'acide éthanoïque et l'ion éthanoate
|
CH3COOH |
+
H2O |
= |
CH3COO– |
+ H3O+ |
- L'acide
éthanoïque est un acide faible et l'ion éthanoate est une base faible dans l'eau
- L'espèce
CH3COOH
peut libérer un proton : c'est un acide
-
l'espèce
CH3COO– peut capter un proton : c'est une base
- C'est
deux espèces CH3COOH
/ CH3COO– constituent un couple acide / base conjuguée
► Acide :
- Un
acide est une espèce chimique capable de céder au moins un proton
-
AH → H+ + A –
- Un acide est fort en solution
aqueuse si sa réaction avec l'eau est totale :
- AH + H2O
→ H3O+ + A–
- Et pH = – log C si 1,0
× 10– 6 mol / L <
C < 5,0
× 10– 2 mol / L
- Un
acide est faible en solution aqueuse si sa réaction avec l'eau est limitée :
équilibre chimique :
- AH + H2O
= H3O+ + A– et pH
> – log C si 1,0
× 10– 6 mol / L <
C < 5,0
× 10– 2
mol / L
► Base :
- Une base
est une espèce chimique capable de capter au moins un proton
-
H+ + A – →
AH
- Une base
est forte en solution aqueuse si sa réaction avec l'eau est totale :
-
A–
+ H2O
→ OH– + AH
- Et
pH = 14 +
log C si 1,0
× 10– 6 mol / L <
C <
5,0
× 10– 2 mol / L
- Une base
est faible en solution aqueuse si sa réaction avec l'eau est limitée : équilibre
chimique :
-
A–
+ H2O
= OH – + AH
- Et
pH < 14 +
log C si 1,0
× 10– 6 mol / L <
C <
5,0
× 10– 2 mol / L
- Un couple
acide / base est noté : acide / base :
- Schéma
formel : Acide
= base
+ H+
- Exemples
:
-
AH
= H+ +
A–
Couple AH
/ A–
-
B + H+ =
BH+ Couple
BH+/ B
-
l'eau est une base, elle peut
capter un proton :
- H2O
+ H+ = H3O+ Couple H3O+
/ H2O
-
l'eau est un acide, elle peut
céder un proton :
- H2O
= OH – + H+ Couple H2O
/ OH –
- L'eau est l'espèce basique du couple
H3O+ / H2O et l'eau est
l'espèce acide du couple H2O / OH –.
- On dit que l'eau est un amphotère ou ampholyte.
Toute espèce qui est l'acide d'un couple et base d'un autre couple est dite amphotère ou ampholyte.
5)- Mise en solution aqueuse d'un acide ou d'une base.
- Exemple : mise en solution aqueuse de l'acide éthanoïque.
|
CH3COOH |
+ H2O
|
= |
CH3COO– |
+ H3O+
|
- Les couples acide / base qui interviennent sont :
- Couple 1 : CH3COOH
/ CH3COO –
- Couple 2 : H3O+
/ H2O
|
|
|
CH3COOH |
= |
H+ |
+
CH3COO– |
|
; |
|
acide
1 |
|
|
base
1 |
|
|
H2O |
+
H+ |
= |
H3O+ |
|
|
; |
base 2 |
|
|
acide 2 |
|
|
———————————————————————— |
|||||
|
Bilan : |
base 2 |
+
acide 1 |
= |
acide 2 |
+
base 1 |
-
Il y a eu un transfert de proton entre le
couple 1 et le couple 2.
- Une réaction acido-basique est une interaction entre deux couples acide / base. Cette réaction se traduit par un transfert de protons.
6)- Cas des acides forts et des bases fortes.
- Acide fort :
|
HCl |
+ H2O
|
→ |
H3O+ |
+ Cl – |
- L'ion chlorure Cl– est la base conjuguée de HCl (acide fort) c'est une base indifférente, elle ne réagit pas avec l'eau.
-
Dans l'eau la base conjuguée d'un
acide fort est une base indifférente, elle ne réagit pas avec l'eau.
- Base forte :
- L'ion éthanolate
|
C2H5O
– |
+ H2O |
→ |
C2H5OH |
+ OH – |
-
L'éthanol est l'acide conjugué d'une base forte, c'est un acide
indifférent, il ne réagit pas avec l'eau.
- Dans l'eau l'acide conjugué d'une base forte est un acide indifférent, il ne réagit pas avec l'eau.
-
Remarque importante :
- Dans une solution d'acide fort ou de
base forte, le seul équilibre qui intervient et celui entre les ions : H3O+
et OH –
- H3O+
+ OH – = 2 H2O
pKe = 14
- On
dit que l'eau a un effet nivelant.
-
Dans l'eau, il n'existe pas d'acide plus fort que H3O+
et de base plus forte que OH –