|
Chim N°
12 |
|
|
|
|
I- Les
différentes formulations de l’aspirine. |
|
III-
Dosages de l’acide acétylsalicylique. |
I- Les différentes formulations de l’aspirine.
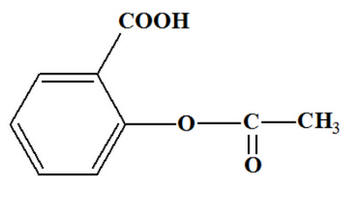
- C’est la forme la plus simple de l’aspirine.
- Ces comprimés sont généralement dosés à 500 mg d’acide acétylsalicylique.
- Ils contiennent un minimum d’additifs :
- De l’amidon,
- Du gel de silice (pour maintenir la poudre agglomérée).
b)- Dissolution de l’aspirine.
- L’un des inconvénients de ce type de comprimé est sa difficulté à se dissoudre dans l’eau.
- De plus il a un goût amer désagréable.
- La solubilité de l’acide acétylsalicylique est d’environ de 3,4 g par litre à 25 °C et à un pH ≈ 2,5.
- La solubilité augmente avec le pH et la température.
![]() Application :
Application :
- Calculer le volume minimal théorique d’eau nécessaire pour dissoudre un comprimé de 500 mg d’aspirine.
- Calculer la concentration totale de la solution saturée en acide acétylsalicylique
- Masse molaire : M = 180 g / mol.
- Volume d’eau nécessaire à la dissolution de l’aspirine :
-

- Concentration de la solution obtenue :
-

- remarque : l’acide acétylsalicylique est faiblement soluble dans l’eau.
- C’est un acide faible : pKA = 3,5.
- En utilisant la relation donnant le pH pour un acide faible en solution aqueuse :
-

c)- Propriétés acides de l’aspirine.
- L’aspirine possède une fonction acide carboxylique.
- C’est un acide faible en solution aqueuse pKA = 3,5 à 25 °C.
- Donner les domaines de prédominance :
- Remarque : l’acide acétylsalicylique est liposoluble.
- Il est lentement soluble dans les graisses.
- Sa base conjuguée ionique est hydrosoluble.
![]() Application :
détermination du taux d’ionisation de l’aspirine.
Application :
détermination du taux d’ionisation de l’aspirine.
- Écrire l’équation bilan de la réaction entre l’acide acétylsalicylique AH et l’eau.
- Donner l’expression littérale de la constante KA, puis celle du pKA.
-

- Déterminer le rapport des concentrations de l’acide acétylsalicylique AH et de l’ion acétylsalicylate A- et le taux d’ionisation :
- Dans l’estomac à pH = 1,
- Dans les cellules stomacales à pH = 7,4.
► Résolution :
-

- taux d’ionisation dans l’estomac pH = 1,0 avec pKA = 3,5 :
- Le taux d’ionisation de l’aspirine est très faible dans l’estomac.
- Taux d’ionisation dans les cellules stomacales : pH = 7,4 avec pKA = 3,5 :
- Le taux d’ionisation dans les cellules stomacales est de 99,9 %.
- Problème : La toxicité de l’aspirine, vis à vis de la muqueuse stomacale, est due à son acidité.
- Le taux d’ionisation de l’aspirine dans l’estomac est faible car le pH ≈ 1.
- La forme moléculaire étant liposoluble, l’aspirine passe à travers la membrane des cellules de la paroi de l’estomac.
- À l’intérieur de la cellule, la molécule d’acide acétylsalicylique s’ionise presque totalement car le pH est voisin de 7,4.
- Les ions acétylsalicylate sont hydrosolubles et s’accumule dans la cellule (Ils ne traversent pas la cellule car pour traverser la cellule, l’espèce doit être liposoluble).
- Cette accumulation entraîne des lésions et même la mort de la cellule.
d)- Une solution à ce problème : l’aspirine entérique.
- On fabrique des comprimés entérosolubles qui se dissolvent dans l’intestin.
- Ces comprimés sont enrobés d’une pellicule insensible à l’acidité du suc gastrique mai qui se dissout dans la deuxième partie du duodénum (pH compris entre 7 et 8).
- Pellicule : acétate de polyvinyle, talc, saccharose, gélatine, gomme arabique, cire d’abeille blanche.
2)- L’acétylsalicylate de Lysine.
a)- La Lysine :
- la Lysine est un acide α-aminé dont le nom dans la nomenclature de l’UICPA est : acide 2,6‑diaminohexanoïque.
- Écrire la formule développée de cette molécule (groupe amino : ― NH2)
- Montrer que cette molécule renferme un carbone asymétrique. Représenter les deux énantiomères.

- Remarque : les deux groupements amino ― NH2, ont un comportement basique, alors que le groupement ― COOH a un comportement acide.
- La lysine peut exister dans l’eau sous 4 formes suivant la valeur du pH de la solution :
- pKA des différents couples :
-

- remarque : LyH porte une charge positive sur le groupe ammonium H3N+― et une charge négative sur le groupe carboxyle ― COO–.
- Cette espèce est globalement neutre.
- C’est un zwitterion ou amphion.
- Domaines de prédominance :
b)- acétylsalicylate de Lysine.
- Échelle des pKA :

- L’acide acétylsalicylique (AH) réagit sur la forme moléculaire de la lysine (LyH) suivant l’équation bilan suivante :
- Le mélange équimolaire d’acide acétylsalicylique et de lysine conduit par une réaction totale à une solution d’acétylsalicylate de lysine.
- Cette solution à un pH voisin de 5,6 qui correspond à la fois au domaine de prédominance de l’ion acétylsalicylate A – et de l’espèce LyH2+.
- L’acétylsalicylate de lysine que l’on note LyH2A est un composé ionique très soluble dans l’eau qui est un solvant polaire.
- Équation simplifiée :
|
|
eau |
|
|
|
|
LyH2A |
→ |
LyH2+ |
+ A – |
|
- L’acidité de la solution obtenue est nettement plus faible que celle de la solution d’aspirine.
![]() Application :
Application :
- Malheureusement, au contact du milieu fortement acide de l’estomac, des réactions se produisent.
- Écrire les équations des réactions qui peuvent se produire lors de l’absorption d’une solution aqueuse d’acétylsalicylate de lysine avec les ions hydronium contenus dans les sécrétions gastriques.
- Calculer les constantes des réactions et conclure.
- Réponses :
- Il se produit deux réactions car les ions majoritaires en présences sont :
- LyH2+ ; A– ; H3O+
- On peut considérer que les ions hydronium sont en excès.


- la réaction (1) est prépondérante devant la réaction (2) car KR1 > KR2.
- Dans l’estomac, l’espèce prépondérante est l’acide acétylsalicylique AH.
a)- L’hydrogénocarbonate de sodium (NaHCO3).
- C’est un composé ionique, en solution aqueuse :
- Domaines de prédominance :
- En milieu acide, les ions hydrogénocarbonate se transforment en dioxyde de carbone.
- La solubilité du dioxyde de carbone dans l’eau à 25 °C est de l’ordre de 0,1 mol / L.
- Comme la limite de solubilité est vite atteinte, on observe un dégagement de dioxyde de carbone (effervescence).
b)- Les comprimés à aspirine effervescente.
- Ils contiennent de l’hydrogénocarbonate de sodium.
- Il se produit la réaction suivante en présence d’acide acétylsalicylique AH.
|
|
 |
- La réaction est fortement déplacée dans le sens (1).
- Le pH de la solution est voisin de 6.
- On observe une effervescence car la limite de solubilité du dioxyde de carbone est vite atteinte.
- La formulation qui associe l’acide acétylsalicylique et l’hydrogénocarbonate de sodium est souvent appelée « aspirine tamponnée ».
- La solution d’aspirine tamponnée reste dans l’estomac à un pH assez élevé.
- L’aspirine se trouve principalement sous forme d’ions acétylsalicylate.
2)- Définition de l’effet tampon.
- Une solution tampon est une solution dont le pH varie faiblement lors de l’addition modérée :
- D’un acide fort,
- D’une base forte,
- Ou par une dilution modérée.
- Une telle solution contient un acide faible et sa base conjuguée en concentrations voisines.
- Le pH d’une telle solution est voisin du pKA du couple acide / base considéré.
3)- Fabrication de solutions tampons.
![]() Application :
Application :
- Comment préparer un litre d’une solution tampon avec le couple acide éthanoïque – ion éthanoate de pH ≈ 5 et
de concentration totale en acide éthanoïque et ion éthanoate de 0,10 mol / L, à partir :
- D’une solution d’acide éthanoïque (CA = 1,00 mol / L) et d’une solution éthanoate de sodium (CB = 1,00 mol / L),
- D’une solution d’acide éthanoïque (CA = 1,00 mol / L) et d’une solution de soude (C’B = 1,00 mol / L),
- D’une solution d’éthanoate de sodium (CB = 1,00 mol / L) et d’acide chlorhydrique (C’A = 1,00 mol / L).
- On donne pKA ≈ 4,8 pour le couple acide éthanoïque / ion éthanoate.
►Réponses :
- Pour des raisons de commodité, le couple acide éthanoïque / ion éthanoate est noté :
- AH / A –.
- Travail préparatoire :
- préparation de la solution à partir d’un mélange de l’acide faible et de sa base conjuguée :
- On mélange un volume VA d’acide faible avec un mélange VB de base conjuguée.
- On veut que la solution finale ait une concentration C = 0,1 mol / L, pour ce faire, on prépare un volume de 100 mL de solution que l’on dilue d’un facteur 10.
- On obtient ainsi 1,0 L de solution.
- préparation de la solution à partir de l’acide éthanoïque (acide faible) et de la soude (base forte).
- On fait réagir l’acide faible et la base forte et on se place au voisinage de la demi-équivalence ( pH ≈ pKA ≈ 4,8 ici, on veut que pH ≈ 5)
- Préparation de la solution à partir de l’ion éthanoate (base faible) et de l’acide chlorhydrique (acide fort).
III- Dosages de l’acide acétylsalicylique.
1)- Action de la soude sur l’acide acétylsalicylique.
![]() Quelles sont les réactions possibles sur
l’aspirine lorsque l’on fait agir une base forte comme la soude ?
Quelles sont les réactions possibles sur
l’aspirine lorsque l’on fait agir une base forte comme la soude ?
a)- Réaction acide – base.
- On peut utiliser cette réaction pour doser l’acide acétylsalicylique car la réaction est totale et rapide.


b)- réaction de saponification.
- Il se produit une réaction de saponification entre la fonction ester et les ions hydroxyde.
- Cette réaction est totale mais elle est très lente à la température de 25 °C.
- Il faut chauffer pour accélérer la réaction.
- Équation bilan de la réaction :
- Aux températures usuelles, la réaction de saponification n’a pas le temps de se faire.
- Le dosage de l’aspirine par la soude revient à un dosage acide faible (pKA ≈ 3,5) base forte.
- On peut réaliser un dosage pH-métrique ou un dosage colorimétrique (phénolphtaléine).
3)- Dosage indirect ou « en retour ».
- Le dosage en retour consiste :
- À faire réagir l’acide acétylsalicylique à doser avec un excès connu de soude jusqu’à saponification complète de la fonction ester,
- puis à doser la soude restante par une solution d’acide chlorhydrique.
- On en déduit le titre ou la concentration de l’acide acétylsalicylique.
- Remarque :

- Il y a trois réactions en compétition qui se produisent simultanément.

- La réaction (1) est prépondérante devant les deux autres.
- Si l’on fait un dosage pH-métrique, la première partie de la courbe correspond au dosage base forte - acide fort et
- la deuxième partie de la courbe correspond à un dosage base faible - acide fort.
- Remarque :
- Si l' on effectue un dosage colorimétrique, on utilise la phénolphtaléine au lieu du B.B.T comme indicateur coloré.
- Lors d'un dosage acide fort base forte, le pH à l'équivalence est égal à 7, mais ici,
- il faut éviter que les ions hydronium réagissent avec les bases faibles présentent dans la solution : les ions éthanoate et les ions acétylsalicylate.
|
|
|
|















