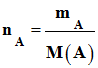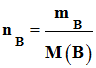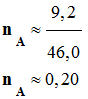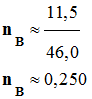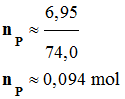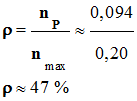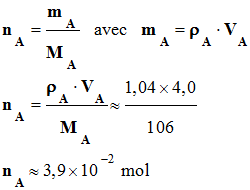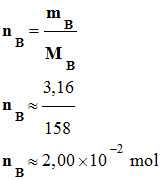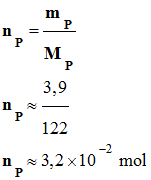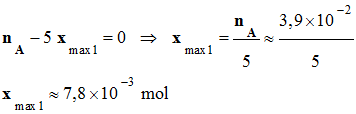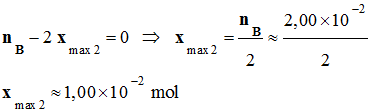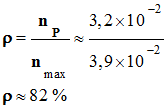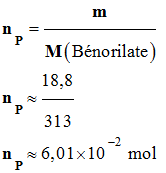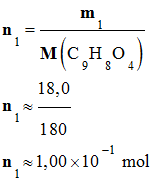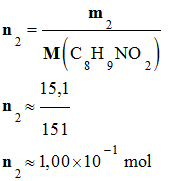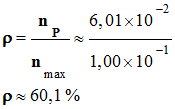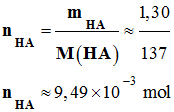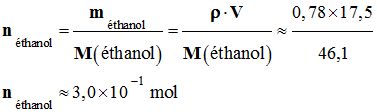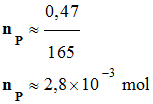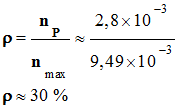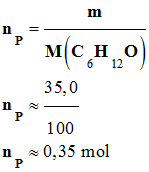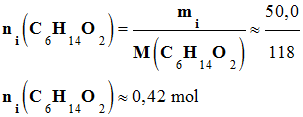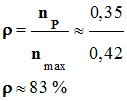|
Chap. N° 19 |
Stratégie d'une synthèse et sélectivité en chimie organique. Exercices. |
|
|
|
I- Exercice 5 page 506 : analyser un protocole : synthèse d’un
liquide.
|
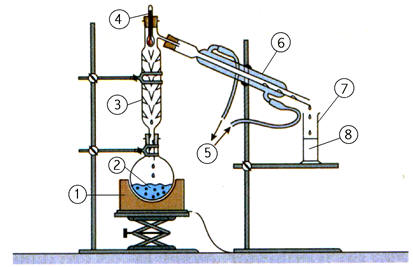
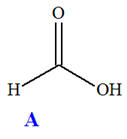
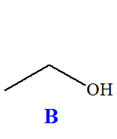
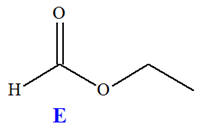
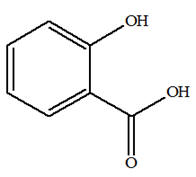
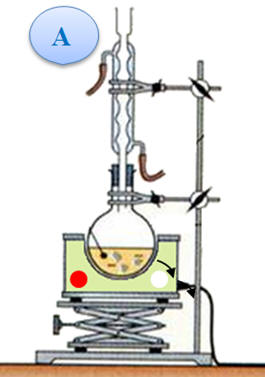
On réalise la synthèse d’un ester à l’odeur de rhum, en faisant réagir, en présence de quelques gouttes d’acide sulfurique (corrosif), l’acide méthanoïque A (mA = 9,2 g) et l’éthanol B (mB = 11,5 g). Le montage expérimental est un montage à
distillation fractionnée. Une fois la distillation terminée, on introduit dans le distillat une spatule de sulfate d’ammonium anhydre et on agite vigoureusement. Après filtration, on obtient une masse finale mE = 6,95 g d’ester E .
1)-
Quelles sont les précautions expérimentales à
prendre lors de la réalisation de cette synthèse ? 2)-
Quel est le rôle de l’acide sulfurique ? 3)-
Que contient le distillat ? Justifier. 4)-
Quel est le rôle du sulfate de sodium anhydre ? 5)-
Comment peut-on facilement identifier le produit de
synthèse sans réaliser d’étape supplémentaire ? 6)-
Calculer le rendement de la réaction.
|
|
1)-
Précautions expérimentales à prendre lors de la
réalisation de cette synthèse ;
-
Il faut porter la
blouse, les gants et les lunettes. 2)-
Rôle de l’acide sulfurique : - L’acide sulfurique est un catalyseur de la réaction d’estérification.
- Il permet d’accélérer cette réaction qui est lente
même à température élevée. 3)-
Étude du distillat :
- Au cours de la distillation fractionnée, les réactifs et les produits se vaporisent
et montent dans la colonne à
distiller.
- Au cours de
l'ascension, le mélange s'enrichi en corps le plus
volatil (ici l'ester).
- En tête de colonne,
on obtient le corps le plus volatil pratiquement
pur.
- Le distillat est
ensuite condensé grâce au réfrigérant.
-
Le distillat est
l’ester E qui est pratiquement pur. 4)-
Rôle du
sulfate de sodium anhydre : - Le sulfate de de sodium anhydre est un desséchant.
- Il permet
d’éliminer les traces d’eau. 5)-
Identification rapide du produit de synthèse sans
réaliser d’étape supplémentaire : - Le thermomètre placé en tête de colonne permet de contrôler la température d’ébullition du solvant. - Lorsque cette température est proche de 54,3 ° C, c’est l’ester qui est extrait. - Tant que la température reste constante à cette valeur, c’est l’ester qui est distillée. - Lorsque la distillation de l’ester est terminée, la température affichée par le thermomètre augmente.
- Il faut arrêter la distillation. 6)-
Rendement de la réaction. - Le rendement théorique est proche de 1, car on extrait l'ester au fur et à mesure qu'il se forme. - La réaction d’estérification est un équilibre chimique.
- Mais
ici, on déplace l'équilibre dans le sens de
l'estérification.
-
Tableau d’avancement
de la réaction :
-
L’alcool B,
l’éthanol, est en excès.
-
C’est l’acide A,
l’acide méthanoïque, qui limite la réaction : xmax
= nA
≈ 0,20 mol
-
La quantité maximale
d’ester attendue :
nmax
= xmax ≈ 0,20 mol
-
Quantité de matière
d’ester effectivement obtenue :
-
- On appelle rendement, noté ρ, de la synthèse, le quotient de la quantité de produit P effectivement obtenue nP
par la quantité maximale
attendue nmax :
-
- Le rendement est faible.
- La distillation de l’ester n’est pas
terminée.
|
II- Exercice 6 page 506 : analyser un protocole : synthèse d’un
solide.
|
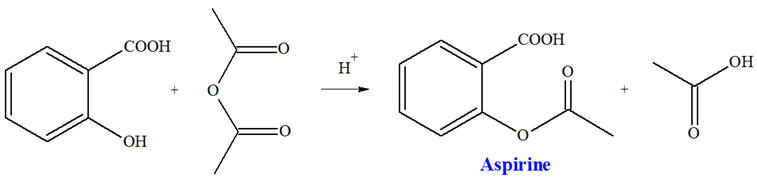
Le texte ci-dessous est extrait
du protocole opératoire de la synthèse de
l’aspirine : « Dans un ballon équipé d’un agitateur magnétique et d’un réfrigérant à boules, introduire : 3,5 g d’acide salicylique, 5 mL d’anhydride éthanoïque et 10 gouttes d’acide
phosphorique concentré. Chauffer vers 70 ° C durant 20 minutes en maintenant l’agitation. Laisser refroidir. Ajouter lentement, tout en agitant vigoureusement, 50 mL d’eau glacée. Continuer l’agitation 15 minutes toue en refroidissant le ballon dans un bain d’eau glacée. Un solide blanc se
forme. » 1)-
Pour quelle(s) raison(s) chauffe-t-on le milieu
réactionnel ? 2)-
Quel est le rôle de l’acide phosphorique ? 3)-
Pour quelle(s) raison(s) refroidit-on une fois la
synthèse terminée ? 4)-
Proposer une technique permettant d’isoler
l’aspirine. 5)-
Proposer une technique permettant de vérifier la
pureté du solide obtenu.
|
|
1)- On chauffe le milieu réactionnel :
-
Le chauffage permet
d’accélérer la réaction et de rendre le milieu
réactionnel plus homogène. 2)-
Rôle de l’acide phosphorique :
-
L’acide phosphorique
apporte les ions hydrogène H+ qui
catalysent la réaction de formation de l’aspirine. 3)-
On refroidit le milieu réactionnel :
-
Cela permet de
démonter le dispositif expérimental sans risque de
brûlures.
-
Le fait de refroidir
le milieu réactionnel permet de précipiter
l’aspirine. 4)-
Technique permettant d’isoler l’aspirine :
-
Pour isoler
l’aspirine, on réaliser une filtration sous pression
réduite.
5)-
Technique permettant de vérifier la pureté du solide
obtenu :
-
On mesure de la
température de fusion du produit obtenu : Banc
Kofler
-
On peut réaliser une
C.C.M. - Le chromatogramme permet de vérifier si l’aspirine préparée est pure et si on a bien éliminé l’anhydride éthanoïque en excès e
t l’acide éthanoïque formé au cours de la
réaction.
|
III- Exercice 8 page 507 : savoir filtrer sous pression réduite.
|
Cet extrait porte sur l’étape de filtration
sous pression réduite permettant d’isoler un produit
solide d’un mélange réactionnel.
-
Expliquer l’intérêt
des six consignes ci-dessus.
|
|
► La fiole à vide doit
être fixée : - Une pince fixée à un support permet de maintenir la fiole à vide. - Ainsi, la fiole à vide ne peut pas se renverser et on a les deux mains libres pour effectuer la manipulation
- Souvent, il faut appuyer sur le filtre Büchner pour
avoir une meilleure aspiration.
► Le papier-filtre doit
être préalablement humidifié : - On humidifie le papier filtre pour assurer un contact parfait entre le filtre Büchner et le papier filtre. - Le papier filtre adhère mieux à la partie en porcelaine qui permet l’aspiration. - Ainsi, lorsque l’on verse le mélange réactionnel, la partie liquide est aspirée et passe à travers le papier filtre et non sur le côté. - La partie solide se retrouve sur le papier filtre.
- On ne perd pas de solide.
► L’addition du contenu
du ballon doit être progressive :
-
On ne doit pas trop
remplir le filtre Büchner pour avoir une meilleure
aspiration et pour ne pas perdre du mélange
réactionnel par débordement.
-
D’autre part, s’il
n’y a pas trop de produit dans le filtre
Büchner, le papier-filtre reste bien en place et on
ne perd pas de produit.
► Le liquide de rinçage
doit être glacé et introduit en petite quantité :
-
On doit utiliser du
liquide de rinçage glacé pour éviter la dissolution
du produit.
-
Il faut
travailler avec de petites quantités pour éviter les
pertes de produit.
► L’aspiration doit
être coupée lors de l’étape de rinçage. - Si on veut rincer de façon efficace, le liquide de rinçage doit s’écouler lentement.
- Il faut donc couper l’aspiration.
- Une fois le rinçage
terminé, on peut remettre l’aspiration pour sécher
plus rapidement le produit solide obtenu.
► Il ne doit plus
rester de solide sur le papier-filtre une fois la
collecte terminée : - On doit récupérer le solide avec une spatule.
-
On frotte délicatement le
papier filtre avec la partie plate de la spatule
sans le trouer et on récupère le solide dans un verre de
montre.
|
IV- Exercice 11 page 507 : étudier la sélectivité d’une réaction.
|
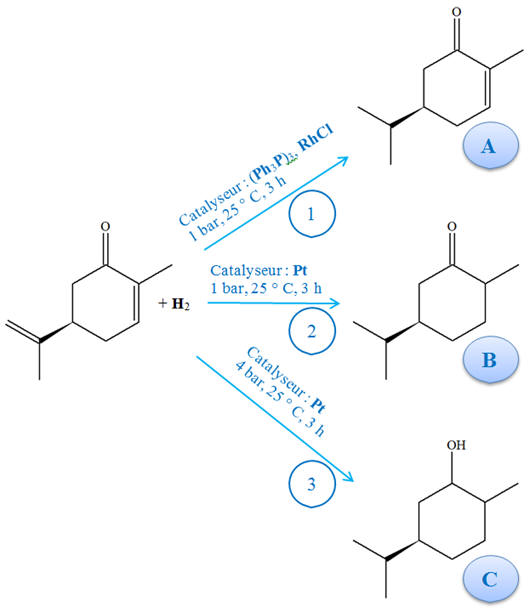
On réalise l’hydrogénation de
la carvone selon trois conditions opératoires
différentes (1), (2) et (3) résumées sur le schéma
ci-dessous. 1)-
Identifier les groupes caractéristiques de la
carvone et des produits. 2)-
Les réactions (1), (2) et (3) sont-elles
sélectives ? 3)-
Un catalyseur est souvent utilisé pour accélérer une
réaction. Quel autre rôle peut-il jouer ? 4)- Des facteurs, autre que la nature des réactifs, peuvent faire qu’une réaction est sélective. Quel
facteur est mis en évidence dans les réactions (2)
et (3) ?
|
|
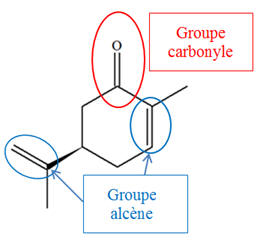
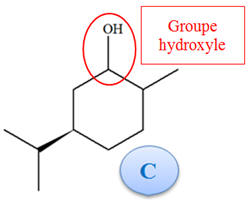
1)-
Groupes caractéristiques de la carvone et des
produits.
-
La carvone possède :
-
Un groupe carbonyle
(fonction cétone)
-
Deux groupes alcène
(Fonction alcène).
-
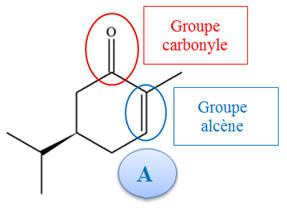
Pour le produit A :
-
Un groupe carbonyle
(fonction cétone)
-
Un groupe alcène
(Fonction alcène).
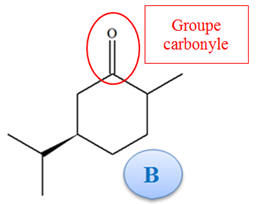
-
Pour le produit B :
-
Un groupe carbonyle
(fonction cétone)
-
Pour le produit C :
-
Un groupe hydroxyle
(fonction alcool)
2)-
Les réactions (1), (2) et (3) et sélectivité :
-
La réaction (1) est
sélective car seul l’un
des groupes alcènes est concerné par la
réaction.
-
La réaction (2) est
sélective car seuls les groupes alcène sont
concernés par la réaction.
-
La réaction (3) n’est
pas sélective car les groupes alcène et le groupe
carbonyle sont concernés par la réaction. 3)-
Autre rôle d’un catalyseur : - Un catalyseur peut intervenir sur la sélectivité d’une réaction chimique.
- Il peut permettre de choisir le groupe
caractéristique qui participe à la réaction. - Un catalyseur est sélectif si, à partir d’un système initial susceptible d’évoluer selon plusieurs réactions spontanées,
il accélère préférentiellement l’une
d’elles. 4)-
Facteur est mis en évidence dans les réactions (2)
et (3) : - Pour les réactions (2) et (3), le catalyseur utilisé est le platine Pt.
- La température est la même, on change la
pression du mélange réactionnel.
-
Lorsque la pression
est élevée, la réaction perd sa sélectivité.
|
V- .
Exercice 12 page 508 : rendement d’une
réaction d’oxydation.
|
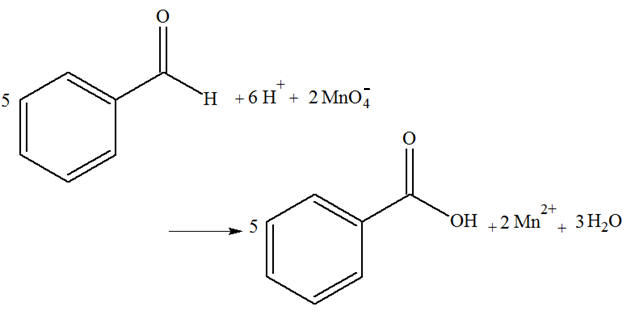
On souhaite réaliser l’oxydation d’un volume VA = 4,0 mL de benzaldéhyde en acide benzoïque. Pour cela, on utilise une masse mB = 3,16 g de permanganate de potassium, KMnO4
(s), comme oxydant en présence d’un excès d’acide
sulfurique.
-
Données : masse
volumique du benzaldéhyde : ρA =
1,04 g . mL–1.
-
Masse molaire du
benzaldéhyde : MA = 106 g . mol–1
-
Masse molaire du
permanganate de potassium : MB =
158 g . mol–1
-
Masse molaire de
l’acide benzoïque : MP = 122 g .
mol–1 Après traitement du milieu
réactionnel, on obtient 3,9 g d’un composé brut
solide. 1)-
Calculer les quantités initiales de benzaldéhyde et
de permanganate de potassium. 2)-
Calculer le rendement de la réaction. 3)-
Proposer une méthode permettant de contrôler la
pureté du produit obtenu et une méthode qui permet
de le purifier, si nécessaire. 4)-
Comment peut-on s’assurer, à l’aide d’un spectre
IR, que la réaction a bien eu lieu ? |
|
1)- Quantités initiales de benzaldéhyde nA et de permanganate de potassium nB .
-
Quantité de matière
initiale de benzaldéhyde nA
-
-
Quantité de matière
initiale de permanganate de potassium nB :
-
2)-
Rendement de la réaction :
-
On appelle rendement,
noté ρ, de la synthèse, le quotient de la
quantité de produit P effectivement obtenue
nP par la quantité maximale
attendue nmax :
-
- On obtient 3,9 g d’un composé brut solide.
- On peut calculer la quantité de
produit P effectivement obtenue nP.
-
La grandeur nP
représente la quantité de matière d’acide benzoïque
obtenue.
-
-
Maintenant, il faut
déterminer la quantité de matière maximale d’acide
benzoïque attendue nmax :
-
On va utiliser le
tableau d’avancement :
-
On note A le
benzaldéhyde et P l’acide benzoïque.
-
Détermination de
l’avancement maximal :
-
Hypothèse 1 :
-
On considère que
A, le benzaldéhyde,
est le réactif limitant :
-
-
Hypothèse 2 :
-
On considère que B, le
permanganate de potassium, est le réactif limitant :
-
-
L’avancement maximal
xmax
est égal à la plus petite des deux valeurs :
-
xmax
= xmax1
≈ 7,8
x 10–3 mol <
xmax2
-
On tire du tableau
d’avancement :
-
nmax
= 5 xmax
= 5 xmax1
≈ 3,9
x 10–2 mol
-
Rendement de la
réaction :
-
3)-
Contrôle de la pureté du produit obtenu et
méthode qui permet de le purifier.
-
On mesure de la
température de fusion du produit obtenu : Banc
Kofler
-
On peut réaliser une
C.C.M.
-
Pour purifier le
produit obtenu, on peut effectuer une
recristallisation. 4)-
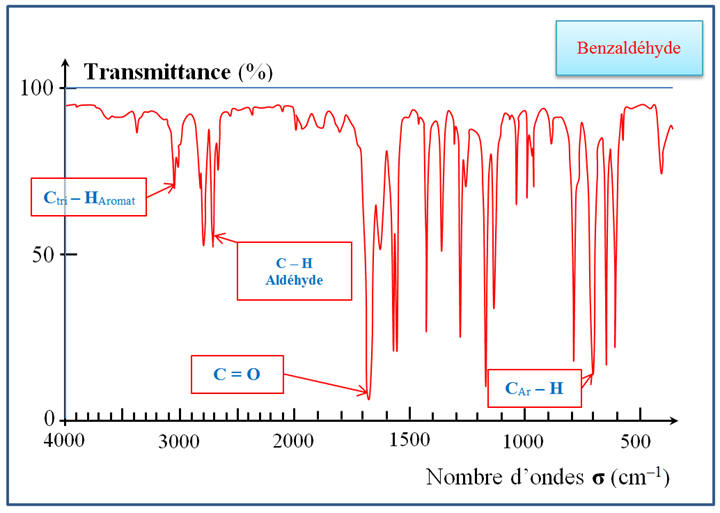
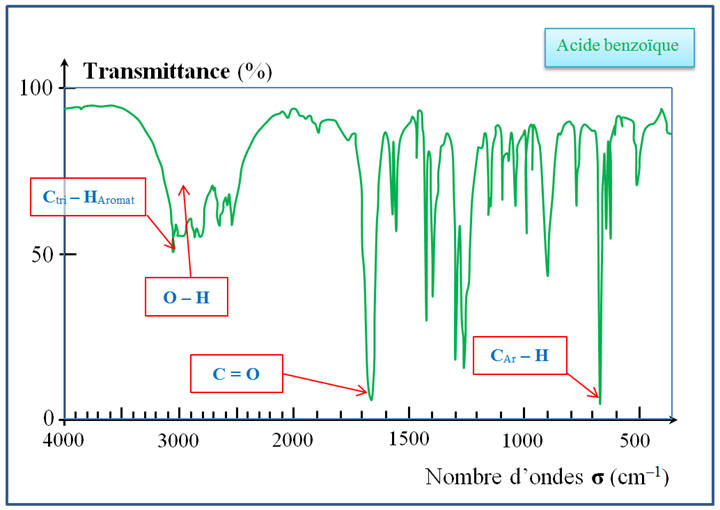
Étude des spectres
IR :
-
Au cours de la
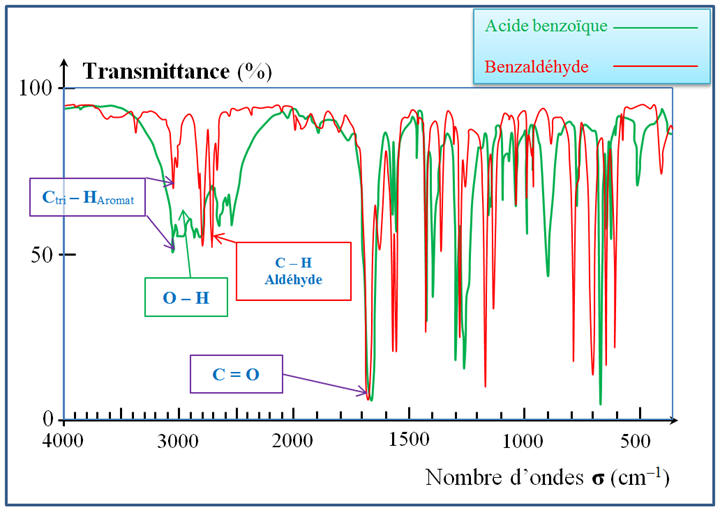
réaction, il y disparition d’une liaison C – H
de la fonction aldéhyde et formation d’une liaison
– OH de la fonction acide carboxylique.
-
Bande d’absorption de
la liaison C – H de la fonction aldéhyde :
- Après réaction, le spectre IR du produit obtenu doit posséder une bande d’absorption caractéristique du groupe – OH de la fonction acide carboxylique
et aucune
bande d’absorption caractéristique du groupe
caractéristique C – H de la fonction
aldéhyde.
-
Bande d’absorption de
la liaison
–
O
–
HAcide
carb de la fonction acide carboxylique
:
-
La bande d’absorption
pour la liaison
C = O ne
change pratiquement pas :
-
Spectre IR du
benzaldéhyde :
-
Spectre IR de
l’acide benzoïque :
-
Superposition des
deux spectres IR :
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
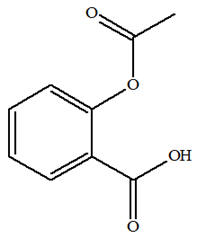
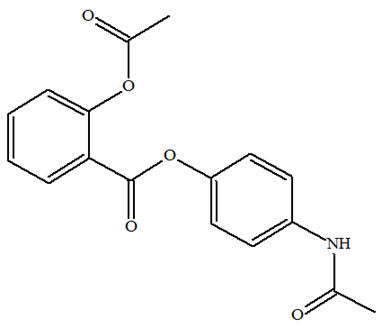
VI- Exercice 13 page 508 : Un di-antalgique, le Salipran®.
|
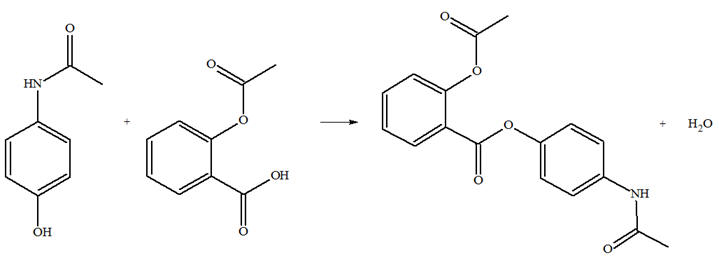
Le Salipran® est un médicament di-antalgique utilisé notamment contre la douleur. Le principe actif en est le bénorilate. C’est le
seul produit organique obtenu lors de la réaction
entre l’aspirine et le paracétamol.
-
Données :
1)-
Reconnaissance des fonctions. a)-
Recopier les formules des
réactifs et du produit, entourer et nommer leurs
caractéristiques. b)-
Écrire l’équation de la
réaction de synthèse du bénorilate. Cette réaction
est-elle sélective ? 2)-
Mode opératoire de la synthèse du bénorilate.
(mélange à 50 % en volume d’eau et d’éthanol), on introduit m1 = 18,0 g d’aspirine, m2 = 15,1 g de paracétamol et
on
ajoute quelques gouttes d’acide sulfurique
concentré. - Après réaction, extraction, purification et séchage,
-
On obtient une
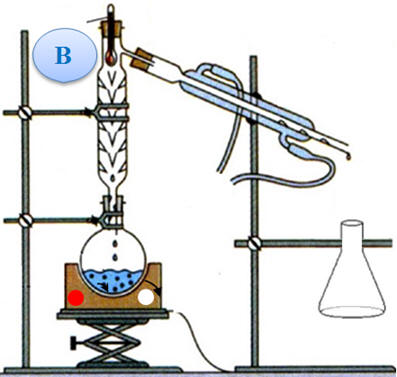
masse m = 18,8 g de bénorilate solide. a)- Parmi les deux schémas fournis ci-dessous, recopier et annoter le montage correspondant à un chauffage à reflux. Indiquer le
sens de circulation de l’eau.
b)-
Quand utilise-t-on le
deuxième montage ? c)-
Pourquoi faut-il chauffer ?
Pourquoi à reflux ? d)-
Quelle méthode utilise-t-on
pour isoler le bénorilate ? e)-
Quelle méthode peut-on
utiliser pour le purifier ? f)-
Comment sèche-t-on le solide
obtenu ? g)-
Calculer le rendement de la
synthèse. 3)-
Assimilation par l’organisme du bénorilate. Après ingestion du comprimé de
Salipran®, le bénorilate subit une réaction inverse
de celle de la synthèse. a)-
Quelles sont les deux
molécules aux propriétés antalgiques alors
obtenues ? b)-
Pourquoi le bénorilate
est-il un « di-antalgique » ?
|
|
1)-
Reconnaissance des fonctions. a)-
Formules des réactifs et du
produit.
-
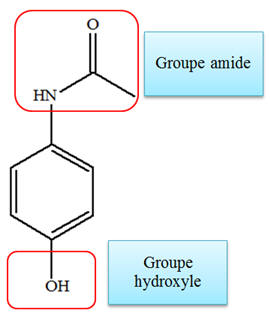
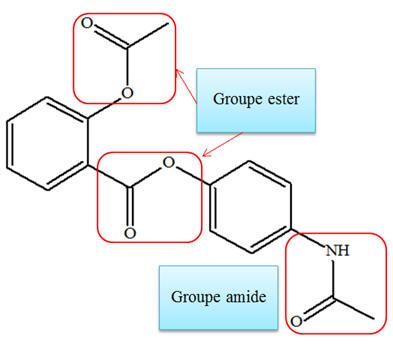
Le
paracétamol possède un groupe amide et un groupe
hydroxyle.
-
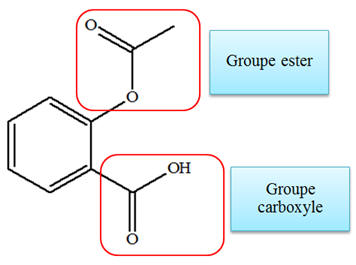
L’aspirine possède un
groupe ester et un groupe carboxyle.
-
Le bénorilate possède
deux groupes ester et un groupe amide.
b)-
Équation de la réaction de
synthèse du bénorilate : - La synthèse du bénorilate est une réaction sélective. - Le groupe hydroxyle du paracétamol réagit avec le groupe carboxyle de l’aspirine.
- Les fonctions amide et
ester de ces deux réactifs ne sont pas concernées
par cette synthèse. 2)-
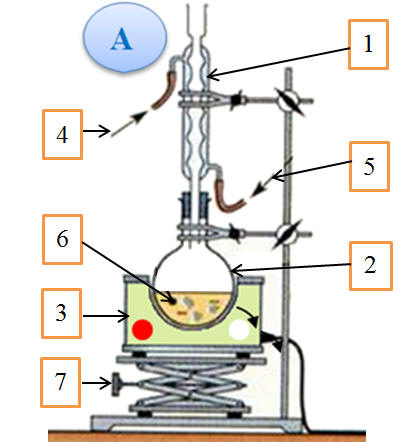
Mode opératoire de la synthèse du bénorilate. a)-
Chauffage à reflux :
-
Schéma légendé :
b)- Le deuxième montage :
-
Distillation
fractionnée : - On utilise ce montage lorsque l’on veut séparer des espèces liquides miscibles qui possèdent des températures d’ébullition différentes.
- On l’utilise aussi pour
purifier des espèces chimiques liquides. c)-
Chauffage et montage à
reflux : - On chauffe pour accélérer la réaction qui est lente à température ambiante.
- On chauffe aussi pour rendre le milieu
réactionnel plus homogène.
-
Le chauffage à reflux
permet de chauffer tout en évitant les pertes par
évaporation. - Ce montage permet de maintenir le milieu réactionnel à une température constante,
en l'occurrence pratiquement la
température d'ébullition du solvant.
-
Les vapeurs sont
condensées dans le réfrigérant et retournent à
l'état liquide dans le ballon.
-
Les réactifs et les
produits restent dans le milieu réactionnel.
-
Il permet d’accélérer
la réaction sans perte de matière. d)-
Isolement du bénorilate ;
-
On filtre le mélange
réactionnel sous pression réduite.
e)-
Purification du bénorilate.
-
Pur purifier le
bénorilate, on réalise une recristallisation. f)-
Séchage du bénorilate :
-
On utilise une étuve
pour effectuer le séchage du bénorilate. g)-
Rendement de la synthèse :
-
Données :
-
On utilise :
-
Une masse m1
= 18,0 g d’aspirine,
-
Une masse m2
= 15,1 g de paracétamol
-
Et on obtient
-
Une masse m = 18,8
g de bénorilate solide
-
Définition du
rendement : - On appelle rendement, noté ρ, de la synthèse, le quotient de la quantité de produit P effectivement obtenue nP
par la quantité maximale
attendue nmax :
-
-
On peut calculer la
quantité de produit P effectivement obtenue
nP.
-
-
La grandeur nP
représente la quantité de matière de bénorilate
obtenue
-
Maintenant, il faut
déterminer la quantité de matière maximale de
bénorilate attendue nmax :
-
Quantité de matière
de d’aspirine :
-
-
Quantité de matière
de paracétamol :
-
-
On va utiliser le
tableau d’avancement :
-
On est en présence
d’un mélange stœchiométrique.
-
xmax
= n1 = n2 = 1,00
x 10–1 mol
-
nmax
= xmax = 1,00
x 10–1 mol
-
Rendement :
-
3)-
Assimilation par l’organisme du bénorilate. a)-
Les deux molécules aux
propriétés antalgiques alors obtenues : - La synthèse du bénorilate est une réaction d’estérification.
- L’inverse de cette réaction est l’hydrolyse de
l’ester.
-
Lors de l’hydrolyse,
on obtient le paracétamol et l’aspirine. b)-
Le bénorilate est un
« di-antalgique » :
-
Le bénorilate est un
« di-antalgique » car lors de l’hydrolyse, il libère
deux molécules antalgiques, le paracétamol et
l’aspirine. |
|||||||||||||||||||||||||||||||||||||||||||||||
VII- Exercice 14 page 509 : Synthèse d’un médicament : la benzocaïne.
|
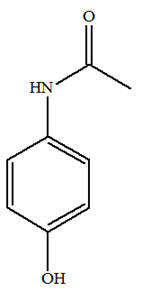
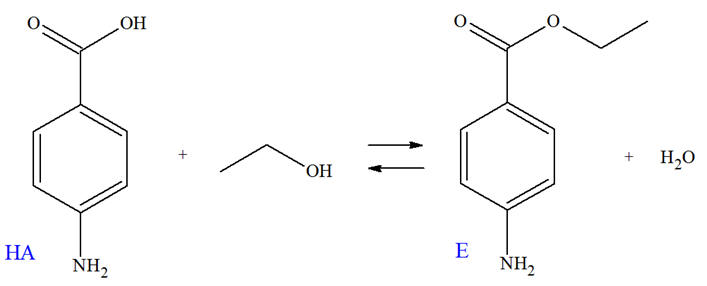
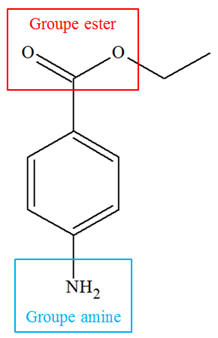
La benzocaïne (4-aminobenzoate d’éthyle), notée E, est le principe actif de médicaments pouvant soulager la douleur. Par exemple, il est présent dans une pommade qui traite les symptômes de lésions cutanées (brûlures superficielles, érythèmes solaires). On se propose de préparer la benzocaïne en faisant réagir de l’acide 4-aminobenzoïque, noté
HA, et
un composé liquide à température ambiante,
l’éthanol. L’équation de la réaction est :
une solution ayant un pH voisin de 9. - Un dégagement gazeux se produit et un précipité de sulfate de sodium apparaît.
Filtrer le
mélange pour éliminer le précipité.
- Agiter l’ampoule et laisser décanter.
-
Récupérer la phase organique.
-
Laisser décanter
et joindre la phase organique à celle déjà présente
dans l'erlenmeyer.
-
Données :
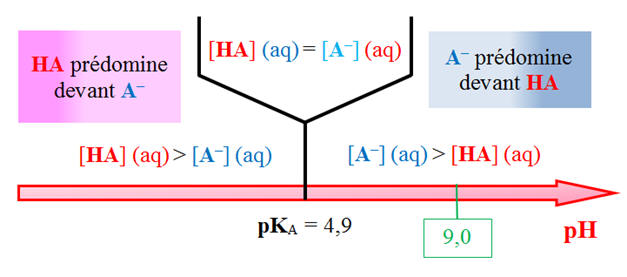
- Valeur de pKA
à 25 ° C : pKA (HA (aq)/
A– (aq)) = 4,9
-
Couples acide /
base : HCO3– (aq) /
CO32– (aq) et CO2,
H2O (aq)/ HCO3–
(aq)
-
Masses volumiques :
eau : 1,0 g . cm–3 ; éther : 0,79 g . cm–3 ;
éthanol : 0,78 g . cm–3
-
Masses molaires :
M (HA) = 137 g . mol–1 : M
(CH3CH2OH)
= 46,1 g . mol–1
-
M (E) =
165 g . mol–1
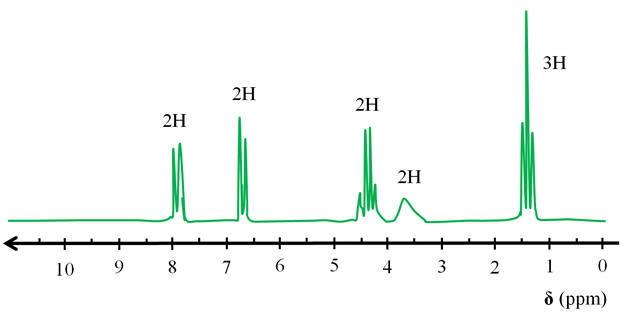
- Pour analyser le produit synthétisé, on réalise un spectre de RMN.
-
Ce spectre est reproduit ci-dessous. 1)-
À propos de la réaction d’estérification. a)-
Recopier les formules de
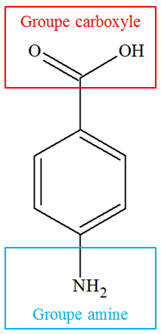
HA et de E, puis entourer et nommer les
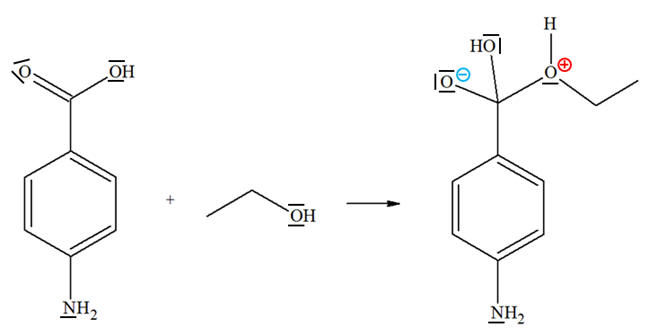
groupes fonctionnels. b)-
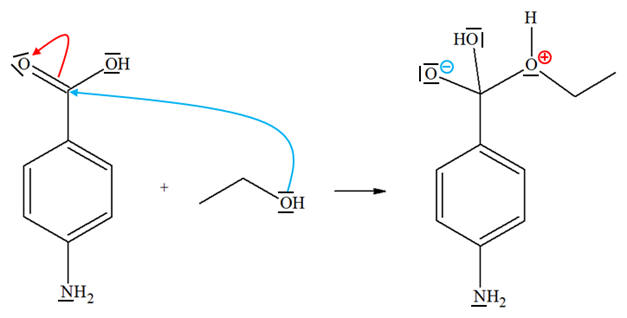
Recopier l’équation
ci-dessous, représenter, par des flèches courbes, le
mouvement des doublets d’électrons permettant
d’expliquer la formation de la liaison C – O. c)- La réaction est-elle
sélective ? Justifier 2)-
À propos de l’étape 1. a)- Quel rôle les ions oxonium
apportés par l’acide sulfurique peuvent-ils jouer ? b)- Quel est l’intérêt du
chauffage à reflux ? 3)-
À propos de l’étape 2. a)- Dessiner le diagramme de prédominance du couple HA (aq)/ A– (aq). Quelle espèce prédomine dans le bécher après
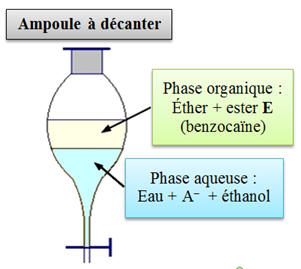
ajout de la solution de carbonate de sodium. b)- En déduire dans quelle phase se trouve cette espèce dans l’ampoule à décanter. Préciser, sur le schéma, les différentes phases et
indiquer leur composition. c)- Déterminer la
masse théorique de
benzocaïne que l’on
peut
obtenir lors de cette synthèse. d)-
Une synthèse a
donné une masse de produit égale à
0,47
g. Calculer son rendement e)- Montrer que le spectre de
RMN obtenu est bien celui de la benzocaïne.
|
|
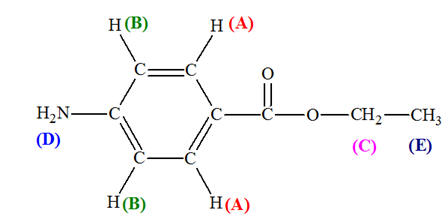
1)-
À propos de la réaction d’estérification. a)- Les formules de HA et de E, puis entourage et nom des groupes fonctionnels.
-
Formule brute de
HA : C7H7NO2
-
Groupes
fonctionnels :
-
Formule brute de la
benzocaïne (4-aminobenzoate d’éthyle), notée E :
-
C9H11NO2
-
Groupes
fonctionnels :
b)- Mouvement des doublets d’électrons permettant d’expliquer la formation de
la liaison C – O.
-
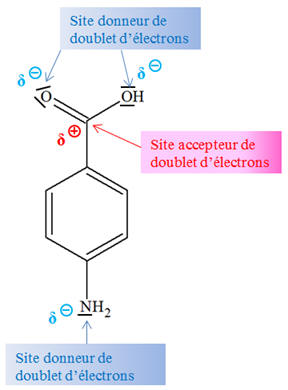
La molécule d’acide
4-aminobenzoïque : - L’atome de carbone du groupe carboxyle est un site accepteur de doublet d’électrons.
- Il porte une charge partielle positive
car le carbone est moins électronégatif que l’atome
d’oxygène.
-
L’atome d’azote du
groupe amine et les atomes d’oxygène du groupe
carboxyle
sont des sites donneurs de doublet
d’électrons.
-
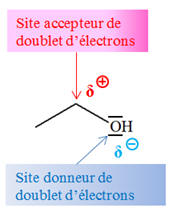
La molécule
d’éthanol : - L’atome de carbone qui porte le groupe hydroxyle est un site accepteur de doublet d’électrons.
- Il porte une charge
partielle positive car l'atome de carbone est moins
électronégatif que l’atome d’oxygène.
-
l’atome d’oxygène du
groupe hydroxyde est un site donneur de doublet
d’électrons.
-
Mécanisme de la
réaction : c)- La réaction sélective et
justification : - L’acide 4-aminobenzoïque, noté HA, est un composé polyfonctionnel.
- Il possède un groupe carboxyle et
un groupe amine.
-
Une réaction est
sélective lorsque parmi plusieurs fonctions d’une
même molécule, l’une d’elle réagit
préférentiellement avec le réactif considéré.
-
Dans le cas présent,
seul le groupe carboxyle de la molécule participe à
la réaction. - La réaction est sélective car on obtient un seul produit.
- Le groupe
amine ne participe pas à la réaction. 2)-
À propos de l’étape 1. a)- Rôle les ions oxonium
apportés par l’acide sulfurique - Les ions oxonium apportés par l’acide sulfurique catalysent la réaction d’estérification.
- Ils jouent le rôle de catalyseur. b)-
Intérêt du chauffage à
reflux :
-
Le chauffage à reflux
permet de chauffer tout en évitant les pertes par
évaporation.
-
Ce montage permet de
maintenir le milieu réactionnel à une température
constante, en l'occurrence pratiquement la
température d'ébullition du solvant.
-
Les vapeurs sont
condensées dans le réfrigérant et retournent à
l'état liquide dans le ballon.
-
Les réactifs et les
produits restent dans le milieu réactionnel.
-
Il permet d’accélérer
la réaction sans perte de matière. 3)-
À propos de l’étape 2. a)- Diagramme de prédominance du
couple HA (aq)/ A– (aq) et
espèce prédominante dans le bécher après ajout de la
solution de carbonate de sodium.
-
L’espèce qui
prédomine à pH = 9,0, est A–,
l’ion 4-aminobenzoate.
-
Cet ion provient de
l’acide HA qui n’a pas réagi.
-
[A–]
>> [HA] b)- L’ampoule à décanter.
-
On est en présence
d’un équilibre chimique.
-
L’ajout de la
solution de carbonate de sodium a pour but :
-
De neutraliser
l’acide sulfurique pour passer d’un milieu acide à
un milieu basique
-
De transformer
l’acide HA restant en sa base conjuguée A–.
-
Comme l’eau est un
solvant polaire, toutes les espèces ioniques se
retrouvent dans la phase aqueuse.
-
L’espèce E se
trouve dans la phase organique.
c)-
Masse théorique de
benzocaïne que l’on
peut
obtenir lors de cette synthèse.
-
Quantité de matière
d’acide HA initiale :
-
-
Quantité de matière
d’éthanol initiale :
-
- On est en présence d’un équilibre chimique. - L’éthanol est en excès.
- On
déplace l’équilibre dans le sens de
l’estérification.
-
Tableau
d’avancement :
-
nHA
= xmax ≈ 9,49
× 10–3 mol
-
Masse théorique de
benzocaïne que l’on peut obtenir :
-
mE
= xmax . M (E) ≈
9,49
× 10–3
× 165
-
mE
≈ 1,57 g d)-
Rendement de la synthèse :
-
Définition du
rendement : - On appelle rendement, noté ρ, de la synthèse, le quotient de la quantité de produit P
effectivement obtenue
nP par la quantité maximale
attendue nmax :
-
-
On peut calculer la
quantité de produit P effectivement obtenue
nP.
-
-
La quantité de
matière maximale attendue :
-
nmax =
xmax ≈ 9,49
x 10–3 mol
-
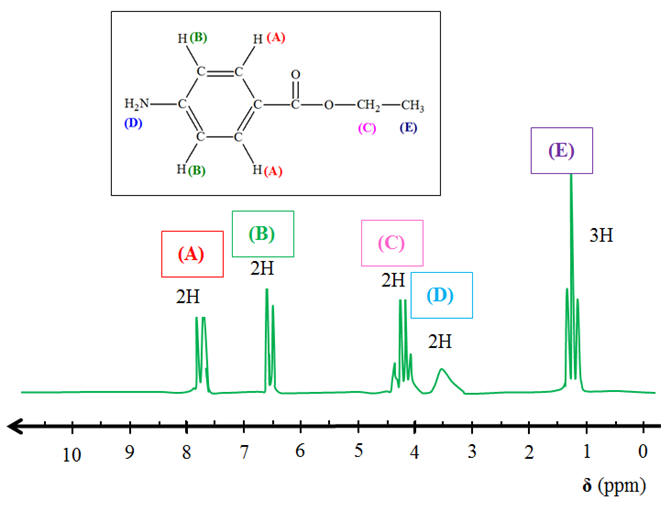
e)-
Étude du spectre de RMN
obtenu.
-
Les différents
groupes de protons équivalents :
-
Tableau des
déplacements chimiques :
-
Spectre RMN de la
benzocaïne et groupes correspondants :
-
Chaque
groupe (A) possède 1 proton équivalent
voisin. On observe un doublet
-
Chaque
groupe (B) possède 1 proton équivalent
voisin. On observe un doublet
-
Le groupe (C)
possède 3 protons équivalents voisins. On observe un
quadruplet
-
Le groupe (D)
ne possède pas de proton équivalent voisin. On
observe un singulet
-
Le groupe (E)
possède 2 protons équivalents voisins. On observe un
triplet
-
Ce spectre de RMN
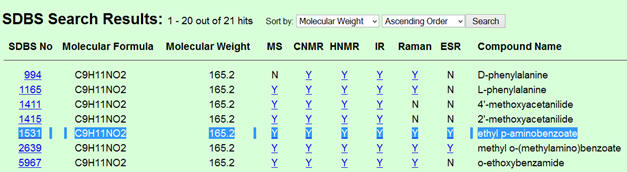
correspond bien à la molécule de benzocaïne. - Pour obtenir le spectre de la benzocaïne : Cliquer sur le lien suivant et suivre
les différentes étapes.
-
Cliquer pour
accepter.
-
-
Entrer la formule
suivante : C9H11NO2
-
Cocher les cases
suivantes :
-
Cliquer sur la touche
« ENTREE » de l’ordinateur
-
Cliquer sur ‘’1531’’
|
VIII- Exercice 17 page 511 : Analyse critique de protocole.
|
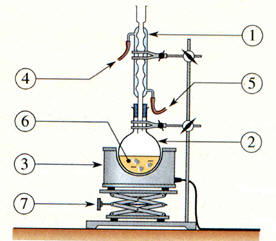
Dans un ballon de 500 mL, introduire 200 mL d’eau distillée puis, avec
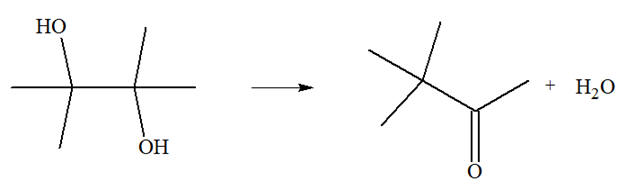
précaution, 50 mL d’acide sulfurique concentré. Porter la solution à 40 ° C et dissoudre 50 g de 2,3-diméthylbutane-2,3-diol (pinacol). L’ensemble est chauffé à reflux, une
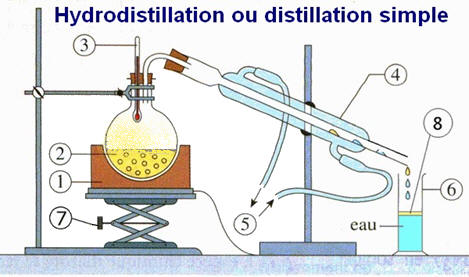
phase organique apparaît peu à peu. Refroidir l’ensemble et
procéder à une hydrodistillation. Introduire une spatule de chlorure de sodium dans le distillat biphasique et le placer dans une ampoule à décanter. Séparer les deux phases et ajouter 20 mL de diéthyléther dans la phase aqueuse. Après
traitement de la phase organique, éliminer le
solvant grâce à l’évaporateur rotatif. L’équation de la réaction
effectuée est : 1)-
Pourquoi l’acide sulfurique est-il ajouté avec
précaution ? 2)-
Justifier le rôle du chauffage. 3)- Expliquer pourquoi, avant le chauffage, il n’y a qu’une seule phase présente et, après le chauffage,
apparition d’une phase organique. 4)-
Pourquoi refroidit-on le mélange avant de réaliser
l’entraînement à la vapeur ? 5)-
Quelle est l’espèce chimique entraînée avec l’eau
lors de l’hydrodistillation ? 6)-
Pour quelle raison ajoute-t-on du sel dans le
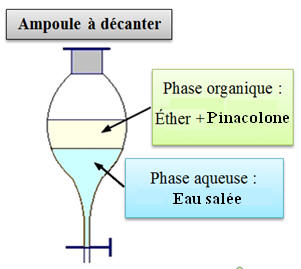
distillat ? 7)- Dessiner l’ampoule à décanter. Justifier la position relative des deux phases. Quel est le rôle de
l’éther ? 8)- a)- L’évaporateur rotatif est un appareil permettant d’évaporer le solvant. Le ballon contenant le solvant à évaporer plonge dans un bain-marie chaud et tourne en permanence. Quel est
le rôle du bain-marie ? b)- Dans un évaporateur rotatif, la pression peut être abaissée à l’intérieur du ballon. En quoi cela facilite-t-il l’évaporation du
solvant ? 9)-
On se propose de caractériser le produit obtenu par
des méthodes spectroscopiques. a)- Quelles sont les fonctions
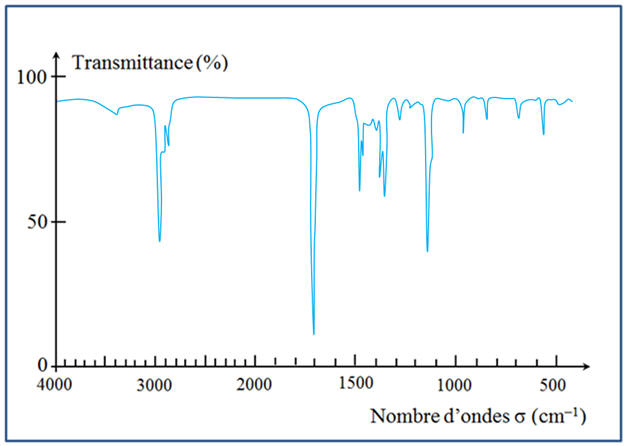
présentes dans le réactif et dans le produit ? b)- Le spectre IR du produit obtenu est donné ci-dessous. Comment peut-on être sûr que la réaction a bien eu lieu ? Justifier en donnant les nombres d’ondes caractéristiques des principales bandes apparaissant et disparaissant. c)- Quelles caractéristiques des
spectres RMN du réactif et du produit
permettraient de les distinguer ? 10)- On obtient une masse m = 35,0 g de 3,3-diméthylbutadone (pinacolone). Calculer le rendement de la
réaction.
-
Données :
-
Masse molaire de la
molécule de pinacol : M (C6H14O2)
= 118 g . mol–1
- Masse molaire de la
molécule de pinacol : M (C6H12O)
= 100 g . mol–1
|
|
1)-
Ajout d’acide sulfurique avec précaution : - La réaction entre l’acide sulfurique et l’eau est une réaction rapide et exothermique. - L’acide sulfurique est une espèce très avide d’eau.
- Il faut toujours verser l’acide
sulfurique dans l’eau et non l’inverse. - Si l’on verse trop rapidement l’acide sulfurique dans l’eau, la température de la solution obtenue augmente trop et
on peut atteindre l’ébullition de celle-ci. - L’acide sulfurique est une espèce très corrosive.
- Il faut porter les
gants, les lunettes et la blouse.
-
Pictogramme :
2)-
Rôle du chauffage. - La température est un facteur cinétique. - Le chauffage a pour but d’accélérer la réaction et de rendre le mélange plus homogène.
- Le pinacol est très soluble dans l’eau
chaude. 3)-
Chauffage et les différentes phases :
-
Avant le chauffage
toutes les espèces chimiques présentes sont solubles
dans l’eau.
-
Au cours de la
réaction, il se forme la molécule de Pinacolone qui
est peu soluble dans l’eau.
-
Il apparaît une phase
organique et une phase aqueuse. 4)-
On refroidit le mélange avant de réaliser
l’entraînement à la vapeur :
-
On refroidit le
mélange avant de réaliser l’entraînement à la vapeur
car il faut changer de montage.
-
On passe d’un montage
à reflux à une distillation simple.
-
On veut éviter de se
brûler et on veut éviter toute émission de vapeur. 5)-
Espèce chimique entraînée avec l’eau lors de
l’hydrodistillation :
-
C’est la Pinacolone. 6)-
On ajoute du sel dans le distillat :
-
On ajoute du sel dans
le distillat car la Pinacolone est moins soluble
dans l’eau salée que dans l’eau. 7)-
Ampoule à décanter. Position relative des deux
phases. Rôle de l’éther :
- La Pinacolone est plus soluble dans l’éther que dans l’eau salée.
- On
réalise une extraction par un solvant, ici l’éther. 8)- a)-
Rôle du bain-marie : - Le bain-marie permet de travailler à une température douce.
- On favorise
l’évaporation du solvant sans détériorer la molécule
de Pinacolone. b)- Évaporation du solvant et
pression : - La température d’ébullition d’une espèce chimique dépend de la pression. - Lorsque la pression diminue, la température d’ébullition
de l’espèce chimique
diminue. - L’évaporation du solvant sous pression réduite permet d’abaisser la température d’ébullition du solvant
et ainsi de
favoriser l’évaporation du solvant. - Le fait d’utiliser un évaporateur rotatif permet d’avoir un mélange bien homogène
et d’augmenter la surface d’évaporation du
mélange. 9)-
On se propose de caractériser le produit obtenu par
des méthodes spectroscopiques. a)- Fonctions présentes dans le
réactif et dans le produit :
-
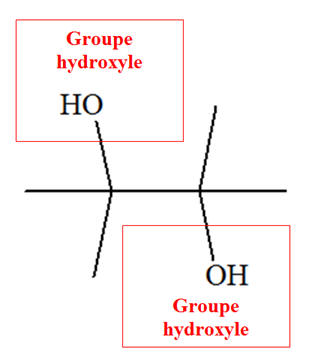
Le
2,3-diméthylbutane-2,3-diol (pinacol) :
-
Il possède deux
fonctions alcool.
-
Le
3,3-diméthylbutadone
(pinacolone) :
-
Il possède une
fonction cétone :
b)-
Étude du spectre IR
du produit obtenu :
-
Au cours de la
réaction, les groupes hydroxyle – OH ont été
remplacés par le groupe carbonyle C =
O.
-
Pour la molécule de
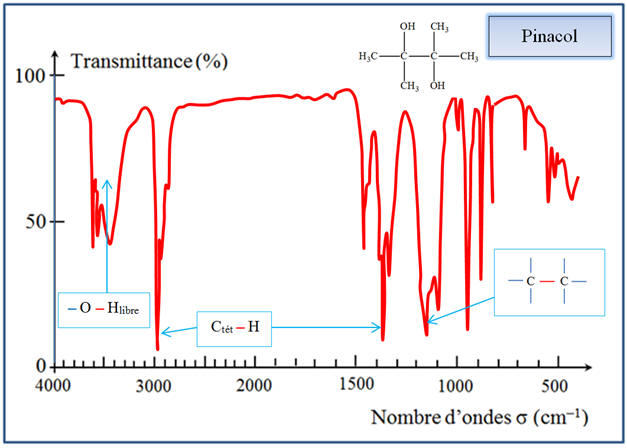
pinacol, on observe les bandes caractéristiques
suivantes :
-
Spectre IR du
pinacol :
-
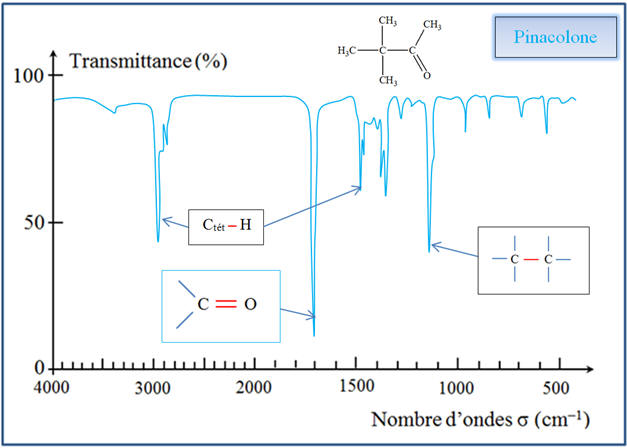
Pour la molécule de
pinacolone, on observe les bandes caractéristiques
suivantes :
-
Spectre IR du
pinacolone :
-
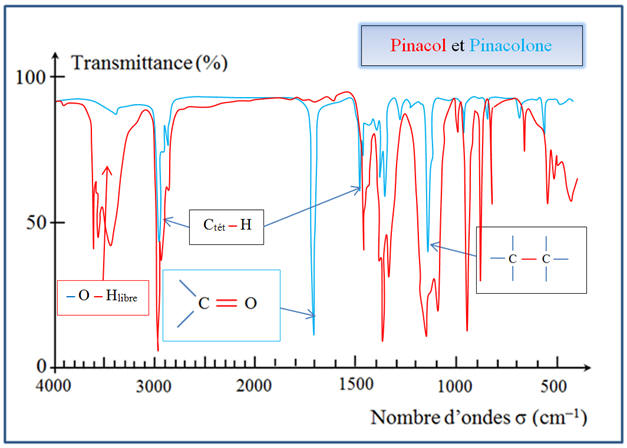
Superposition des
deux spectres :
-
D’après le spectre
RMN, on peut affirmer que la réaction a eu lieu.
-
La bande d’absorption
des groupes – O – H (3580 cm–1
à 3650 cm–1) a disparue.
-
On trouve en revanche
la bande caractéristique du groupe C = O
(1650 cm–1
à 1730 cm–1). c)- Caractéristiques des
spectres RMN du réactif et du produit :
-
Dans le cas du
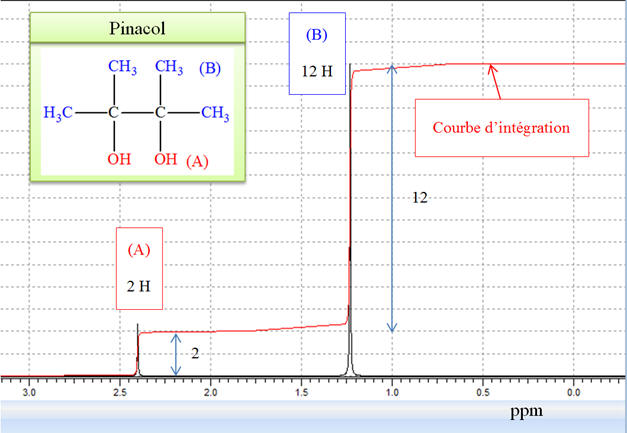
pinacol, on observe deux types de signaux :
-
Un pour les 12
protons des groupes méthyle,
-
Un pour les deux
protons des groupes hydroxyle.
-
Le rapport de leurs
intensités est donc de 6/1.
-
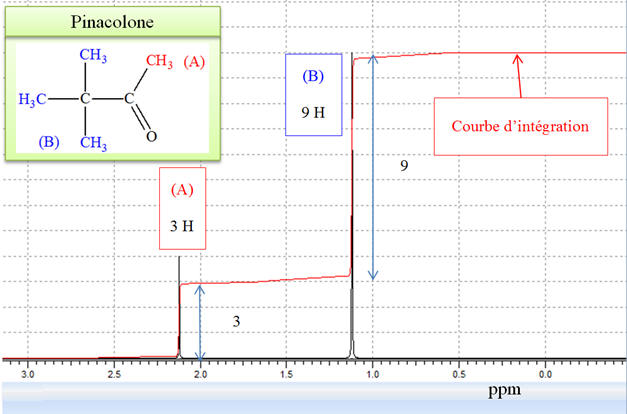
Dans le cas de la
pinacolone, on observe deux types de signaux :
-
Un pour les 9 protons
du tertio-butyle (t–butyle)
-
Un pour les 3 protons
du groupe méthyle
-
Le rapport de leurs
intensités est donc de 3/1. - Pour les deux spectres, on observe deux pics.
- Ce qui change, c’est
le rapport entre les deux pics.
-
Pour la molécule de
pinacol, le rapport est de 1/6 et pour la molécule
de pinacolone le rapport est de 1/3. 10)-
Rendement de la réaction :
-
Définition du
rendement : - On appelle rendement, noté ρ, de la synthèse, le quotient de la quantité de produit P effectivement obtenue nP
par la quantité maximale
attendue nmax :
-
-
On peut calculer la
quantité de produit P effectivement obtenue
nP.
-
- La quantité de matière maximale attendue : on est en présence d’une réaction
d’élimination avec un seul réactif.
-
nmax =
ni (C6H14O2)
-
-
nmax =
ni (C6H14O2)
≈ 0,42 mol
-
|

|
|