|
|
Premier principe de la thermodynamique
et bilan énergétique |
|
|
|
|
|
I- Le modèle du gaz parfait et quelques limites. |
|
II- L’énergie interne et les modes de transfert de l’énergie. 1)- Énergie
interne d’un système. 2)- Énergie totale
d’un système. |
|
III- Le premier principe de la thermodynamique. 2)- Étude
énergétique d’un système thermodynamique. |
|
QCM r
Premier principe de la
thermodynamique et bilan énergétique Le modèle du gaz parfait et quelques
limites L’énergie interne et les modes de
transfert de l’énergie Le premier principe de la thermodynamique
|
|
Exercices : énoncé et correction
Préparation à l'ECE Identification d’un échantillon métallique 1)- Exercice 05 page 312 : Déterminer un volume
molaire. 2)- Exercice 07 page 312 : Exprimer une mass
volumique. 3)- Exercice 08 page 312 : Calculer une masse
volumique. 4)- Exercice 09 page 313 : Définir l’énergie
interne. 5)- Exercice 11 page 313 : Connaître l’énergie
microscopique. 6)- Exercice 13 page 313 : Distinguer des
variations d’énergie. 7)- Exercice 15 page313 : Reconnaître le mode de
transfert de l’énergie. 8)- Exercice 17 page 314 : Connaître le premier
principe . 9)- Exercice 21 page 314 : Prévoir l’évolution
de l’énergie interne. 10)- Exercice 23 page 315 : Pression d’un gaz. 11)- Exercice 26 page 316 : Il y a film et film. 12)- Exercice 29 page 317 : Équation de Van der
Waals. 13)- DS N° 01 : Le principe de la montgolfière
(30 min) : exercice 31 page 318. 14)- DS N° 02 : Géothermie (50 min) : exercice
32 page 319. 15)- Préparation à ECE : Identification d’un
échantillon métallique. |
|
QCM r
Premier principe de la
thermodynamique et bilan énergétique Le modèle du gaz parfait et
quelques limites L’énergie interne et les modes
de transfert de l’énergie
Le premier principe de la thermodynamique
|
I-
Le modèle du
gaz parfait et quelques
limites
.
-
L’état gazeux est
un état dispersé.
-
À l’état
microscopique :
-
Les molécules ou
les atomes sont éloignés les uns des autres et se déplacent dans toutes les
directions de façon désordonnée.
-
Les interactions
entre les entités chimiques sont faibles.
-
À l’état gazeux
règne le chaos moléculaire.
-
L’agitation des
molécules constituant un gaz, sous faible pression caractérise son état
thermique.
-
L’agitation des
molécules qui constituent un gaz est liée à une grandeur macroscopique :
-
la température
absolue du gaz, notée
T.
-
L’unité de
température absolue est le Kelvin : symbole K.
-
La température
absolue étant liée à l’agitation des molécules d’un gaz, on ne peut pas
refroidir indéfiniment un gaz.
-
Lorsque la
température diminue, l’agitation thermique diminue aussi.
-
Lorsque les
molécules sont immobiles, il n’y a plus d’agitation thermique et on ne peut plus
refroidir : c’est le zéro absolu.
-
En l’absence de
toute agitation thermique la température
T
= 0 K.
-
C’est le zéro
absolu où toutes les particules sont immobiles.
-
Au zéro absolu, la
température absolue est nulle, la pression est nulle et il n’y a plus
d’agitation thermique.
-
La température
absolue est une grandeur obligatoirement positive.
-
Relation :
l’échelle de température Celsius (température notée
θ
) se déduit de la température absolue par la relation :
-
T
(K) = θ
° C + 273,15 ou T
(K) ≈ θ
°
C + 273
|
-
Les grandeurs
macroscopiques de description du gaz |
-
Un gaz est dit
parfait si la taille de ses entités est négligeable devant la distance qui les
sépare et si les interactions entre elles sont négligeables.
-
À basse pression,
tous les gaz peuvent être assimilés à des gaz parfaits.
|
GAZ PARFAIT |
|
|
À l’échelle
macroscopique
Grandeur physique |
À l’échelle
microscopique
Comportement |
|
Le gaz parfait
est au repos
à la température
T (K) |
Mouvement
incessant et
désordonné des
entités du gaz
Pas d’interaction
entre
les entités
assimilées à des
points matériels |
|
La pression P
(Pa) est faible |
Pas de chocs
entre les entités de gaz
Chocs seulement
entre les entités
du gaz et la
paroi |
|
La masse volumique
(kg . m–3) est
très faible |
Les entités du
gaz sont éloignées
les unes des
autres. |
c)-
Équation d’état du gaz
parfait :
-
Cette équation
relie les différentes grandeurs macroscopiques qui permettent de le décrire.
|
P . V
= n . R . T |
|
|
P
|
Pression en
pascal (Pa) |
|
V |
Volume en mètre
cube (m3) |
|
n |
Quantité de
matière en mole (mol) |
|
R |
Constante des gaz parfaits :
R = 8,314 Pa . m3 .mol–1 . K–1 |
|
T |
Température absolue en kelvin (K) |
►
Volume du gaz
parfait :
-
![]()
►
Masse volumique du gaz
parfait :
-
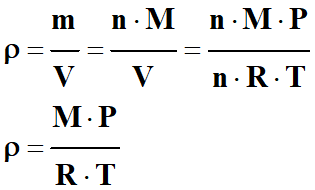
2)- Quelques limites du
modèle du gaz parfait.
-
Si la pression et
la masse volumique du gaz sont trop importantes, alors le modèle du gaz parfait
n’est plus adapté.
-
Le modèle du gaz
parfait est adapté :
-
Si la pression est
faible ;
-
Si l’entité
chimique qui constitue le gaz est de faibles dimensions
-
Pour un gaz réel :
-
P
. V
≈ n
.
R
.
T
si la pression
est faible et si la température n’est pas trop basse.
-
Dans les conditions
habituelles de température et de pression, l’air (mélange de gaz) se comporte
comme un gaz parfait.
II-
L’énergie
interne et les modes de transfert de l’énergie.
1)- Énergie interne
U
d’un système.
►
Échelle
microscopique :
|
-
À l'échelle
microscopique, les particules constituant le système sont animées de mouvements
individuels.
-
L’énergie cinétique microscopique est lié à la vitesse de déplacement
des particules du système dans
le référentiel d’étude.
-
Cette agitation augmente avec la température T, on
l'appelle l'agitation thermique.
-
Plus la température
d’un système est élevée, plus l’agitation thermique des particules qui le
constituent est grande et plus son énergie cinétique microscopique est grande.
-
Au niveau
microscopique, à toute liaison entre deux particules du système est associée une
énergie potentielle microscopique.
-
L’énergie
potentielle microscopique est due aux interactions gravitationnelle,
électromagnétique, forte et faible entre les particules qui constituent le
système.
-
On distingue les
énergies potentielles microscopiques chimique, électrique, magnétique et
nucléaire.
-
Les énergies
potentielles résultent de l’énergie de liaisons chimiques et de l’énergie de
masse des noyaux.
-
On peut citer d’autres
formes d’énergies potentielles microscopiques qui résultent de liaisons
intermoléculaires entre les molécules qui constituent le système étudié.
-
Ces énergies
potentielles microscopiques varient lors d’un changement d’état de la matière :
fusion, liquéfaction, solidification.
-
L’énergie interne
est la somme des énergies cinétique et potentielle microscopiques, c’est
l'énergie liée à sa structure interne microscopique, notée U.
-
Énergie interne :
U
(J)
-
Le plus souvent, on
s’intéresse à la variation de l’énergie interne
ΔU
d’un système. |
2)- Énergie totale d’un
système.
►
Échelle
macroscopique :
-
L’énergie mécanique
Em
d’un système macroscopique résulte de contributions macroscopiques.
-
L’énergie mécanique
d’un système est la somme de son énergie cinétique et de son énergie
potentielle.
-
Relation :
-
Em
= EC
+ EP.
-
Unité : joule (J)
►
Énergie totale d’un
système :
-
L’énergie totale
d’un système est la somme de son
énergie interne
U
et de son
énergie
mécanique
E
m.
-
Etot
= Em
+ U
-
La variation
d’énergie totale d’un système est égale à la somme des variations de son énergie
interne et de son énergie mécanique :
-
ΔEtot
= ΔEm
+ ΔU
►
Système au repos
macroscopique :
-
Lorsqu’un système
est au repos macroscopique dans le référentiel d’étude, son énergie mécanique
est constante.
-
La variation
d’énergie totale du système est alors égale à sa variation d’énergie interne :
-
ΔEtot
= ΔU
3)- Deux modes de transfert
de l’énergie.
Transferts macroscopique d'énergie
|
-
Exemple : - Un transfert d'énergie ayant pour effet de modifier la position, la forme d'un objet ou
de le
mettre en mouvement par rapport à un référentiel donné est appelé travail
mécanique noté
Wm.
-
On parle plus
simplement de travail noté
W
exprimé en Joule (J).
-
Le travail
W
est un transfert d’énergie qui s’effectue macroscopiquement de façon ordonnée.
-
Il peut être lié au
déplacement du point d’application d’une force s’exerçant sur un système. |
Transferts d'énergie et conservation
Transferts d'énergie et énergie interne
|
-
La thermodynamique
étudie plus particulièrement les transformations de
transfert
thermique
en travail et réciproquement.
-
Le
transfert
thermique
est de l'énergie cinétique d'agitation des particules qui composent le système ;
mais cette agitation est désordonnée. - La différence entre transfert thermique et travail est expliquée par la mécanique statistique ;
celle-ci permet de
définir une fonction qui mesure le degré de "désordre" d'un état macroscopique d'un système.
-
Cette fonction
s'appelle l'entropie.
-
Le
transfert
thermique
est une forme d'énergie.
-
Le
transfert thermique Q
est un transfert
d’énergie qui s’effectue microscopiquement de manière désordonnée entre le
système et le milieu extérieur.
-
Le milieu extérieur
est tout ce qui n’est pas le système. - Ainsi, lorsqu’il existe une différence de température entre le système et le milieu extérieur,
le
transfert thermique
Q
se fait spontanément du corps le plus chaud vers le corps le plus froid. |
►
Exemple : La tasse de
café :
-
Cas d’une tasse de café (65
° C) qu’on laisse à la température ambiante (21 ° C).
-
Au cours du temps,
la température du café diminue.

-
La tasse de café constitue le système d’étude
S
, l’autre système
S’
est
constitué par le milieu extérieur.
-
Un transfert
d’énergie s’effectue de la tasse de café vers le milieu extérieur.
-
La tasse de café cède de l’énergie sous forme de
transfert thermique, notée Q,
au milieu extérieur.
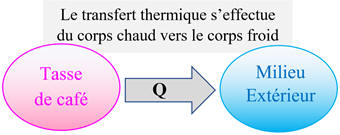
-
Un transfert
thermique a pour conséquence macroscopique une modification de la température
T
ou un changement d’état physique du système.
c)-
Travail et transfert
thermique :
|
-
Le travail
W
et le transfert thermique
Q
sont des grandeurs algébriques. - Par convention :
-
Le travail
W
et le transfert thermique
Q
sont comptés
positivement
s’ils sont reçus par le système.
-
Le travail
W
et le transfert thermique
Q
sont comptés
négativement
s’ils sont cédés par le système.
-
Le bilan
énergétique dépend du système choisi.
-
Avant tout bilan,
il faut préciser le système d’étude.
-
L’énergie d’un
système varie s’il reçoit ou cède de l’énergie. |
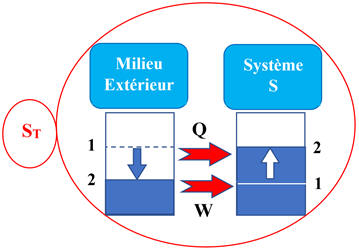
-
On peut écrire que
:
-
ΔES =
E2
–
E1
=
Q
+
W
►
Exemple de
convertisseurs d’énergie.
-
Le radiateur
électrique convertit de l’énergie électrique en énergie thermique.
-
Le système
(Radiateur électrique) reçoit un travail électrique :
W
> 0
-
Le système
(Radiateur électrique) cède un transfert thermique :
Q
< 0
►
La bouilloire
électrique :
- Une bouilloire électrique, alimentée par la tension du secteur de valeur efficace U eff = 230 V.
- Elle comprend un conducteur ohmique de résistance
R
= 120 Ω.


-
On verse 500 mL
d’eau dans la bouilloire électrique que l’on chauffe à 60 ° C.
-
Le système étudié
est le
conducteur ohmique
de la bouilloire.
-
Le conducteur
ohmique est alimenté par une
source de tension.
-
Il reçoit de
l’énergie sous forme de travail électrique
W
compté
positivement.
-
D’autre part, il
cède de l’énergie à l’eau
qui constitue le milieu extérieur sous forme de transfert thermique
Q.
-
Ce transfert
thermique
Q
est compté
négativement
pour le conducteur ohmique.
►
Chaîne énergétique :
III-
Le premier
principe de la thermodynamique.
|
-
La variation ΔU
i→f
d’énergie interne d’un système,
-
Qui n’échange pas
de matière avec le milieu extérieur,
-
Au repos
macroscopique,
-
Qui évolue d’un
état initial (i) à un état final (f)
-
Est égale à la
somme des énergies échangées par le système avec le milieu extérieur,
-
Par travail
W
et / ou par transfert thermique
Q
: |
|
ΔUi→f
= W + Q |
|
ΔUi→f
: Variation d’énergie interne (joule : J) |
|
W :
Travail (électrique ou mécanique) (joule :
J) |
|
Q :
Transfert thermique (joule : J) |
-
Remarques :
-
L’énergie mécanique
d’un système au repos macroscopique dans le référentiel d’étude est constante.
-
Le premier principe
de la thermodynamique relie la variation d’énergie interne aux transferts
d’énergie.
-
Il permet d’établir
le bilan énergétique d’un système qui n’échange pas de matière avec le milieu
extérieur.
2)- Étude énergétique d’un
système thermodynamique.
►
Établissement d’un
bilan énergétique :
|
-
Il faut :
-
Définir le système
au repos macroscopique, l’extérieur est alors le reste de l’Univers ;
-
Écrire le premier
principe de la thermodynamique ;
-
Relever tous les
transferts d’énergie ayant lieu entre le système et le milieu extérieur
-
Repérer le sens de
chaque transfert d’énergie ;
-
Attribuer un
signe positif
si l’énergie est
reçue
par le
système ;
-
Attribuer un
signe négatif
si l’énergie est
cédée
par le système ;
-
Effectuer la somme
de tous ces transferts :
-
Si la somme est
positive,
l’énergie interne du système a
augmenté ;
-
Si la somme est
négative,
l’énergie interne du système a
diminué. |
►
Application :
- Le fluide frigorigène d’une pompe à chaleur prend de l’énergie à l’air froid extérieur et en transfère à l’air de la pièce à chauffer.
-
Pour
cela, un compresseur transfère de l’énergie par travail mécanique au fluide
frigorigène.
-
Schéma du
dispositif :
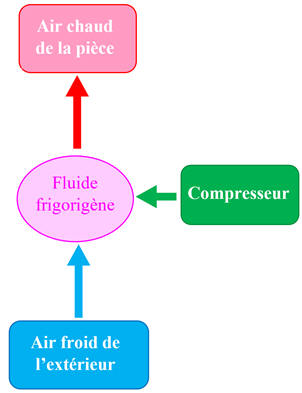
-
Compléter le schéma
avec les trois transferts d’énergie ayant lieu entre le système (fluide
frigorigène) et le milieu extérieur.
-
Écrire le premier
principe pour le système (fluide frigorigène).
►
Réponses :
-
Schéma légendé :
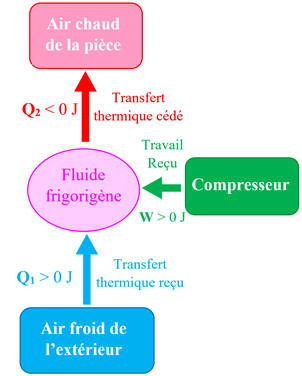
-
Premier principe
pour le système (fluide frigorigène) :
-
Système étudié :
Fluide frigorigène
-
W : Énergie reçue sous
forme de travail mécanique
W
> 0 J
-
Q1
:
Transfert thermique reçu du milieu extérieur :
Q1
> 0 J
-
Q2
:
Transfert thermique cédé à l’air de la pièce : Q2
< 0 J
-
Relation :
-
ΔU
=
W
+
Q1
+ Q2
3)- Énergie interne d’un
système incompressible.
►
Système
incompressible :
-
Un système est
incompressible si sa masse volumique
ρ
est constante.
►
Augmentation de la
température d’un système incompressible :
-
Lorsque l’on
augmente la température d’un système incompressible,
-
L’énergie cinétique
des entités chimiques qui le constitue augmente ;
-
Donc son énergie
interne
U
augmente.
►
Capacité thermique :
-
La capacité
thermique
C
d’un système est égale au produit de la masse
m
du système par sa capacité thermique massique
c.
|
C = m . c |
|
C
: Capacité thermique (J . °C–1) ou (J . K–1) |
|
m :
masse du système (kilogramme :
kg) |
|
C
: Capacité
thermique massique (J . kg–1
. °C–1) ou (J . kg–1 . K–1) |
-
Quelques capacités
thermiques massiques :
|
Matériau |
c
(J . kg–1
. °C–1)
ou (J . kg–1
. K–1) |
|
Aluminium Al
(s) |
897 |
|
Eau H2O
(s) |
2,06 × 103 |
|
Éthanol C2H5OH
(ℓ) |
2,44 × 103 |
|
Eau H2O
(ℓ) |
4,81 × 103 |
►
Définition de la
capacité thermique massique :
|
- La capacité thermique massique c d’un système incompressible est l’énergie absorbée par
1 kg de ce système pour
élever sa température de 1 ° C ou 1 K. |
►
Transfert par chaleur
produisant une élévation de température (sans changement d’état) :
|
- La variation d’énergie interne ΔU d’une masse m de substance dont la température varie d’une valeur initiale θi à une valeur finale θf, sans changement d’état,
est donnée par la relation suivante : |
|
ΔU
= m . c . (θf
– θi ) = m . c . Δθ
|
|
ΔU :
Variation d’énergie interne en joule (J) |
|
m :
Masse de la substance en kilogramme (kg) |
|
c :
Capacité thermique massique
(J.kg – 1.°
C– 1) ou (J.kg – 1. K– 1) |
|
θf
– θi =
Δθ
: Variation de température
en (°C) ou (K) |
►
Remarque 1 :
-
On peut travailler avec la température absolu
T
en kelvin (K)
|
ΔU
= m . c . (Tf
– Ti ) = m . c . ΔT
|
|
ΔU
: Variation d’énergie interne en joule (J) |
|
m :
Masse de la substance en en kilogramme (kg) |
|
c :
Capacité thermique massique
(J . kg –
1.° C– 1) ou (J.kg – 1.K– 1)
|
|
Tf
–Ti
= ΔT :
Variation de
température absolue en
kelvin (K) |
►
Remarque 2:
-
ΔT = Δθ
►
Remarque 3 :
|
- La capacité thermique massique c d’une substance correspond au transfert thermique nécessaire pour faire
varier
de 1 ° C (ou 1 K) une masse de
-
Unité : (J.kg
– 1
.° C
– 1
)
ou (J . kg
– 1
. K
–
1) |
►
Remarque 4 :
-
Si θ
f
> θ
i
=>
ΔU = Q >
0,
la substance reçoit de l'énergie du milieu extérieur.
-
Si θ
f
< θ
i
=>
ΔU = Q <
0,
la substance cède de l'énergie au milieu extérieur.
►
Exemple :
|
On chauffe de l’eau afin obtenir 80 L d’eau à 80 ° C à partir de 80 L d’eau à 20 ° C.
- Masse volumique de l’eau : ρ = 1,0 kg / dm3 - Capacité thermique massique de l'eau : c = 4,18 kJ . kg–1 . ° C–1 |
|
-
Variation de
l’énergie interne du système :
-
La température du
système augmente.
-
La variation de
l’énergie interne ΔU
du système est positive
-
ΔU
= Q
=
m
. c
. (
θ
f
– θ
i
)
-
ΔU =
80 × 4,18 × (80 – 20)
-
ΔU =
2,0 × 10
4
kJ. |
4)- Établir un bilan énergétique .
|
Un cumulus électrique est une réserve d’eau chauffée par un conducteur ohmique.
En l’absence de chauffage, la température
de l’eau chaude qu’il contient diminue au fil des
heures. On souhaite
faire le bilan énergétique de l’eau contenue dans le
cumulus.
-
Définir le
système étudié.
-
Relever la
nature des transferts énergétiques entre le système et le milieu
extérieur.
-
Repérer le
sens des transferts et leur attribuer un signe.
-
Présenter
le bilan énergétique à l’aide d’un schéma. |
|
►
Système
étudié : S
-
S
= {Eau contenue dans le cumulus}
►
Nature des
transferts énergétiques entre le système et le milieu extérieur. - La résistance du cumulus, lorsqu’elle est traversée par un courant électrique,
transfère à l’eau de l’énergie
électrique par travail électrique We.
-
La
température de l’eau contenue dans le cumulus augmente. - Lorsque la résistance n’est plus traversée par un courant électrique,
la température de l’eau diminue
lentement.
-
Le système
S cède de l’énergie au milieu extérieur sous forme de
transfert thermique
Q.
►
Sens des
transferts et signe :
-
L’eau
reçoit de l’énergie par travail électrique We.
-
Cette
énergie est comptée positivement : We > 0.
-
L’eau cède
de l’énergie Q par transfert thermique.
-
Cette
énergie est comptée négativement : Q < 0.
►
Schéma du
bilan énergétique : |
Mesure de la capacité thermique massique du laiton.
|
QCM r
Premier principe de la
thermodynamique et bilan énergétique Le modèle du gaz parfait et
quelques limites L’énergie interne et les modes
de transfert de l’énergie
Le premier principe de la thermodynamique
|
|
Exercices : 1)- Exercice 05 page 312 : Déterminer un volume
molaire. 2)- Exercice 07 page 312 : Exprimer une mass
volumique. 3)- Exercice 08 page 312 : Calculer une masse
volumique. 4)- Exercice 09 page 313 : Définir l’énergie
interne. 5)- Exercice 11 page 313 : Connaître l’énergie
microscopique. 6)- Exercice 13 page 313 : Distinguer des
variations d’énergie. 7)- Exercice 15 page313 : Reconnaître le mode de
transfert de l’énergie. 8)- Exercice 17 page 314 : Connaître le premier
principe . 9)- Exercice 21 page 314 : Prévoir l’évolution
de l’énergie interne. 10)- Exercice 23 page 315 : Pression d’un gaz. 11)- Exercice 26 page 316 : Il y a film et film. 12)- Exercice 29 page 317 : Équation de Van der
Waals. 13)- DS N° 01 :Le principe de la montgolfière
(30 min) : exercice 31 page 318. 14)- DS N° 02 : Géothermie (50 min) : exercice
32 page 319. 15)- Préparation à ECE : Identification d’un
échantillon métallique. |
|
|