|
|
Méthodes d'analyse physique |
|
|
|
|
|
II-
Dosage
spectrophotométrique.
a)-
Mesure de l’absorbance d’une
solution par spectrophotométrie.
b)-
Principe
de fonctionnement.
2)- Absorbance en fonction
de la concentration.
a)-
Réglage du spectrophotomètre. |
|
|
|
3)- Spectroscopie
infrarouge IR . a)- Présentation d’un spectre. |
|
QCM r
L |
|
Préparation à l'ECE : Le sérum physiologique
1)- Exercice 04 page 40 : Utiliser la loi de
Beer-Lambert.
2)- Exercice 05 page 40 : Exploiter la loi de Kohlrausch.
3)- Exercice 06 page 40 : écrire l’expression d’une
conductivité.
4)- Exercice 08 page 40 : Utiliser l’équation d’état du
gaz parfait.
5)- Exercice 14 page 41 : Contrôle de qualité d’un
produit.
6)- Exercice 16 page 42 : La tyrosine.
7)- DS N° 01 : Sirop
de menthe glacial : exercice 23 page 46.
8)- DS N° 02 : Sol truffier (15 min) : exercice 24 page
47. |
I-
Les dosages par
étalonnage.
|
Réaliser un dosage par étalonnage consiste à déterminer la concentration d’une espèce en solution en comparant une grandeur physique, caractéristique de la solution, à la même
grandeur physique mesurée pour des solutions étalons. |
2)-
Exemples : les différents types de dosages :
-
Dosage avec un
spectrophotomètre.
-
Dosage avec un
conductimètre (titrage conductimétrique).
-
Dosage avec un
pH-mètre (titrage
pH-métrique).
-
Dosage avec un
indicateur coloré (titrage colorimétrique).
II-
Dosage
spectrophotométrique.
a)-
Mesure de l’absorbance d’une
solution par spectrophotométrie.
-
On utilise le fait que toute solution colorée absorbe
la lumière visible (400 nm < λ0
< 800 nm).
-
Lorsqu’un faisceau de lumière monochromatique
traverse un milieu absorbant, l’intensité lumineuse
I du faisceau
transmis est inférieure à l’intensité lumineuse
I0
du faisceau incident.
-
Pour évaluer cette
diminution, on utilise :
-
La transmittance T :

-
L’absorbance A :

-
La transmittance
s’exprime en pourcentage.
-
À une transmittance
T de 100 % (T
= 1) correspond une absorbance nulle : A
= 0.
-
à une
transmittance de 1 % (T
= 0,01) correspond une absorbance A =
log 100 = 2.
-
Exemple de
réaction :
-
On peut utiliser
cette méthode lorsqu’une espèce colorée se forme ou disparaît au cours de la
réaction.
-
Réaction entre
l’eau oxygénée et les ions iodure en milieu acide :
-
Il se forme du
diiode qui est une espèce chimique colorée.
-
Équation de la
réaction :
|
H2O2
(aq)
+ 2
H+(aq)
+
2 I– (aq)
→ 2
H2O
(ℓ)
+ I2 (aq) |
|
Réaction lente |
b)-
Principe
de fonctionnement.


-
Un système dispersif (prisme ou réseau) permet de
sélectionner une radiation lumineuse de longueur d’onde
λ donnée.
- Cette radiation est dirigée vers l’échantillon à analyser.
- Le flux lumineux transmis est mesuré et converti en valeur
d’absorbance A.
c)-
Absorbance en fonction de la
longueur d’onde.
-
L’absorbance d’une
solution colorée dépend de la longueur d’onde de la radiation lumineuse
utilisée.
-
On donne
l’absorbance d’une solution de diiode en fonction de la longueur d’onde :
-
Pour une solution de diiode de concentration
C = 1,0
mmol / L, on mesure l’absorbance
A pour différentes
longueurs d’ondes.
-
La plage de
variation de la longueur d’onde se situe dans l’intervalle suivant :
-
400
nm < λ < 700
nm.
-
On règle la
longueur d’onde sur la valeur souhaitée, on fait le blanc avec la solution
étalon, puis on mesure l’absorbance.
-
Il faut répéter le
mode opératoire pour chaque mesure.
-
Courbe obtenue :
2)- Absorbance en fonction
de la concentration.
a)-
Réglage du spectrophotomètre.
-
Pour réaliser les
mesures d’absorbance, le spectrophotomètre est généralement réglé sur la
longueur d’onde
λmax
correspondant au maximum d’absorption du spectre de la solution étudiée.
-
À cette longueur
d’onde, la valeur de l’absorbance étant la plus grande, l’incertitude sur la
mesure est la plus petite.
-
Pour les solutions aqueuses de diiode, on choisit
λ = 450 nm,
pour avoir le maximum de variations pour la valeur de
A.
-
On n’a pas choisi λ = 475 nm car
le spectrophotomètre sature en fin d’expérience lorsque la concentration en
diiode devient trop grande.
b)-
Préparation des solutions et
mesures :
-
On dispose d’une solution
S0
de concentration en diiode C0
= 1,0 mmol / L.
-
À partir de S0,
préparer les solutions 10 mL de solution
S en utilisant les
solutions présentes dans les burettes.
-
Matériel :
-
Préparer la solution
S et réaliser la
mesure de l’absorbance de la solution préparée.
|
Groupes
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Solution S
mmol / L
|
0,10
|
0,20
|
0,30
|
0,40
|
0,50
|
0,60
|
0,70
|
0,80
|
0,90
|
1,0
|
|
Absorbance A g1 |
0.120 |
0.256 |
0.435 |
0.578 |
0.723 |
0.818 |
0.997 |
1.149 |
1.281 |
1.404 |
-
Pour préparer la solution
S, on mélange la
solution de diiode de concentration C0
= 1,0 mmol / L et la solution d’iodure de potassium de concentration
C = 0,20 mol
/ L.
|
Pour préparer la solution 1, on mélange à l’aide des burettes graduées, - 1 mL de solution de diiode de concentration C0 = 1,0 mmol / L - 9 mL de solution d’iodure de potassium de concentration C = 0,20 mol / L |
|
Pour préparer la solution 2, on mélange à l’aide des burettes graduées, - 2 mL de solution de diiode de concentration C0 = 1,0 mmol / L -
8 mL de solution d’iodure de potassium de concentration
C = 0,20 mol / L.
|
|
Ainsi de suite jusqu'à la solution 10. |
-
On trace la courbe
A = f
(C).
-
Courbe obtenu par
le Groupe 1 :
-
On obtient la
courbe d’étalonnage.
-
Ce graphe est une
portion de droite passant par l’origine.
-
L’absorbance A
est proportionnelle à la concentration C
de la solution de diiode.
-
A = k
. [I2].
-
On peut généraliser
ce résultat à toutes les solutions colorées.
-
Pour les solutions
suffisamment diluées, l’absorbance
A est proportionnelle à la concentration
C
de l’espèce colorée.
►
Définition :
|
L’absorbance d’une solution diluée contenant une espèce colorée est
proportionnelle à la concentration (effective)
C de cette espèce et à
l’épaisseur ℓ (cm) de la solution traversée par le faisceau
lumineux. |
|
A (λ)
= ε (λ) .
ℓ .
C |
|
A :
absorbance : grandeur sans unité |
|
ℓ :
largeur de la cuve (épaisseur de la solution traversée) (cm) |
|
ε
(λ) : coefficient d’extinction molaire (mol– 1. L. cm–
1) |
|
C :
concentration de l’espèce absorbante (mol . L– 1) |
|
ε (λ) : - ε (λ) est appelé
coefficient d’extinction molaire ou coefficient d’absorption
molaire. - Il dépend de la nature de
l’espèce dissoute et de la longueur d’onde de la radiation
utilisée. - Il dépend également du solvant et
de la température. |
-
La courbe A
= f
(C)
constitue la courbe d’étalonnage de la substance étudiée.
-
Elle permet de
déterminer la concentration d’une solution de la substance étudiée.
-
Elle permet donc de
doser une espèce chimique colorée.
-
Afin d’augmenter la
sensibilité de la méthode, on utilise la longueur d’onde qui correspond au
maximum d’absorption de la substance étudiée.
-
Cette méthode est
alors beaucoup plus précise que la méthode colorimétrique utilisant une échelle
des teintes.
-
Remarque : la
solution colorée doit être suffisamment diluée,
-
C ≤ 1,0 × 10–2
mol . L–1, et le
spectrophotomètre ne doit pas saturer.
1)- Le conductimètre.
Titrage
conductimétrique
|
Le
conductimètre est constitué : - D'une sonde de conductimétrie (deux plaques conductrices en vis-à-vis,
alimentées par une tension alternative).
-
D'un
boîtier qui sert d'alimentation pour la sonde. - Ce boîtier dispose en outre d'une zone de lecture, d'un bouton
de réglage
de la
température et d'un bouton d'étalonnage.
-
Un
troisième bouton permet en général de sélectionner le calibre. |
-
Régler le bouton de
température du conductimètre sur la température de la pièce.
-
Rincer (avec de
l'eau distillée) et essuyer délicatement (avec du papier Joseph) la sonde.
-
Plonger la sonde
dans une solution d'étalonnage.
-
Régler le bouton
d'étalonnage du conductimètre pour que la valeur affichée coïncide avec la
valeur donnée par le fabriquant de la solution d'étalonnage (à la température de
la pièce).
-
Sortir la sonde de
la solution d'étalonnage, la rincer, la replacer dans l'eau distillée.
-
Rincer la sonde de
conductimétrie (si possible avec la solution dont on veut mesurer la
conductivité). L'essuyer délicatement avec du papier Joseph.
-
Plonger la sonde
dans la solution dont on veut mesurer la conductivité.
-
Attendre la
stabilité (quelques secondes).
-
Lorsque la lecture
est terminée, rincer la sonde et la plonger dans la solution d'eau.
|
Détermination
de la concentration d’une solution L’hypocalcémie, carence de l’organisme en élément calcium, peut être traitée par
injection intraveineuse d’une solution de chlorure de
calcium (Ca2+ (aq)
+ 2
Cl– (aq)). Pour
déterminer sa concentration C,
on utilise une méthode conductimétrique. 1. On dispose, pour étalonner la cellule conductimétrique, de solutions étalons Si de
concentrations connues
Ci.
-
Le tableau
suivant fournit les conductances Gi de ces
différentes solutions.
-
Tracer la courbe G = f (C). 2. Le contenu d’une ampoule de solution injectable a été dilué 100 fois. La mesure de la conductance de la solution diluée, avec la même cellule conductimétrique et à la même
température, donne :
G’ = 2,71 mS.
a.
Déterminer la valeur de la concentration
C’ de la solution diluée.
b.
En
déduire la concentration C
de la solution injectable.
c.
Pourquoi a-t-il été nécessaire de diluer cette solution ?
3.
Déterminer l’apport calcique, c’est-à-dire la quantité d’élément
calcium, d’une ampoule
de solution injectable de 10,0 mL. |
Correction :
|
Détermination
de la
concentration d’une solution
1.
Courbe G = f (C).
-
Les points
sont sensiblement alignés. On peut tracer la droite moyenne.
-
Avec le
tableur Excel, on ajoute une courbe de tendance et comme
modèle ‘’linéaire’’
-
La courbe
obtenue est une droite qui passe pratiquement par l’origine. - On peut affirmer que la conductance G de la solution est proportionnelle à
la concentration
C de la solution, ceci
dans le domaine étudié.
-
On tire : G (mS) = 0,588 C (mmol / L)
2.
Conductance de la solution diluée
a.
Concentration C’ de la
solution diluée.
-
Exploitation graphique :
-
C’
≈ 4,6 mmol / L
-
C’
≈ 4,6 × 10– 3 mol / L
b.
Concentration C de la
solution injectable.
-
C
= 100 C’
-
C
≈ 100 × 4,6 × 10– 3
-
C
≈ 4,6 × 10– 1
mol / L
c.
Pourquoi a-t-il été nécessaire de diluer cette solution ?
-
La
concentration de la solution injectable est supérieure à la
concentration
de la solution S0.
-
Elle
n’appartient pas au domaine d’étude.
-
La loi n’est plus vérifiée pour les solutions trop
concentrées.
d.
Apport calcique d’une ampoule de solution injectable de 10,0 mL.
-
Par
définition : n (Ca2+) = [Ca2+]
. V
-
n (Ca2+)
≈ 4,6 ×
10– 1 × 10,0 × 10–
3
-
n (Ca
2+) ≈
4,6 × 10– 3 mol |
a)-
La conductivité d’une
solution ionique (rappels).
-
Cellule conductimétrique :
![]() Mesure
de la conductance d’une solution de chlorure de sodium :
Mesure
de la conductance d’une solution de chlorure de sodium :
►
Dispositif
expérimental :
Conductance et facteur d’influence..
-
Réglages : On
choisit le signal sinusoïdal :
-
On règle la
fréquence du
G.B.F
sur 500 Hz.
-
On règle la tension
U aux bornes de la
cellule sur 1,00 V.
-
On choisit la cellule conductimétrique :
S
= 1 cm2 et
ℓ
= 1 cm
-
Solution de chlorure de sodium de concentration
C
= 5,0 × 10– 3 mol / L.
►
Mesure :
|
I
= 1,08 mA |
Valeur de la
conductance :
|
|
U
= 1,00 V |
|
|
f
= 500 Hz |
-
Avant chaque
mesure, il faut rincer les électrodes à l’eau distillée.
-
Essuyer
délicatement les électrodes avec du papier absorbant, agiter doucement la
cellule dans la solution pour bien homogénéiser.
-
La conductance G
est proportionnelle à la concentration C
de la solution si C
< 1,0 ×10–2 mol / L.
-
G = k’
. C
-
D’autre part :
-
La conductance G
d’une portion de solution est proportionnelle au rapport
![]() .
.
-
Par définition, le
coefficient de proportionnalité est appelé :
-
Conductivité de la solution ionique que l’on note
σ ''sigma minuscule''.
-
On écrit :
|
|
G
est la conductance en siemens S |
|
S :
surface des
électrodes en m2. |
|
|
ℓ :
distance entre les électrodes en m. |
|
|
σ :
conductivité de
la solution en S . m– 1 |
-
La grandeur σ
est caractéristique de la solution.
-
Elle rend compte de
la capacité de la solution à conduire le courant électrique.
-
Elle ne dépend pas
de la géométrie de la cellule.
-
La grandeur σ
est liée à la nature et la concentration des ions présents dans la solution.
►
La
conductance G :
-
La
conductance G est l’inverse de la
résistance R d’une portion de solution.
-
G
dépend de la solution et des caractéristiques géométriques de la cellule de
mesure.
-
Pour s’affranchir de
ces caractéristiques, on définit la conductivité
σ à partir de la conductance :
-
G
= kcellule
. σ
-
La
grandeur kcellule
est la constante de la cellule.
-
Lorsqu’on réalise un
dosage avec un conductimètre, on utilise toujours la même cellule.
-
On réalise toujours un
étalonnage de l’appareil avant d’effectuer une série de mesures.
b)-
Conductivité molaire ionique.
-
À chaque ion d’une solution ionique, on affecte une
conductivité molaire ionique λ.
-
La conductivité
molaire ionique se rapporte à un ion donné.
-
Elle dépend de la
température, de la nature du solvant.
-
Elle ne dépend pas de la concentration si
C
< 1,0 × 10–2 mol / L.
-
Exemple pour les
ions sodium, on écrit :
-
λ (Na
+) = 5,01 × 10– 3 S
. m2 . mol–
1 dans l’eau.
-
Pour les ions
chlorure :
-
λ (Cl–)
= 7,63 × 10 –
3
S . m2 .
mol– 1 dans l’eau.
-
Remarque :
-
Dans une solution
électrolytique, ce sont les ions qui sont responsables du passage du courant.
-
Un courant dans une
solution est dû à la circulation des ions positifs et négatifs se déplaçant en
sens inverse.
-
Chaque ion dans la
solution contribue à la conductivité de celle-ci.
-
La conductivité σ
de la solution est égale à la
somme des
conductivités
due aux cations
et aux anions.
-
On écrit :
-
σ
=
σ (+) +
σ (–)
-
Formule générale :
-

-
La conductivité σ
d’une solution ionique dépend de la nature des ions présents Xi
et de leur concentration [ Xi
] respectives.
►
Conductivité molaire
ionique de quelques ions :
|
Ions |
λ
mS . m2 . mol– 1 |
|
Na+ |
5,01 |
|
H3O+ |
34,98 |
|
Cℓ– |
7,63 |
|
HO– |
19,86 |
►
Exemple :
-
Pour une solution
de chlorure de sodium :
-
Solution de
chlorure de sodium :
|
|
eau |
|
|
|
|
NaCℓ
(s) |
→ |
Na+
(aq) |
+ |
Cℓ–
(aq) |
-
Or : C
= [Cℓ–] = [Na+]
-
σ =
λ (Cℓ–) . [
Cℓ–
] + λ (Na+) . [
Na+
]
-
σ =
{λ
(Cℓ–)
+ λ (Na+)
} . C
-
Solution de
chlorure de baryum :
|
|
eau |
|
|
|
|
BaCℓ2
(s) |
→ |
Ba2+
(aq) |
+ |
2 Cℓ–
(aq) |
-
Or : [
Ba2+ ] = C
et [
Cℓ–
] = 2 C
-
σ
=
λ
(Cℓ–)
. [
Cℓ–
] + λ
(Ba2+)
. [
Ba2+
]
-
Expression en fonction de
C :
-
σ =
λ (Cℓ–).2 C
+ λ (Ba2+).
C
-
σ =
(2
λ
(Cℓ–).+
λ (Ba2+)
) . C
►
Remarque :
-
σ =
k . C
c)-
Énoncé de la loi de
Kohlrausch :
|
La conductivité σ d’une solution diluée d’une espèce ionique dissoute
est
proportionnelle à sa concentration molaire
C en soluté
apporté : |
|
σ =
k .
C |
|
σ
= k . C |
C ;
concentration en mol . L– 1
|
|
k :
coefficient de
proportionnalité en S . L .
m– 1. mol– 1
|
|
|
σ :
conductivité de
la solution en S . m– 1 |
-
À partir de la
mesure de la conductivité d’une solution, on peut déterminer la valeur de sa
concentration.
►
Remarque :
-
On peut le faire
aussi à partir de la valeur de la conductance si on ne possède pas de
conductimètre.
-
Remarque :
-
Les lois de
Beer-Lambert
et Kohlrausch
ont des équations analogues.
-
La solution colorée doit être suffisamment diluée,
C
≤ 1,0 × 10–2 mol . L–1,
et ne doit contenir qu’un seul soluté ionique.
IV-
La
détermination d’une quantité de gaz.
-
L’état gazeux est un
état dispersé.
-
À l’état
microscopique :
-
Les molécules ou les
atomes sont éloignés les uns des autres et se déplacent dans toutes les
directions de façon désordonnée.
-
Les interactions entre
les entités chimiques sont faibles.
- À l’état gazeux règne le chaos moléculaire
-
L’agitation des
molécules constituant un gaz, sous faible pression caractérise son état
thermique.
-
L’agitation des
molécules qui constituent un gaz est liée à une grandeur macroscopique :
-
la
température absolue du gaz, notée
T.
-
L’unité de température
absolue est le Kelvin : symbole K.
-
La température absolue
étant liée à l’agitation des molécules d’un gaz, on ne peut pas refroidir
indéfiniment un gaz.
-
Lorsque la température
diminue, l’agitation thermique diminue aussi.
-
Lorsque les molécules
sont immobiles, il n’y a plus d’agitation thermique et on ne peut plus refroidir
: c’est le zéro absolu.
-
En
l’absence de toute agitation thermique la température
T
= 0 K.
-
C’est le zéro absolu
où toutes les particules sont immobiles.
-
Au zéro absolu, la
température absolue est nulle, la pression est nulle et il n’y a plus
d’agitation thermique.
-
La température absolue
est une grandeur obligatoirement positive.
-
Relation : l’échelle de température Celsius (température notée
θ)
se déduit de la température absolue par la relation :
-
T
(K) = θ ° C
+ 273,15 ou T
(K) ≈ θ ° C
+ 273
2)- Équation d’état du gaz
parfait.
-
Un gaz est dit parfait
si la taille de ses entités est négligeable devant la distance qui les sépare et
si les interactions entre elles sont négligeables.
-
À basse pression, tous
les gaz peuvent être assimilés à des gaz parfaits.
►
Équation d’état du gaz
parfait :
|
P . V
= n . R . T |
|
|
P |
Pression en
pascal (Pa) |
|
V |
Volume en
mètre cube (m3) |
|
n |
Quantité de
matière en mole (mol) |
|
R |
Constant des
gaz parfaits : R = 8,314 Pa . m3 .mol–1
. K–1 |
|
T |
Température
absolue en kelvin (K) |
-
Pour un gaz réel :
-
P
. V
≈ n .
R
. T
si la pression est faible et si la température n’est pas trop basse.
-
Dans les conditions
habituelles de température et de pression, l’air (mélange de gaz) se comporte
comme un gaz parfait.
►
Application :
-
Les
briquets à gaz contiennent du butane liquide (C4H10).
-
La
pesée d’un briquet a donné une masse
m
= 20,51 g.
-
Grâce à
un tuyau souple, de faible section et adapté à l’orifice de sortie du gaz, on
recueille par déplacement d’eau un volume
V
= 1,5 L de butane dans une bouteille en matière plastique.
-
On pèse
alors le briquet : sa masse
m’ = 16,93 g.
-
Masse
molaire du butane M (C4H10)
= 58,1 g . mol–1.
-
Faire un schéma de
l’expérience.
-
Au
cours de l’expérience, la pression du gaz recueilli est égale à la pression
atmosphérique P = 1020 hPa et sa température
θ = 23,0 °C.
-
Calculer la quantité de matière
n de gaz qui s’est échappée du briquet
à partir du volume de gaz obtenu.
-
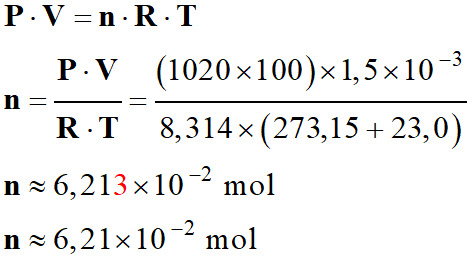
-
Calculer la quantité
de matière n
de gaz qui s’est échappée du briquet à partir des pesées :
-
m
(C4H10)
= m
– m’
-
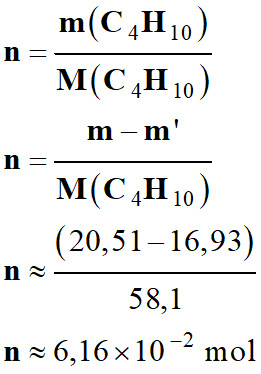
-
Les deux résultats
sont cohérents.
-
Volume d’une mole de
butane gazeux dans les conditions de l’expérience :
-
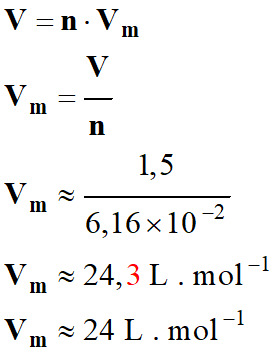
-
Température θ
= 23,0 °C.
-
Avec cette expérience
simple, on peut avoir une estimation du volume molaire d’un gaz.
3)- Volume molaire et
quantité de gaz.
-
Loi d’Avogadro – Ampère
:
-
Énoncé :
-
Des volumes égaux de
gaz différents, pris dans les mêmes conditions de température et de pression,
renferment le même nombre de molécules.
-
Il découle de cette
loi que des volumes égaux de gaz différents, pris dans les mêmes conditions de
température et de pression, renferment le même nombre de moles.
-
Ainsi :
-
Une mole de
dihydrogène, une mole de butane, une mole de méthane occupent le même volume
dans les mêmes conditions de température et de pression.
-
Tous les gaz ont le
même volume molaire.
-
Le volume molaire :
|
Le volume molaire d’un gaz parfait est le volume occupé par une
mole de ce gaz |
|
|
|
|
|
P |
Pression en
pascal (Pa) |
|
Vm |
Volume en
mètre cube par mole (m3. mol–1) |
|
R |
Constant des
gaz parfaits : R = 8,314 Pa . m3 .mol–1
. K–1 |
|
T |
Température
absolue en kelvin (K) |
-
Autre relation :
-
Le
volume molaire Vm
permet de relier la quantité de gaz
n
à son volume V.
-
V
= n
. Vm
1)- Groupes caractéristiques et fonctions.
|
Groupe caractéristique |
Famille
de composés |
Formule
générale |
|
– OH Hydroxyle |
Alcool |
R – OH |
|
Carbonyle |
aldéhyde |
 |
|
Cétone |
|
|
|
carboxyle |
Acide
carboxylique |
|
|
groupe ester |
Ester |
|
|
|
Alcène |
|
|
|
Amine
(Primaire) |
|
|
|
Amide |
|
-
Les solutions colorées
absorbent certaines radiations dans le domaine du visible, dont la longueur
d’onde est comprise entre :
-
400 nm
≤ λ
≤ 800 nm
-
Les solutions
incolores peuvent absorber des radiations dans le domaine ultraviolet :
-
Pour
une espèce chimique colorée, on peut tracer le graphe donnant l’absorbance
A
en fonction de la longueur d’onde
λ.
-
On obtient alors le
spectre d’absorption de l’espèce chimique.
-
Exemple : Spectre
d’absorption du diiode :
-
La valeur de la
longueur d’onde correspondant à l’absorbance maximale du spectre d’absorption
peut permettre l’identification d’une espèce chimique.
3)- Spectroscopie
infrarouge IR .
a)-
Présentation d’un spectre.
(tsch042010)
-
La spectroscopie IR
est une spectroscopie d’absorption.
-
Les composés
organiques absorbent aussi dans le domaine de l’infrarouge.
-
Pour ces spectres,
on fait figurer :
-
La transmittance T
ou intensité lumineuse transmise par l’échantillon analysé en ordonnée (elle
s’exprime en pourcentage)
-
Le nombre d’ondes σ
en abscisse.
-
Le nombre d’ondes σ
est l’inverse de la longueur d’onde λ.
-

-
Unité :
-
Généralement, le nombre d’ondes
σ
s’exprime en cm–1 en
chimie organique.
-
En chimie organique, les radiations
infrarouges exploitées vont de 400 cm–1
à 4000 cm–1. (25 μm à 250
μm)
-
Cette spectroscopie
peut se faire en phase gazeuse ou en phase condensée.
-
Exemple : Spectre
de la propanone.
-
Remarque :
-
Une faible valeur
de transmittance correspond à une forte absorption.
-
Les bandes
d’absorption sont orientées vers le bas.
-
L’axe des abscisses
est orienté vers la gauche. Cette échelle n’est pas toujours linéaire.
-
On distingue deux zones principales dans le spectre
IR :
►
Le
nombre d’onde compris entre 1500 et 4000 cm–1.
-
Cette zone ne
contient qu’un nombre limité de bandes, correspondant à des types de liaisons
particuliers.
-
Chaque bande est
caractérisée par :
-
Sa position dans le
spectre (la valeur du nombre d’onde du minimum de transmittance,
-
Sa largeur (bande
large ou fine),
-
Son intensité
(faible, moyenne ou forte), correspondant à la valeur minimale de la
transmittance.
►
Le
nombre d’onde compris entre 400 et 1500 cm–1.
-
Il s’agit d’une
zone très riche en bandes d’absorption pour les molécules organiques possédant
un ou plusieurs atomes de carbone.
-
Elle est
généralement exploitée qu’en comparaison avec un spectre de référence.
-
Cette zone
s’appelle l’empreinte digitale de la molécule.
-
Dans un spectre
infrarouge, la zone d’identification des groupes caractéristiques correspond à :
σ
> 1600 cm–1.
-
Les spectres IR
sont constitués d’une série de bandes d’absorption.
-
Chaque bande
d’absorption est associée à un type de liaison, principalement caractérisé par
les deux atomes liés et la multiplicité de la liaison.
-
Un spectre
infrarouge renseigne sur la nature des liaisons présentes dans une molécule.
-
Les bandes
d’absorption associées à chacune des liaisons rencontrées en chimie organique
correspondent à un domaine de nombre d’ondes bien précis.
-
Une table des absorptions caractéristiques des
liaisons dans le domaine de l’IR
donne les fourchettes des nombres d’onde (souvent l’allure des bandes) pour
différents types de liaison.
-
Un spectre infrarouge nous renseigne sur
la nature des liaisons présentes dans la molécule et permet d’en identifier les
groupes caractéristiques.
-
Les spectres IR
sont liés au fait que les atomes d’une molécule ne sont pas fixes, ils vibrent
autour d’une position d’équilibre.
-
Les vibrations
peuvent correspondre à une élongation longitudinale :

-
Les vibrations
peuvent correspondre à une déformation angulaire :

-
Les vibrations des
liaisons d’une molécule sont à l’origine de son spectre infrarouge.
-
Un spectre
infrarouge renseigne sur la nature des liaisons présentes dans une molécule et
sur les groupes caractéristiques qui sont présents dans la molécule.
d)-
Bandes d’absorption
caractéristiques.
-
Tableau simplifié :
|
Liaison |
σ (cm–1) |
Intensité |
|
–
O –
Hlib |
3580 à 3650 |
Forte |
|
–
O –
Hlié
ou
–
O –
Hassocié |
3200 à 3400 |
Forte |
|
Ctri
– H |
3000 à 3100 |
Moyenne |
|
Ctêt
–
HAromat |
3030 à 3080 |
Moyenne |
|
Ctri
–
H |
2800 à 3000 |
Forte |
|
Ctri
–
HAldéhyde |
2750 à 2900 |
Moyenne |
|
–
O –
HAcide
carb |
2500 à 3200 |
Forte |
|
1650 à 1730 |
Forte |
|
|
|
1680 à 1710 |
Forte |
|
Ctêt
– H |
1415 à 1470 |
Forte |
|
|
1050 à 1450 |
Forte |
|
|
1000 à 1250 |
Forte |
-
Les notations :
-
L’intensité
traduit l’importance de l’absorption.
-
–
O
–
Hlib sans liaison hydrogène et
–
O
– Hlié
avec liaison
hydrogène.
-
Ctri
correspond à un carbone trigonal engagé dans une double liaison.
-
Ctêt
correspond à un carbone tétragonal engagé dans quatre liaisons simples.
►
Bande
C = O
-
La liaison C = O
est présente dans de nombreuses molécules organiques telles que les aldéhydes,
cétones, acide carboxyliques, esters, amides,…
-
La position de la
bande d’absorption dépend de la nature de la fonction.
-
Elle est généralement comprise entre
1650 cm–1 et 1750 cm–1.
-
Lorsque la liaison
C = O est conjuguée à d’autres doubles
liaisons, la liaison C = O
est affaiblie et le nombre d’onde correspondant
diminue.
►
Bande
C – O
-
La liaison C – O
est présente dans les alcools, les acides carboxyliques,…
-
Sa bande d’absorption se situe entre
1070 cm–1 et 1450 cm–1.
-
Tableau à
connaître :
|
Liaison |
σ (cm–1) |
Bande |
|
– O – H
Alcool |
3200 – 3400 |
Bande forte
et
large |
|
–O – H
Acide
carboxylique |
2600 – 3200 |
Bande forte
et
large |
|
C = O
Aldéhyde
Cétone
Acide
carboxylique |
1700 – 1760 |
Bande forte
et
fine |
|
C = O
Ester |
1700 - 1740 |
Bande forte
et
fine |
|
C = C
Alcène |
1625 - 1685 |
Bande
moyenne |
|
N – H
Amine |
3100 - 3500 |
Bande
moyenne |
-
Une bande est forte
lorsque la valeur de la transmittance est faible.
-
Une bande est large
si elle s’étale sur un intervalle de nombre d’ondes important.
Groupe hydroxyle :

Groupe carbonyle :

Groupe carboxyle :

e)-
Exemples de spectres
infrarouges :
►
Spectre
IR de l’éthanol :
-
Spectre de
l’éthanol à l’état gazeux :
-
Spectre de
l’éthanol à l’état liquide :
-
Ci-dessus, on peut
observer les spectres infrarouges de l’éthanol à l’état gazeux et à l’état
liquide.
-
À l’état gazeux :
-
La liaison O – H
donne une bande moyenne et fine vers 3620 cm–1.
-
Il n’existe pas de liaison hydrogène entre les
molécules d’éthanol, la liaison O – H
est dite libre.
-
On la note O – Hlib.
- À l’état liquide :
-
La liaison O – H
se manifeste par une bande d’absorption forte et large de 3200 cm–1
à 3400 cm–1.
-
Les liaisons hydrogène établies entre les molécules
d’éthanol affaiblissent les liaisons covalentes
O – H et conduisent
à un abaissement du nombre d’onde σO
– H.
-
De plus, la bande s’élargit. La liaison
O – H est dans ce
cas dite associée, on la note O – Hassocié
ou O – Hlié.
-
Ce résultat est
général.
►
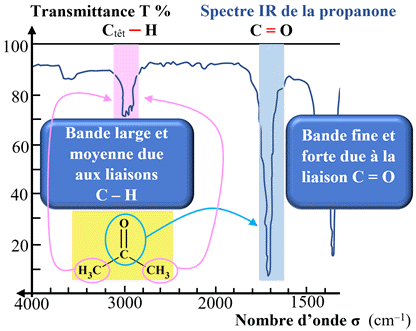
Cas de la propanone :
-
Les liaisons
C – H
donnent une bande large et moyenne de 2800 cm–1
à 3100 cm–1.
-
La double liaison
C = O
donne une bande fine et forte vers 1700 cm–1.
►
Acide éthanoïque :
-
Les liaisons
O – H
donnent une bande large et forte de 2500 cm–1
à 3200 cm–1.
- Pour les acides carboxyliques en solution concentrée, les molécules s’associent sous forme de dimères grâce à des liaisons hydrogène.
- On note un affaiblissement
important des liaisons
– O – H.
-
La
bande d’absorption relative aux liaisons
– O – H
se situe autour du nombre d’onde
σ ≈ 3000 cm–1.
-
Cette bande est
caractéristique d’un acide carboxylique.
-
La double liaison
C = O
donne une bande fine et forte vers 1700 cm–1.
►
Comparaison du spectre
IR du
propanal avec celui de la propanone.
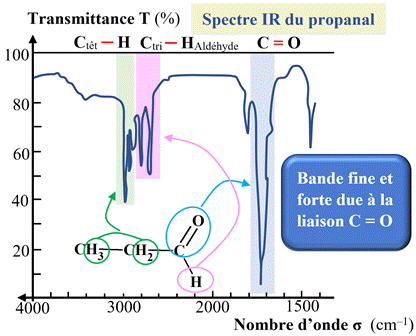
-
Dans ce
cas on travaille sur la partie comprise entre 1500 cm–1
et 4000 cm–1.
-
Les
deux spectres présentent une bande forte et fine centrée sur 1700 cm–1.
-
Cette
bande est caractéristique du groupe carbonyle
C
=
O.
-
Dans le
spectre IR
du propanal, on remarque la présence de deux bandes moyennes et fines entre 2750
cm–1 et 2900 cm–1,
caractéristiques de la liaison
Ctri –
HAldéhyde.
-
Ces deux bandes ne
sont pas présentes dans le spectre de la propanone.
-
Ces deux bandes
permettent de distinguer la molécule de propanal de la molécule de propanone.
1)- Dosage par étalonnage
conductimétrique.
-
Évolution de la
conductivité lors d’un titrage.
-
Dosage des ions
chlorure dans le lait.
Méthodes
d’analyse physique
Les dosages par
étalonnage
La détermination
d’une quantité de gaz
La spectroscopie
|
Préparation à l'ECE : Le sérum physiologique
1)- Exercice 04 page 40 : Utiliser la loi de
Beer-Lambert.
2)- Exercice 05 page 40 : Exploiter la loi de Kohlrausch.
3)- Exercice 06 page 40 : écrire l’expression d’une
conductivité.
4)- Exercice 08 page 40 : Utiliser l’équation d’état du
gaz parfait.
5)- Exercice 14 page 41 : Contrôle de qualité d’un
produit.
6)- Exercice 16 page 42 : La tyrosine.
7)- DS N° 01 : Sirop
de menthe glacial : exercice 23 page 46.
8)- DS N° 02 : Sol truffier (15 min) : exercice 24 page
47. |
|
|