|
Premier principe de la thermodynamique et bilan énergétique |
|
|
|
|
|
|
QCM N° 15
Premier principe de la thermodynamique et bilan énergétique.
Le modèle du gaz parfait et quelques limites.
L’énergie interne et les modes de transfert d’énergie.
Le premier principe de la thermodynamique.
Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La masse volumique d’un gaz de masse m et de volume
V s’écrit : |
|
|
|
B |
|
2 |
Les entités d’un
gaz considéré comme
parfait : |
Sont
ponctuelles |
Sont en
interaction |
Ne sont pas
en interaction |
AC |
|
3 |
Les entités d’un gaz qui ne peut être considéré comme parfait : |
Sont
ponctuelles |
Ont un
volume propre |
Ne sont pas
en interaction |
B |
|
4 |
L’énergie
interne U d’un système
macroscopique est égale à la
somme des énergies :
|
Cinétique et
potentielle de toutes les
entités
microscopiques
qui constituent
le système |
Cinétiques de toutes les
entités
microscopiques
qui constituent
le système |
Potentielles de toutes les
entités
microscopiques
qui constituent
le système |
A |
|
5 |
L’énergie totale
d’un système est
égale à : |
Son énergie
interne |
La somme
des énergies
mécanique
et interne |
Son énergie
mécanique |
B |
|
6 |
L’énergie peut
être transférée par : |
Travail |
Transfert
thermique |
Travail et
transfert
thermique |
ABC |
|
7 |
Pour le système
{Cornet de
glace}, le transfert
thermique Q
avec l’extérieur :
|
Est positif |
Est négatif |
S’effectue
du cornet vers
l’extérieur |
A |
|
8 |
La variation
ΔU d’énergie interne d’un
système au repos
macroscopique est : |
ΔU
= W + Q |
ΔU
= W – Q |
ΔU
= W × Q |
A |
|
9 |
L’ampoule électrique étant le système étudié, on attribue :
|
Un signe
positif à
l’énergie
qui sort
du système |
Un signe
négatif à
l’énergie
qui sort
du système |
La valeur 0 J À
l’énergie
qui sort
du système |
B |
|
10 |
La variation
ΔU d’énergie interne d’un
système incompressible
de masse m,
de capacité thermique massique c, qui passe d’une température initiale Ti
à une température finale Tf
s’écrit : |
ΔU =
m . c (Tf – Ti) |
ΔU =
m . c (Ti – Tf) |
ΔU =
m . c (Tf + Ti) |
A |
|
11 |
Si la
température d’un système
incompressible augmente alors
son énergie
interne : |
Augmente |
Diminue |
Ne varie pas |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Le gaz parfait :
|
GAZ PARFAIT |
|
|
À
l’échelle macroscopique
Grandeur physique |
À
l’échelle microscopique
Comportement |
|
Le gaz parfait est au repos à
la température T (K) |
Mouvement incessant et
désordonné des entités du gaz
Pas d’interaction entre
les entités assimilées à des
points matériels |
|
La pression P (Pa) est faible |
Pas de chocs entre les entités de gaz
Chocs seulement entre les entités
du gaz et la paroi |
|
La masse volumique
(kg . m–3) est très faible |
Les entités du gaz sont éloignées
les unes des autres. |
Masse volumique d'un gaz :
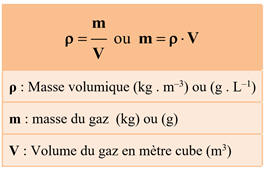
Équation d’état du gaz parfait :
|
P . V
= n . R . T |
|
|
P |
Pression en pascal
(Pa) |
|
V |
Volume en mètre
cube (m3) |
|
n |
Quantité de matière
en mole (mol) |
|
R |
Constante du gaz
parfait : R
= 8,314 Pa . m3 .mol–1 . K–1. |
|
T |
Température absolue
en kelvin (K) |
Quelques limites du modèle du gaz parfait.
Énergie interne U d’un système
Énergie mécanique d’un système macroscopique :
Énergie totale d’un système :
Système au repos macroscopique :
Deux modes de transfert de l’énergie :
Le travail W
Le transfert thermique Q
Travail et transfert thermique :
Le premier principe de la thermodynamique.
|
ΔUi→f
= W + Q |
|
ΔUi→f
: Variation d’énergie interne (joule : J) |
|
W :
Travail (électrique ou mécanique) (joule : J) |
|
Q :
Transfert thermique (joule : J) |
Énergie interne d’un système incompressible :
Transfert par chaleur produisant une élévation de
température (sans changement d’état) :
|
ΔU =
m . c . (θf
– θi
) = m . c . Δθ |
|
ΔU :
Variation d’énergie interne en joule (J) |
|
m :
masse de la substance en kilogramme (kg) |
|
c :
capacité thermique massique (J.kg – 1.°
C– 1) ou (J.kg – 1. K– 1) |
|
θf
– θi =
Δθ : Variation de température
en (°C) ou (K) |
|
ΔU = m . c . (Tf
– Ti
) = m . c . ΔT |
|
ΔU
: Variation d’énergie interne en joule (J) |
|
m :
Masse de la substance en en kilogramme (kg) |
|
c :
Capacité thermique massique (J . kg – 1.°
C– 1) ou (J.kg – 1.K– 1)
|
|
Tf
–Ti
= ΔT : Variation de
température absolue en
kelvin (K) |
|
|