![]()
Exercices
|
|
Force des acides et des bases Exercices |
|
|
|
|
|
QCM r
Force des acides et des
bases. La réaction d’un acide ou
d’une base avec l’eau. La constante d’acidité d’un couple acide-base. |
1)- Exercice 03 page 164 :Associer une constante d’équilibre à une équation de réaction :
|
Associer une constante d’équilibre à une équation de réaction : Soit l’équation : 2 H2O (ℓ)
1.
Parmi les expressions données ci-dessous,
identifier et nommer la constante d’équilibre associée à cette
équation :
-
2.
Une solution aqueuse a un pH de 4,6.
Calculer sa concentration en ions hydroxyde
HO–
(aq). |
|
Associer une constante d’équilibre à une équation de réaction : 1.
Identification
et nom de la constante
d’équilibre associée à cette équation : 2 H2O (ℓ)
-
Il s’agit de la réaction
d’autoprotolyse de l’eau : - La constante d’équilibre associée à cette réaction est Ke : - Produit ionique de l’eau
-
Ke = [H3O+]éq
. [HO
–]éq
= 1,0 × 10–14
-
Valeur numérique de Ke :
à
-
Qr,éq = [ H3O+
]éq . [HO –]éq
= Ke
≈ 1,0 × 10–14
-
L’autoprotolyse de l’eau a lieu dans
toute les solutions aqueuses.
-
La valeur du produit ionique de l’eau
Ke dépend de la température.
-
Ke
(grandeur sans unité)
-
Elle croît avec la température.
-
On utilise le pKe.
-
pKe= – log Ke.
=> Ke
= 10–pKe
-
Autres relations :
-
[H3O+ ]éq
= C0 . 10–pH
-
pH = pKe +
log [HO–]éq
-
[HO –]éq
= C0 . 10
pH – pKe 2.
Concentration en ions hydroxyde
HO– (aq).
-
La solution aqueuse a un
pH de 4,6 :
-
pH = 4,6
-
Par définition :
-
[H3O+ ]éq
= C0 . 10–pH
-
[H3O+
]éq = 1,0
× 10 – 4,6
-
[H3O+
]éq ≈ 2,5
× 10 – 5 mol . L–1
-
D'autre part :
-
Ke = [H3O+]éq
. [HO –]éq
= 1,0 × 10–14
-
[HO –]éq
= C0 . 10
pH – pKe
-
[HO –]éq
= 1,0 × 104,6–14
mol . L–1
-
[HO –]éq
≈ 1,0 × 10–9,4
mol . L–1
-
[HO –]éq
≈ 3,98
× 10–10 mol . L–1
-
[HO –]éq
≈ 4,0 × 10–10
mol . L–1 |
|||||||||
2)- Exercice 05 page 164 : Déterminer la composition finale d’une solution :
|
Déterminer la composition finale d’une solution : Une solution aqueuse, d’acide ascorbique de volume V = 500 mL, est obtenue en dissolvant n = 5,0 mmol d’acide ascorbique C6H8O6 (s) dans l’eau. Le pH de la solution est pH = 2,7. Déterminer la composition finale de la solution. |
|
Déterminer la composition finale d’une solution :
-
Composition finale de la solution :
-
Dissolution :
-
n = 5,0 mmol et
V = 500 mL
-
Acide ascorbique :
C6H8O6
(s)
-
pH = 2,7
-
Première étape :
-
La solubilité de l’acide ascorbique
dans l’eau est 330 g . L–1.
-
La dissolution est totale.
-
Deuxième étape :
-
Tableau d’avancement de la réaction :
-
Valeur de l’avancement maximal xmax
de la réaction :
-
L’avancement maximal xmax
serait atteint si l’acide éthanoïque était totalement consommé.
-
Dans ce cas :
-
n – xmax
= 0
-
xmax ≈ 5,0 mmol
-
xmax ≈ 5,0 × 10–3
mol
-
Valeur de l’avancement final xf
de la réaction :
-
On calcule la valeur de xf
à partir de la valeur du pH de la solution :
-
D’après de tableau d’avancement de la
réaction, on peut écrire que :
-
xf = nf
(H3O+)
-
D’autre part : pH = 2,7
qui est équivalent à
[H3O+]f
= C0 × 10– pH mol
. L–1
-
Avec C0 :
Concentration standard : C0 =
1,0 mol . L–1
-
xf = nf
(H3O+) = [H3O+]f
. V
-
xf ≈ 1,0
× 10–
2,7 ×
500,0 × 10–3
-
xf ≈ 9,97
× 10–4 mol
-
xf ≈ 1,0 × 10–3
mol
-
xf ≈ 1,0 mmol
-
On constate que : xf
< xmax
-
La réaction entre l’acide ascorbique
et l’eau est instantanée, mais n’est pas totale.
-
Le réactif limitant n’ayant pas
totalement réagi, les réactifs et les produits coexistent dans le mélange réactionnel à l’état final.
-
On peut compléter le tableau
d’avancement de la réaction :
-
Concentration des différentes espèces
présentes dans la solution :
-
Quantité de matière d’acide
ascorbique :
-
nf (C6H8O6)
= n –
xf ≈ 5,0 – 1,0
-
nf (C6H8O6)
≈ 4,0 mmol
-
Concentration en acide ascorbique à
l’équilibre chimique (état final) :
-
-
Quantité de matière d’ions ascorbate
et d’ions oxonium :
-
nf (C6H7O6–)
= nf (H3O+)
= xf ≈
1,0 mmol
-
Concentration en ions ascorbate et en
ions oxonium :
-
-
On peut calculer la constante
d’acidité de l’acide ascorbique :
-
-
Valeur du
pKA :
-
pKA = – log
KA
-
pKA ≈ 3,3
-
Il y a un problème au niveau de la
valeur du pH de la
solution d’acide ascorbique.
-
pKA de l’acide
ascorbique à 25 ° C : pKA1
= 4,17 et pKA2
= 11,6.
-
Acide ascorbique :
C6H8O6
-
L’acide ascorbique ne possède pas de
fonction acide carboxylique, mais il se comporte comme un acide
faible :
-
L’anion ascorbate est stabilisé par
délocalisation de la charge négative (forme mésomère).
-
L’ion ascorbate : C6H7O6–
|
3)- Exercice 07 page 164 : Justifier le caractère fort d’un acide :
|
Justifier le caractère fort d’un acide : Une solution aqueuse, de concentration C = 5,0 × 10–3 mol . L–1 en acide nitrique apporté et de volume V = 150 mL, a un pH égal à 2,3. L’équation de la réaction entre l’acide nitrique et l’eau
s’écrit : HNO3 (ℓ) + H2O
(ℓ) → NO3–
(aq) + H3O+ (aq) 1.
Construire un tableau d’avancement de la
réaction. 2.
Justifier le caractère fort de cet acide
dans l’eau en calculant le taux d’avancement final τ. |
Justifier le caractère fort d’un acide :
-
Acide nitrique : HNO3 (ℓ) + H2O
(ℓ) → NO3–
(aq) + H3O+ (aq)
-
Concentration en acide nitrique
apporté :
-
C = 5,0 × 10–3
mol . L–1
-
Volume de la solution :
-
V = 150 mL
-
pH de la solution :
-
pH = 2,3 1.
Tableau d’avancement de la réaction.
Équation
HNO3
(ℓ)
+
H2O (ℓ)
→
NO3–
(aq)
+
H3O+ (aq)
état
Avancement
x
(mmol)
n
(HNO3)
solvant
n
(NO3–)
n
(H3O+)
État initial
(mmol)
0
n
/
0
0
Au cours de la
transformation
x
n
– x
/
x
x
Avancement
Final
(mmol)
xf
n
– xf
/
xf
xf
Avancement
maximal
(mmol)
xmax
n
– xmax
/
xmax
xmax 2.
Taux d’avancement final τ et
caractère fort de cet acide dans l’eau.
-
Le taux d’avancement final d’une
réaction, noté τ (tau),
est le quotient de l’avancement final par l’avancement maximal :
τ
(tau)
Taux
d’avancement final (sans unité)
xf
Avancement final (mol)
xmax
Avancement maximal (mol)
-
Si τ = 0, la réaction n’a pas lieu.
-
Pour une réaction totale :
τ = 1 car
xf = xmax
-
Pour une réaction non totale :
0 < τ < 1 car
xf <
xmax
-
On peut exprimer cette grandeur en
pourcentage.
-
Quantité de matière n en acide
nitrique apporté :
-
n = C . V
-
n = 5,0 × 10–3
× 150 × 10–3
-
n ≈ 7,5 × 10–4 mol
-
Valeur de l’avancement maximal xmax
de la réaction :
-
L’avancement maximal xmax
serait atteint si l’acide nitrique était totalement consommé.
-
Dans ce cas :
-
n – xmax
= 0
-
xmax ≈ 7,5 × 10–4
mol
-
Valeur de l’avancement final xf
de la réaction :
-
On calcule la valeur de xf
à partir de la valeur du pH de la solution :
-
D’après de tableau d’avancement de la
réaction, on peut écrire que :
-
xf = nf
(H3O+)
-
D’autre part : pH = 2,3
qui est équivalent à [H3O+]f
= C0 × 10– pH mol
. L–1
-
Avec C0 :
Concentration standard : C0 = 1,0 mol . L–1
-
xf = nf
(H3O+) = [H3O+]f
. V
-
xf ≈ 1,0 × 10–
2,3 ×
150 × 10–3
-
xf ≈ 7,51
× 10–4 mol
-
xf ≈ 7,5 × 10–4
mol
-
Conclusion :
-
xmax ≈ xf
≈ 7,5 × 10–4 mol
-
-
La réaction entre l’acide nitrique
et l’eau est totale :
-
Définition : Acide fort dans l’eau :
-
La transformation modélisée par la
réaction entre l’acide AH (aq) et l’eau H2O
(ℓ) est totale :
-
En conséquence :
-
Le taux d’avancement de la réaction :
τ = 1
-
L’écriture de la réaction est la
suivante :
AH
(aq)
+ H2O (ℓ)
→
H3O+ (aq) +
A–
(aq)
-
La concentration en ions oxonium :
-
[H3O+]f
= [H3O+]max = C
-
C représente la concentration
en acide apporté.
-
pH de la solution obtenue :
-
pH = – log [H3O+]f
-
Le pH d’une solution diluée
d’acide fort, de concentration C en soluté apporté, est : pH
= – log C
Valable pour
10–2 mol . L–1 ≤
C ≤ 10–6
mol . L–1
-
Vérification :
-
pH = – log C
≈ – log(5,0 × 10–3)
-
pH ≈ 2,3
-
Ceci est bien en accord avec la
donnée de l’exercice.
-
L’acide nitrique est un acide fort.
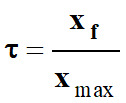
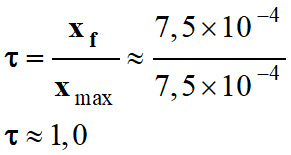
![]()
4)- Exercice 09 page 165 : Écrire une constante d’acidité :
|
Écrire une constante d’acidité : Les « fumeurs noirs » rejettent des solutions contenant entre
autres du sulfure d’hydrogène H2S. 1.
Écrire l’équation de la réaction entre le
sulfure d’hydrogène et l’eau. 2.
Exprimer la constante d’acidité KA
associée. 3.
Écrire la relation entre KA
et pKA.
-
Donnée :
H2S (aq) /
HS– (aq) |
Écrire une constante d’acidité : 1.
Équation de la réaction entre le sulfure
d’hydrogène et l’eau. H2S
(aq)
+ H2O (ℓ)
H3O+ (aq) +
HS–
(aq) 2.
Constante d’acidité KA
associée (écriture simplifiée).
-
3.
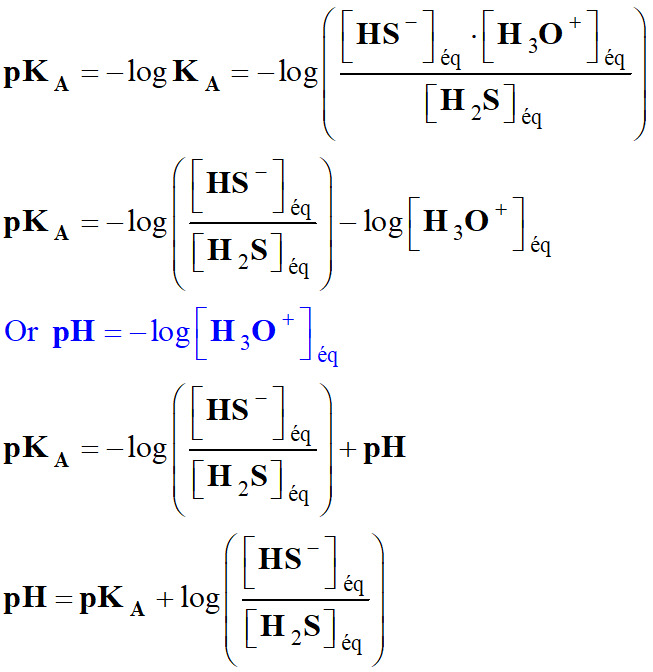
Relation entre KA et pKA.
-
pKA = – log
KA qui
équivaut à KA
= 10–pKA
-
En utilisant pKA =
– log KA
-
-
Les différents couples : Acide
Base
conjuguée
pKA
H2S
(aq)
HS–
(aq)
7,0
HS–
(aq)
S2–
(aq)
12,9
-
Le sulfure d’hydrogène est un gaz
inflammable, à l’odeur d’œuf pourri, peu soluble dans l’eau.
-
Il donne un acide faible, l’acide
sulfhydrique.
-
L’ion hydrogénosulfure ou
hydrosulfure HS–
(aq) est une espèce amphotère, c’est un ampholyte.
-
C’est la base conjuguée du sulfure
d’hydrogène et l’acide de l’ion sulfure S2–
(aq).
-
Les "fumeurs noirs" sont des sources
hydrothermales qui rejettent de l'eau.
-
La composition de l'eau est liée aux
roches rencontrées au cours de la remontée.
-
Elle contient principalement des
sulfures (surtout H2S),
-
du méthane
CH4,
-
du dioxyde de carbone CO2, ...
![]()
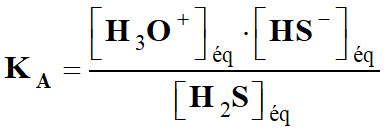

![]()
5)- Exercice 10 page 165 : Calculer une constante d’acidité :
|
La transformation modélisée par la réaction de l’acide lactique
C3H6O3 avec
l’eau n’est pas totale. 1.
Écrire l’équation de la réaction
correspondante. 2.
Exprimer la constante d’acidité KA
associée. 3.
Un état d’équilibre est caractérisé par :
-
[C3H5O3–]éq = [H3O+]éq
= 2,5 mmol . L–1.
-
En déduire la valeur de la
concentration [C3H6O3]éq.
-
Donnée :
-
pKA (C3H6O3
(aq) / C3H5O3– (aq)) = 3,9. |
|
Calculer une constante d’acidité : 1.
Équation de la réaction correspondante.
2.
Expression
de la constante d’acidité KA associée.
-
3.
Valeur de la concentration [C3H6O3]éq
:
-
On connaît la valeur du
pKA de l’acide lactique :
-
pKA
= 3,9 qui équivaut à KA
= 10–3,9.
-
-
Tableau d’avancement de la réaction :
-
D’après le tableau d’avancement, à
l’état final d’équilibre du système :
-
nf (C3H5O3–) = nf (H3O+) = xf
-
Dans la solution d’acide lactique
obtenue :
-
[C3H5O3–]f = [H3O+]f
= [C3H5O3–]éq
= [H3O+]éq
-
L’acide lactique :
-
Acide 2-hydroxypropanoïque.
-
Couple acide-base :
Acide lactique / Ion lactate :
C3H6O3
(ℓ)
-
La molécule d’acide lactique peut
former des liaisons hydrogène avec les molécules d’eau car elle
possède un groupe carboxyle et un groupe hydroxyle.
|
6)- Exercice 12 page 165 : Comparer la force de trois bases dans l’eau :
|
Comparer la force de trois bases dans l’eau : Trois solutions aqueuses sont obtenues en dissolvant dans l’eau de l’ammoniac NH3 (aq), de la méthylamine CH3NH2 (aq) et de l’hydroxylamine NH2OH (aq) de même concentration en soluté apporté. - En justifiant, attribuer à chaque solution le taux d’avancement final correspondant parmi les valeurs suivantes : τ
= 0,18 ; τ = 4,0 % et τ =
8,5 × 10–2.
-
Données :
-
pKA1 (NH4+
(aq) / NH3 (aq)) = 9,2
-
pKA2 (NH3OH+ (aq)
/
NH2OH
(aq)) = 9,9
-
pKA3 (CH3NH3+
(aq) / CH3NH2
(aq)) = 10,6 |
|
Comparer la force de trois bases dans l’eau :
-
Couple de l’ammoniac :
NH4+
(aq) / NH3 (aq) ; pKA1 = 9,2
-
Couple de la méthylamine :
NH3OH+ (aq) / NH2OH
(aq) ; pKA2 = 9,9
-
Couple de l’hydroxylamine :
CH3NH3+
(aq) / CH3NH2
(aq) ; pKA3 =
10,6
-
Concentration en soluté apporté :
C
-
Taux d’avancement final correspondant
parmi les valeurs suivantes :
-
τ = 0,18 ;
τ = 4,0 % et
τ = 8,5 × 10–2. - Le taux d’avancement final d’une réaction, noté τ (tau), est le quotient
de l’avancement final par l’avancement maximal :
-
Réaction entre l’ammoniac et l’eau :
-
Équation de la réaction :
-
Constante d’équilibre
KB de cette réaction :
-
-
Concentration en base apportée
NH3 (aq) : [NH3]app
= C
-
Volume de la solution :
V
-
Expression de
KB en fonction de
τ et C.
-
Tableau d’avancement de la réaction :
-
Avec : xmax =
C .
V et xf = nf (NH4+)
= nf (HO–)
-
-
Conservation de la matière :
-
[NH3]éq
+ [NH4+]éq
= [NH3]app
=
C
-
[NH3]éq
= C – [NH4+]éq
-
[NH3]éq
= C – [NH4+]éq
-
[NH3]éq
= C –
τ . C
-
[NH3]éq
= C . (1 –
τ)
-
Expression de la constante
d’équilibre KB
en fonction de taux τ :
-
-
L’ammoniac
NH3 est la
base conjuguée de l’ion ammonium
NH4+.
-
Couple acide / base :
NH4+
(aq) /
NH3 (aq) :
-
Réaction associée :
-
Expression de la constante
d’acidité :
-
-
Or :
-
-
Au plus
τ → 1, au plus
KA ↓ est petit
et l’acide est faible et la base conjuguée est forte.
-
Ce résultat est valable pour la
méthylamine CH3NH2 (aq) et de
l’hydroxylamine NH2OH (aq)
-
On peut représenter les différents
couples sur l’échelle des pKA.
-
Pour une même concentration
C en base apportée : - La base la plus forte est la méthylamine CH3NH2 (aq), de pKA3 = 10,6 et
de taux d’avancement le plus grand :
τ = 0,18 = 18 % - La base de force intermédiaire est l’hydroxylamine NH2OH (aq), de pKA2 = 9,9 et
de
taux d’avancement τ =
0,085 = 8,5 % - La base la plus faible est l’ammoniac NH3 (aq), de pKA1 = 9,2 et
de taux d’avancement
τ = 0,040 = 4,0 %
-
Or :
-
-
-
On peut en déduire la valeur de la
concentration C des
différentes solutions :
-
-
Pour la méthylamine
CH3NH2
(aq),
-
pKA3 =
10,6 => KA3 =
10–10,6
-
τ = 0,18 = 18 %
-
-
Vérification :
-
L’hydroxylamine
NH2OH (aq),
-
pKA2
= 9,9
-
τ = 0,085 = 8,5 %
-
C ≈ 1,0 × 10–2
mol . L–1.
-
-
On retrouve bien la valeur de
pKA2
= 9,9
-
Vérification pour l’ammoniac :
-
pKA1 =
9,2
-
τ = 0,040 = 4,0
%
-
C ≈ 4,8 × 10–3
mol . L–1.
-
-
Ce résultat est bien en accord avec
la valeur de la pKA1 =
9,2. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7)- Exercice 13 page 165 : Tracer un diagramme de prédominance :
|
Tracer un diagramme de prédominance : Le pH d’une solution contenant de l’acide nitreux HNO2
(aq) est pH = 4,5.
-
Identifier, en justifiant, l’espèce
prédominante du couple de l’acide dans la solution.
-
Donnée :
-
pKA (HNO2
(aq) / NO2–
(aq) = 3,3 |
|
Tracer un diagramme de prédominance : Le pH d’une solution contenant de l’acide nitreux HNO2 (aq) : - pH = 4,5.
-
Espèce prédominante du couple à
pH = 4,5.
-
pKA (HNO2
(aq) / NO2–
(aq) = 3,3
-
Diagramme de prédominance :
- À pH = 4,5, L’acide nitreux HNO2 (aq) prédomine devant l’ion nitreux NO2– (aq), sa base conjuguée car pKA < pH.
-
Couple acide / base :
-
Équation de la réaction de l’acide
sur l’eau :
-
Constante d’acidité :
-
-
La relation :
-
-
En conséquence : [NO2–]éq > [HNO2]éq
|
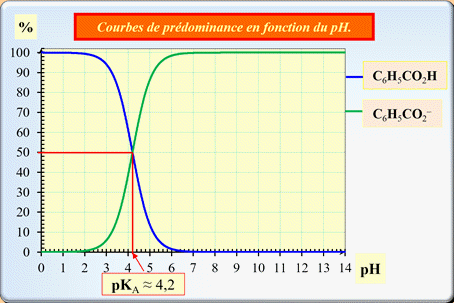
8)- Exercice 14 page 165 ; Exploiter un diagramme de distribution :
|
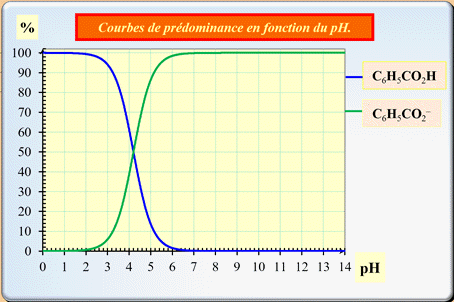
Exploiter un diagramme de distribution : Le diagramme ci-dessous représente les pourcentages des espèces acide benzoïque C6H5CO2H (aq) et ions benzoate C6H5CO2–
(aq) d’une solution en fonction du pH.
1.
En justifiant, associer chacune de ces
courbes à l’espèce correspondante. 2.
Déterminer graphiquement la valeur du pKA
du couple : C6H5CO2H
(aq) / C6H5CO2–
(aq). |
Exploiter un diagramme de distribution :
-
Couple :
C6H5CO2H (aq) / C6H5CO2–
(aq). 1.
Association de chacune de ces courbes à
l’espèce correspondante.
-
Graphe :
-
Équation de la réaction : C6H5CO2H
(aq)
+ H2O (ℓ)
H3O+ (aq) + C6H5CO2–
(aq)
-
Constance d’acidité :
-
-
La relation :
-
-
Permet de considérer trois cas :
►
Premier cas :
-
Si
-
L'acide et la base conjuguée ont la
même concentration.
►
Deuxième cas :
-
Si
-
La base
C6H5CO2–
(aq)
est l'espèce prédominante
►
Troisième cas :
-
Si
-
L’acide
C6H5CO2H (aq) est l’espèce
prédominante.
-
En conséquence, de façon générale,
-
L’espèce acide prédomine pour les
pH faibles :
courbe bleue.
-
L’espèce basique prédomine pour les
pH élevés :
courbe verte.
-
pH =
pKA pour : [C6H5CO2–]éq
= [C6H5CO2H]éq 2.
Détermination graphique de la valeur du
pKA du couple : C6H5CO2H
(aq) / C6H5CO2–
(aq).
-
Exploitation graphique :
►
Premier cas :
-
Si
-
L'acide et la base conjuguée ont la
même concentration.
-
pKA ≈ 4,2
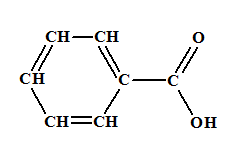
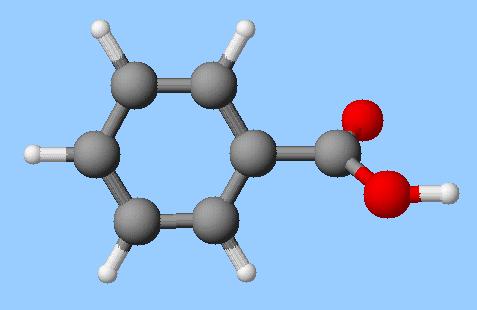
- Formule semi-développée de
l'acide benzoïque :
- Formule topologique : - Additif alimentaire E210 (conservateur alimentaire) - L’acide benzoïque C6H5
– COOH est utilisé comme conservateur (E 210) dans l’industrie agroalimentaire. - Il est
considéré comme un additif cancérigène, - Au laboratoire, on peut préparer
l’acide benzoïque à partir de l’alcool benzylique
C6H5CH2OH.
![]()
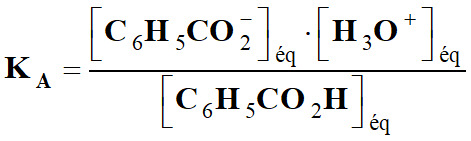
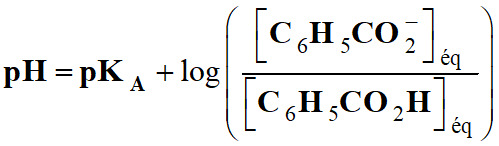
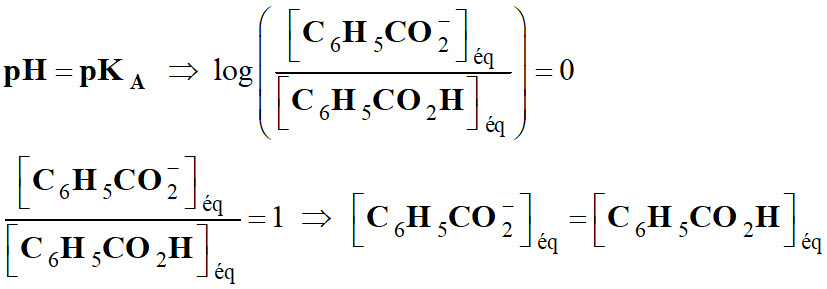
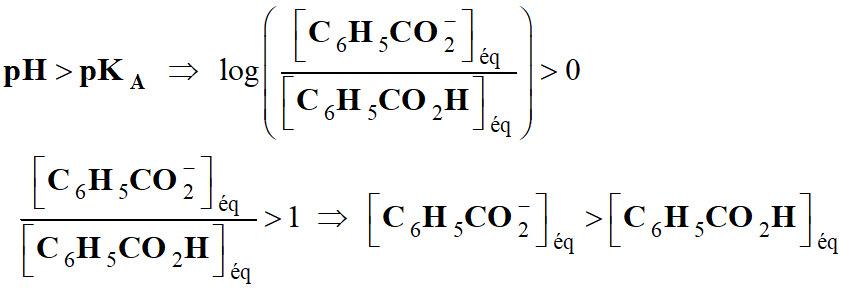
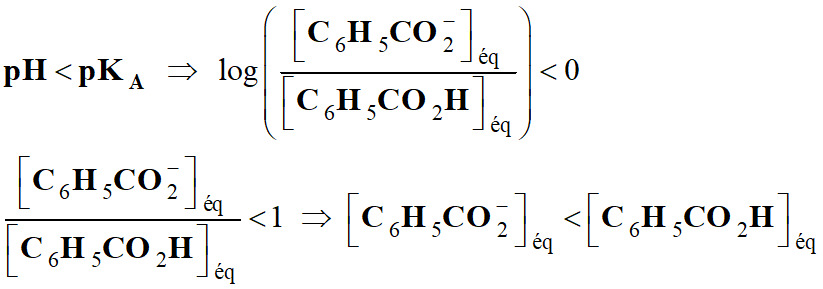
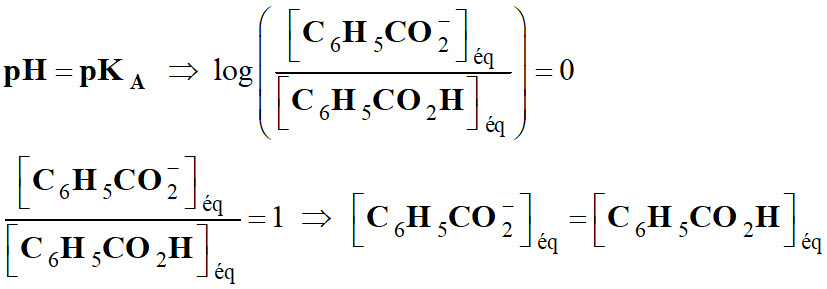

- Arôme: odeur d'amande
amère.![]()
9)- Exercice 15 page 165 : Justifier le choix d’un indicateur coloré :
|
Justifier le choix d’un indicateur coloré : La courbe de suivi pH-métrique du titrage d’une solution d’acide éthanoïque par une solution d’hydroxyde de sodium est donnée ci-dessous. Les teintes de l’indicateur coloré phénolphtaléine sont indiquées à côté de l’axe des ordonnées. 1.
Définir un indicateur coloré acido-basique. 2.
Pourquoi la phénolphtaléine est-elle un
indicateur coloré adapté à ce titrage ? |
Justifier le choix d’un indicateur coloré : 1.
Définition d’un indicateur coloré
acido-basique.
-
Les indicateurs colorés sont
constitués par des couples acide faible / base faible dont les
espèces conjuguées ont des teintes différentes.
-
Écriture symbolique :
Hind
(aq)
+
H2O
(ℓ)
Ind–
(aq)
+
H3O+
(aq)
Teinte (1)
Teinte (2)
-
-
On admet, de façon générale, que
l'indicateur coloré prend sa teinte acide si :
-
-
On admet, de façon générale, que
l'indicateur prend sa teinte basique si :
-
-
Dans la zone de pH, comprise
entre :
-
pKAi
–1 ≥ pH ≥ pKAi
+1, l’indicateur coloré prend sa teinte sensible.
-
Les couleurs des teintes acide et
basique se superposent.
-
Cette zone est appelée zone de virage
de l’indicateur coloré.
pKAi
– 1
...pKAi
…….pKAi
+ 1
Couleur de InH…..
Zone de Virage
.. Couleur de
In–…
Teinte acide Teinte
sensible Teinte
basique
-
Il se peut que la zone de virage soit
supérieure à 2 unités pH si l’œil a du mal à distinguer les
deux couleurs. 2.
La phénolphtaléine est un indicateur coloré
adapté à ce titrage :
-
Un indicateur coloré acido-basique
est adapté à un titrage si la zone de virage de l’indicateur coloré
contient le pH à l’équivalence pHE du
titrage.
-
L’utilisation d’un indicateur coloré
permet de repérer visuellement l’équivalence d’un titrage
acido-basique grâce au changement de teinte du mélange réactionnel.
-
Dans le cas présent,
pHE ≈ 8,6
-
8,2<
pHE < 10
-
La phénolphtaléine est un indicateur
coloré adapté à ce titrage car la zone de virage de l’indicateur
coloré contient le pH à l’équivalence pHE
du titrage.
![]()
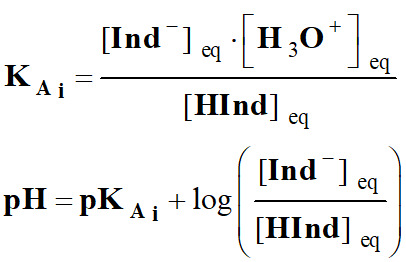
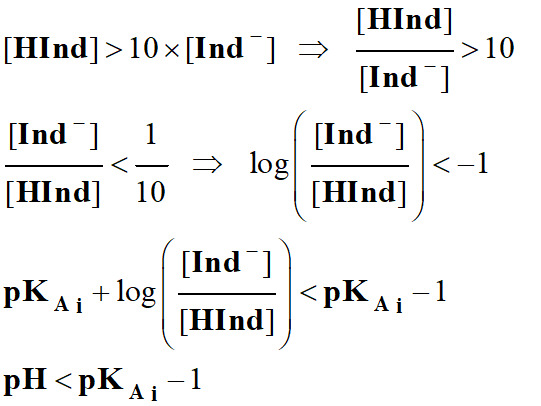
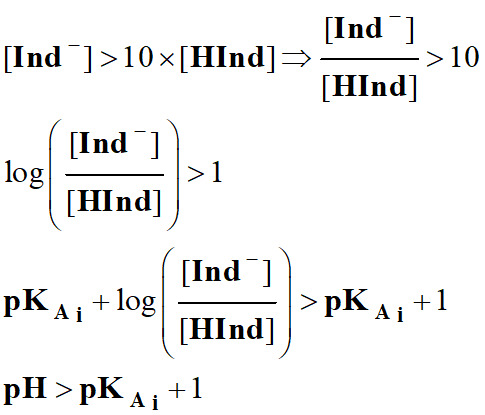
![]()
10)- Exercice 17 page 166 : Reconnaître un effet tampon :
|
Reconnaître un effet tampon : On dispose de différentes solutions :
1.
Parmi les solutions S1 et
S3, identifier celle qui pourrait âtre une
solution tampon. Justifier. 2.
Proposer d’autres tests qui permettraient de
valider cette hypothèse. |
|
Reconnaître un effet tampon : 1.
Solution tampon.
-
Une solution tampon est une solution
dont le pH varie faiblement lors de l’addition modérée :
-
D’un acide,
-
D’une base,
-
Ou par une dilution modérée.
-
Une telle solution contient un acide
faible et sa base conjuguée en concentrations voisines.
-
Le pH d’une telle solution est
voisin du pKA du couple acide / base considéré.
-
L’étalonnage du pH-mètre
nécessite l’utilisation de deux solutions étalons (solutions
tampons) de pH connu.
-
La solution
S3 est une
solution tampon.
-
C’est un mélange équimolaire de
l’acide éthanoïque et de sa base conjuguée, l’ion éthanoate :
-
Couple
CH3CO2H (aq) /
CH3CO2–
(aq)
-
En conséquence, [CH3CO2H]éq
= [CH3CO2–]
éq
-
Or :
-
-
On remarque, que lors de l’ajout de
la solution d’acide chlorhydrique, le
pH de la solution
S3 varie peu (
pH = 4,71).
-
D’autre part, l’acide chlorhydrique
est un acide fort :
-
On remarque que :
pH = – log C.
-
L’acide éthanoïque est un acide
faible : pKA =
4,75. 2.
Autres tests.
-
À la solution
S3 , on peut ajouter :
-
Un peu de solution de base (la
soude),
-
Un peu d’eau (dilution).
|
11)- Exercice 20 page 166 : Les couleurs des hortensias :
|
Les couleurs des hortensias :
Les couleurs rouge, mauve, violette et bleue des hortensias sont dues à la présence d’anthocyanes dans les pétales. La couleur violette est due à une molécule que l’on notera AH dans la suite. La molécule AH appartient
à deux couples acide-base : AH2+ (aq) / AH
(aq) de pKA1 =
4,3 et AH (aq) / A– (aq)
de pKA2 =
7,0. La présence des espèces AH2+ (aq),
AH (aq) et A– (aq) en solution donne, respectivement, une coloration rouge, violette et bleue aux
pétales. 1.
Écrire les équations des réactions des
acides AH2+ (aq) et AH (aq) avec
l’eau. 2.
Construire le diagramme de prédominance des
espèces AH2+ (aq), AH (aq) et
A– (aq). 3.
Associer des constances d’acidité ci-dessous
aux équations de la question 1 :
-
4.
Identifier l’acide le plus fort dans l’eau. 5.
Calculer la constance d’acidité du couple
pKA2 du
couple AH (aq) / A– (aq). 6.
Une solution S contenant l’espèce
AH (aq) a un pH égal à 10. a.
Exprimer puis calculer la valeur du rapport
b.
En déduire la couleur de la solution. 7. Le pH dans les cellules des pétales varie en sens inverse du pH du sol. Expliquer pourquoi et comment il
est possible de faire passer de rose à bleu des fleurs d’un hortensia. |
|
Les couleurs des hortensias :
-
Les couples :
-
AH2+
(aq) / AH (aq) de pKA1 = 4,3
-
AH (aq) / A–
(aq) de pKA2 =
7,0. 1.
Équations des réactions des acides AH2+
(aq) et AH (aq) avec l’eau.
-
Couple AH2+
(aq) / AH (aq) :
-
Couple AH (aq) / A–
(aq) :
2.
Diagramme de prédominance des espèces AH2+
(aq), AH (aq) et A– (aq). 3.
Expression des constances d’acidité :
-
Couple AH2+
(aq) / AH (aq) :
-
Couple
AH (aq) /
A– (aq) :
-
4.
Identification de l’acide le plus fort dans
l’eau.
-
Un acide AH (aq) est d’autant
plus fort dans l’eau que le pKA du couple
auquel il appartient est petit (ou son KA
grand)
-
Une base A– (aq)
est d’autant plus forte dans l’eau que le pKA
du couple auquel elle appartient est grand (ou son KA
petit).
-
Échelle des
pKA :
-
L’acide de plus fort est AH2+
(aq) : pKA1 <
pKA2.
-
AH2+
(aq) est un acide plus fort que AH (aq) 5.
Valeur de la constance d’acidité du couple
pKA2 du
couple AH (aq) / A– (aq).
-
Couple
AH (aq) /
A– (aq) :
-
-
pKA2 =
– log (KA2)
équivalent à : KA2 =
10–pKA2
-
KA2 =
10–7,0
-
KA2 ≈
1,0 × 10–7 6.
Une solution S contenant l’espèce
AH (aq) a un pH égal à 10. a.
Expression et
valeur du rapport
-
Ce rapport fait intervenir l’équation
suivante :
-
-
-
On tire :
-
-
Valeur du rapport :
- b.
Couleur de la solution.
-
Or [A–]
>> [AH], la couleur qui
prédomine est celle de A–
(aq).
-
La solution est de couleur bleue. 7.
Passage de rose à bleu des fleurs d’un
hortensia.
-
Le
pH dans les cellules des
pétales varie en sens inverse du
pH du sol.
-
Pour passer de la couleur rouge à la
couleur bleue, le pH dans
les cellules des pétales doit augmenter.
-
En
conséquence, il faut faire diminuer la valeur du
pH du sol. |
13)- Exercice 22 page 167 : Résoudre une équation du second degré :
|
Résoudre une équation du second degré : On dispose d’une solution aqueuse de concentration C = 1,0
× 10–1 mol . L–1 en acide faible AH
(aq) apporté. 1.
Exprimer la constante d’acidité du couple
AH (aq) / A– (aq) 2.
Établir l’équation du second degré vérifiée
par [H3O+]. 3.
Calculer la valeur du pH de la
solution.
-
Données :
-
pKA (AH
(aq) / A– (aq)) = 3,5 |
|
Résoudre une équation du second degré :
-
Données :
-
Couple :
AH (aq) / A–
(aq)
-
C = 1,0 × 10–1
mol . L–1
-
pKA = 3,5 1.
Expression la constante d’acidité du couple
AH (aq) / A– (aq)
-
Soit la réaction suivante :
-
Expression de la constante
d’acidité :
-
-
-
Tableau d’avancement :
-
À l’état final d’équilibre :
-
nf (A–) = nf
(H3O+)
-
[A–]éq =
[H3O+]éq
-
Or : nf (AH) = n – xf
-
[AH]éq =
C – [A–]éq
-
[AH]éq =
C – [H3O+]éq
-
3.
Valeur du pH de la solution.
-
Étude de l’équation du second degré :
-
Signe du discriminant :
-
-
Car
KA et
C sont des grandeurs
positives.
-
L’équation possède deux racines
réelles.
-
-
Seule la solution positive a un sens
en chimie :
-
-
Concentration en ions oxonium de la
solution acide :
-
-
Valeur du
pH de la solution :
-
pH ≈ 2,26
-
pH ≈ 2,3 |
|
|