|
|
Évolution d’un système siège d’une
transformation nucléaire |
|
|
|
|
|
I-
La désintégration radioactive. 3)- Radioactivité
α,
β+
et
β–. |
|
II- Loi de décroissance radioactive.
2)- La constante radioactive λ. |
|
III-
Applications et
radioprotection. 1)- Activité d’un
échantillon. |
|
QCM r
|
|
Exercices : énoncé avec correction Préparation à l'ECE : Le technétium 1)- Exercice 03
page 122 : Reconnaître les particules : 2)- Exercice 05
page 122 : Utiliser les lois de conservations. 3)- Exercice 07
page 122 : écrire une équation de réaction nucléaire. 4)- Exercice 09
page 122 : Déterminer un type de radioactivité. 5)- Exercice 11
page 123 : Utiliser le diagramme (Z,
N). 6)- Exercice 13
page 123 : Déterminer un nombre de noyaux radioactifs. 7)- Exercice 15
page 123 : Calculer une durée. 8)- Exercice 17
page 124 : Déterminer une demi-vie. 9)- Exercice 19
page 124 : Utiliser une activité. 10)- Exercice 21
page 124 : Mesures de radioprotection pour une scintigraphie. 11)- Exercice 23
page 125 : La découverte d’un élément radioactif. 12)- Exercice 25
page 125 : Des galères grecques à Marseille. 13)- DS 01 : La découverte de la radioactivité artificielle et ses applications (60 min) : Exercice 32 page 128. 14)- DS 02 :
Datation à l’uranium 238 (40 min) : exercice 33 page 129
|
I- La désintégration
radioactive.
-
La radioactivité a été découverte par
Henri BECQUEREL
en 1896 (1852 – 1908).
-
Il découvre la radioactivité de
l’uranium au cours de travaux sur la phosphorescence.
-
Les travaux sont poursuivis par
Pierre et Marie CURIE.
-
En 1898, ils découvrent la
radioactivité du polonium 210 (Polonium)
et du radium 226 (Radium).
-
En 1903 : prix Nobel de physique (Henri
BECQUEREL avec Pierre et Marie CURIE).
-
La radioactivité artificielle fut mise
en évidence en 1934 par Irène et Frédéric
JOLIOT – CURIE.
-
Ils ont créé par réaction nucléaire un
isotope radioactif du phosphore.
-
Ils bombardent une feuille d’aluminium
avec des particules α.
-
On connaît actuellement, une
cinquantaine de nucléides naturels radioactifs et environ 3000 nucléides
artificiels radioactifs.
-
La
radioactivité est un phénomène physique
naturel,
aléatoire et
spontané, qui
concerne certains noyaux.
-
La cohésion du noyau est due à
l’existence d’une interaction forte, attractive qui unit l’ensemble des nucléons
et qui prédomine devant l’interaction électrique (répulsion entre les protons).
-
Il y a antagonisme entre l’interaction
forte et la répulsion des protons.
-
Dans certains cas la cohésion n’est pas
suffisante, on dit que les noyaux sont instables.
-
Un noyau est instable s’il possède trop
de protons par rapport au nombre de neutrons.
-
Un noyau est instable s’il possède trop
de neutrons par rapport au nombre de protons.
-
Un noyau est instable s’il possède trop
de protons et trop de neutrons (trop de nucléons).
-
Ils se désintègrent spontanément, on
dit qu’ils sont radioactifs.
-
Ce sont des radionucléides.
3)- Radioactivité
α,
β+
et β–.
-
Une source radioactive peut émettre :
-
Des particules
-
Un rayonnement
γ.
-
Les particules émises sont de trois
types : les particules α,
β+et
β–.
►
Les particules α (alpha).
-
Ce sont des particules positives, des
noyaux d’hélium dont l’écriture symbolique :
- ![]() , ion
He2+.
, ion
He2+.
-
Ces particules sont éjectées à grande
vitesse v
≈ 2 × 107 m . s–1.
-
Ce ne sont pas des particules
relativistes.
-
Les particules sont directement
ionisantes mais peu pénétrantes.
-
Elles sont arrêtées par une feuille de
papier et par une épaisseur de quelques centimètres d’air.
-
elles
pénètrent la peau sur une épaisseur de l’ordre de quelques micromètres.
-
Elles ne sont pas dangereuses pour la
peau.
-
En revanche, elles sont dangereuses par
absorption interne : inhalation, ingestion.
►
Les particules β (bêta).
-
On distingue :
-
Les particules β–
(bêta moins) qui sont des électrons :
-
Symbole :
![]()
-
Masse : me
= 9,1 × 10–31 kg
-
Charge :
- e
= – 1,60 × 10–19 C.
-
Les particules β+
(bêta plus)
qui sont des positons (antiparticule de
l’électron).
-
Symbole :
![]()
-
Masse : me
= 9,1 × 10–31 kg
-
Charge :
e =
1,60 × 10–19 C.
-
Les particules sont émises à grande
vitesse v
≈ 2,8 × 108 m . s–1.
-
Ce sont des particules relativistes
(leur vitesse est voisine de celle de la lumière).
-
Elles sont plus pénétrantes mais moins
ionisantes que les particules α.
-
Elles sont arrêtées par un écran de
Plexiglas ou par une plaque d’aluminium de quelques centimètres.
-
Elles pénètrent la peau sur une
épaisseur de quelques millimètres.
-
Elles sont dangereuses pour la peau.
►
Le rayonnement γ (gamma).
-
Il accompagne l’émission de particules
α,
β+et
β–.
-
Il est constitué
d’une onde électromagnétique de très courte longueur d’onde
-
(λ
≈ 10–12
m et
υ ≈ 10
20 Hz).
-
Le rayonnement est
constitué de photons qui se déplacent à la vitesse de la lumière et dont la
masse est nulle.
-
Ils ne sont pas
directement ionisants, mais ils sont très pénétrants.
-
Ils peuvent traverser jusqu’à
-
Par interaction
avec les atomes des substances traversées, ils peuvent donner naissance à des
électrons qui eux sont ionisants.
![]() Conclusion :
Conclusion :
-
Au cours d’une
désintégration radioactive,
un noyau instable
se transforme spontanément en un noyau
d’un autre élément chimique.
-
Cette désintégration s’accompagne de
l’émission d’une particule et d’un rayonnement gamma.
-
Le noyau qui se désintègre est appelé :
-
le
noyau-père:
-
et le noyau formé est appelé :
-
Le
noyau-fils,
-
Il existe trois types de radioactivité,
caractérisés par la particule émise lors de la désintégration du noyau
radioactif :
-
Tableau :
|
Particule émise |
Symbole |
Type de radioactivité |
|
Électron |
|
β–
(bêta moins) |
|
Positon |
|
β+
(bêta plus) |
|
Noyau d’hélium 4 |
|
α
(alpha) |
-
Une
particule, α,
β+ou
β–,
4)- Équation de réaction de désintégration nucléaire.
-
Une réaction de désintégration
radioactive est modélisée par une équation.
-
Cette équation vérifie les lois de
conservation suivantes :
-
Conservation du nombre de charge Z.
-
Conservation du nombre de masse A.
-
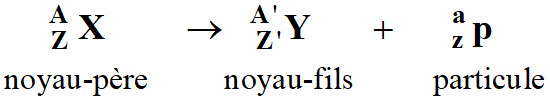
-
Lois de Soddy :
-
Conservation du nombre de masse
A :
A = A’ + a
-
Conservation du nombre de charge
Z :
Z = Z’ + z
►
Remarque :
-
Lors d’une réaction nucléaire, il n’y a
pas conservation des éléments chimiques.
-
Dans les équations de réactions
nucléaires, on écrit uniquement les particules possédant une charge ou une
masse.
-
Les rayonnements gamma n’apparaissent
pas.
-
Les trois types de radioactivité :
|
|
|
|
|
|
►
Exemples :
►
Radioactivité α :
-
Un noyau lourd instable éjecte une
particule α
et donne un noyau-fils plus léger, généralement dans un état excité.
-
L’uranium 238 est émetteur α.
-
Écrire l’équation de la réaction.

►
Radioactivité β– :
-
Cette radioactivité se manifeste
lorsque le noyau présente un excès de neutrons.
-
Le césium 137 est émetteur β–.
-
Écrire l’équation de la réaction.

-
Le noyau-père possède trop de
neutrons :
![]()
►
Radioactivité β+ :
-
Cette radioactivité se manifeste
lorsque le noyau d’un atome possède trop de protons.
-
Au cours de la désintégration, il y a
émission d’un positon noté
![]() .
.
-
L’oxygène 14 est émetteur
β+.
-
Écrire l’équation de la réaction.
![]()
-
Le noyau-père possède trop protons :
![]()
-
Pour un élément chimique donné,
certains isotopes sont stables tandis que d’autres ne le sont pas.
-
Il sont donc radioactifs.
-
Le diagramme (N,
Z) indique les isotopes stables ou
radioactifs.
-
Il donne aussi le type d’émission
radioactive des isotopes instables.
-
Dans ce diagramme, on porte :
-
En
abscisse, le nombre
N de neutrons du
noyau
-
En
ordonnée, le nombre de protons du noyau.
-
Chaque isotope y est représenté par
une case.
-
On retrouve sur une même ligne les
isotopes d’un même élément.
-
L’ensemble des noyaux stables (en
rouge) forme sur la représentation graphique
la vallée de stabilité.
-
Les noyaux légers stables ont une
tendance à la symétrie.
-
Ils se répartissent au voisinage de la
première bissectrice (N
= Z autant
de protons que de neutrons).
-
Les noyaux lourds stables s’écartent de
la bissectrice. Ils ont plus de neutrons que de protons.
-
Pour les noyaux instables :
-
En bout de la vallée de stabilité, ils
se désintègrent en émettant des particules alpha : ils sont radioactifs alpha.
-
Au-dessous de la vallée de stabilité,
ils sont émetteurs β–.
-
Au-dessus du domaine de stabilité, ils
sont émetteurs β+.
-
Tableau réduit :
-
Légende :
|
|
Émetteur α |
|
|
Émetteur β+ |
|
|
Stable |
|
|
Émetteur β- |
-
Le logiciel Nucleus Win :
-
Il permet d’obtenir des renseignements
sur les différents nucléides d’un élément chimique.
-
En noir les noyaux stables
-
En orange les noyaux instables
émetteurs β+
-
En bleu les noyaux instables émetteurs
β–
-
En jaune les noyaux instables émetteurs
α
-
Cas de l’élément oxygène :
-
L'oxygène possède 17 isotopes connus de
nombre de masse variant de 12 à 28.
-
Les isotopes les plus
stables sont : 16O,
17O
et 18O,
-
16O
est ultra-majoritaire dans la nature (plus de 99,76 % de l'oxygène naturel).
-
L'oxygène naturel est constitué des
trois isotopes stables.
-
12O
est un isotope très instable. C’est un nucléide émetteur de proton.
-
L’émission d’un proton est aussi un
type de désintégration radioactive.
-
De même,
25O
est un nucléide émetteur de neutron (autre type de
désintégration radioactive).
-
Il donne un isotope avec un neutron de
moins.
-
Quelques nucléides de l’oxygène :
-
Les noyaux émetteurs
β+

-
Les noyaux stables avec l’abondance :

-
Les noyaux émetteurs
β–
II- Loi de décroissance radioactive.
1)- Caractère aléatoire d’une désintégration radioactive.
-
Un noyau instable est susceptible de
revenir à l’état stable à tout moment.
-
Le phénomène de désintégration est
imprévisible.
-
Pour un noyau instable donné, on ne
peut prévoir la date de sa désintégration.
-
En revanche, on connaît la probabilité
de désintégration de ce noyau par unité de temps.
-
Le phénomène de désintégration est
aléatoire.
-
La probabilité qu’a un noyau radioactif
de se désintégrer pendant une durée donnée est indépendante de son âge.
-
Elle ne dépend que du type de noyaux
considéré.
-
Un noyau de carbone 14 apparu, il y a
mille ans et un autre formé, il y a 5 min ont exactement la même probabilité de
se désintégrer dans l’heure qui vient.
-
Un noyau ne vieillit pas.
-
Ce caractère aléatoire fait que pour un
ensemble de noyaux instables identiques, on ne peut prévoir lesquels seront
désintégrés à une date donnée, mais on peut prévoir combien de noyaux seront
désintégrés.
-
On peut prévoir avec précision
l’évolution statistique d’un grand nombre de noyaux radioactifs.
-
C’est un phénomène sur lequel il est
impossible d’agir.
-
Il n’existe aucun facteur permettant de
modifier les caractéristiques de la désintégration d’un noyau radioactif.
2)- La constante radioactive λ.
-
Chaque nucléide radioactif est
caractérisé par une constante de désintégration radioactive
λ, qui est la
probabilité de désintégration d’un noyau par unité de temps.
-
Elle s’exprime en s–1.
-
La constante
λ ne dépend que du
nucléide.
-
Elle est indépendante du temps, des
conditions physiques et chimiques.
-
Pendant la durée
Δt,
-
la probabilité, pour qu’un noyau se
désintègre, est : λ
. Δt.
3)- Loi de décroissance radioactive.
-
Considérons un échantillon contenant :
-
N0
noyaux radioactifs à la date t0.
-
N (t)
noyaux radioactifs à la date t.
-
A la date
t +
Δt très proche de
t, le nombre
de noyaux radioactifs a diminué.
-
Pendant l’intervalle de temps
Δt très court, on
peut considérer que le nombre de noyaux ayant subi une désintégration est :
λ .
Δt . N.
-
ΔN (t)
= N (t)
– N0
< 0
-
La variation
ΔN du nombre
N de noyaux pendant
la durée Δt
est donnée par la relation :
-
ΔN (t)
= – λ .
Δt . N (t)
soit :
-
ΔN (t)
+ λ
. Δt . N (t)
= 0
(1)
-
Divisons l’expression (1) par
Δt, il vient :
-
![]()
-
Lorsque
Δt → 0,
l’expression (2) s’écrit :
-
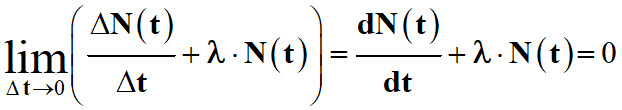
-
La grandeur
![]() représente la dérivée de
N (t)
par rapport au temps t.
représente la dérivée de
N (t)
par rapport au temps t.
-
![]()
-
On est en présence d’une équation
différentielle du premier ordre sans second membre.
-
La solution de cette équation
différentielle du premier ordre donne la loi de décroissance radioactive :
-
L’évolution, au cours du temps, du
nombre N (t)
de noyaux radioactifs d’un échantillon peut être modélisée par la loi de
décroissance radioactive :
|
N (t) = N0
. exp ( – λ . t) ou N
(t)
= N0
e – λ . t |
|
|
N
(t) |
Nombre de noyaux radioactifs présents
à la date t |
|
N0 |
nombre de noyaux présents à la date
t0 = 0 s |
|
λ |
Constante radioactive (s–1) |
|
t |
Temps (s) |
-
λ
est la constante de désintégration (ou de décroissance) radioactive s–1.
-
Définition :
-
Pour un type de noyaux radioactifs, la
demi-vie t1/2
est la durée au bout de laquelle la moitié des noyaux radioactifs initialement
présent dans l’échantillon se sont désintégrés.
-
Relation entre
t1/2
et λ :
-
Au temps
t :
N (t) = N 0
e – λ . t
-
Au temps
t +
t
1/2 :
-
![]()
-
En conséquence :
-
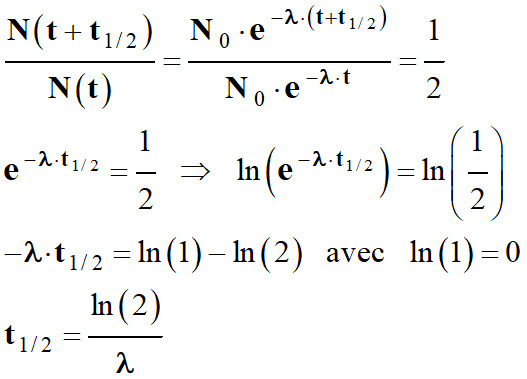
-
La demi-vie n’a qu’une valeur
statistique.
-
Elle indique qu’un noyau radioactif a
une chance sur deux de disparaître au bout d’une demi-vie.
►
Courbe de décroissance : N = f
(t).
-
On peut déterminer la demi-vie d’un
noyau radioactif à partir de la courbe de décroissance radioactive.
-
Représentation graphique :
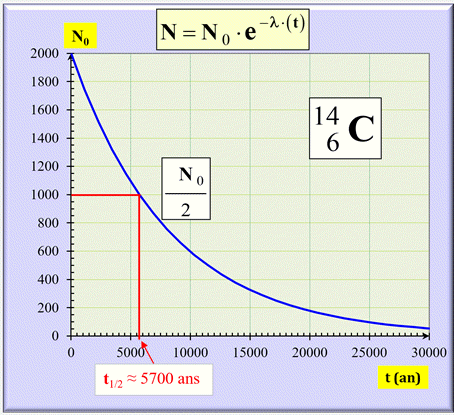
-
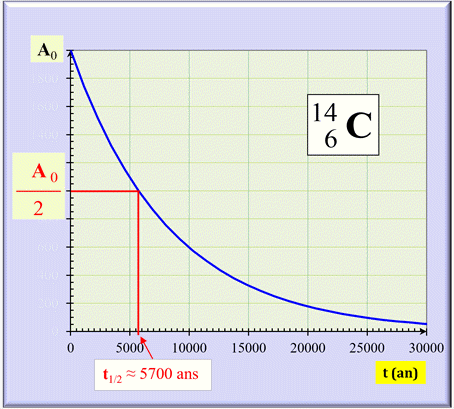
La demi-vie du carbone 14 est d’environ
5700 ans.
-
Évolution en fonction de la demi-vie :
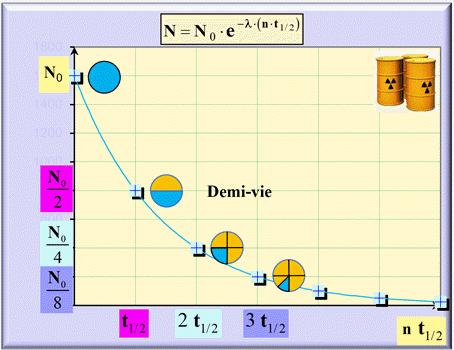
-
On considère que 99 % d’une population
de noyaux radioactifs est désintégrée après une durée de sept demi-vies environ.
III- Applications et radioprotection.
1)- Activité d’un échantillon.
-
L’activité
A (t)
d’un échantillon radioactif à la date t
est le nombre de désintégrations par seconde de cet échantillon.
-
L’unité d’activité est le Becquerel Bq
en hommage à Henri Becquerel.
-
1 Bq = 1 désintégration par seconde.
-
Si l’on considère qu’entre
t et
t +
Δt, le nombre de
noyaux radioactif a diminué de ΔN,
l’activité est donnée par la relation :
-
![]()
-
Cette expression représente l’activité
moyenne.
-
Pour avoir l’activité à un instant
donné, il faut faire tendre Δt
→0.
-
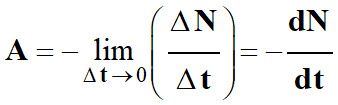
-
En conséquence :
-
L’activité, à un instant donné, est
égale à l'opposé de la dérivée par rapport au temps de N (t).
-
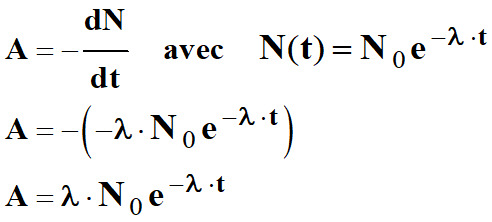
-
Si l’on pose :
-
A0
= λ . N0
=> A
(t) = A0
e – λ . t
-
La décroissance de l’activité suit la
même loi que la décroissance du nombre de noyau radioactif d’un échantillon.
|
A
(t) = A0
. exp ( – λ . t) ou A
(t)
= A0
e – λ . t |
|
|
A
(t) |
Activité de l’échantillon radioactif
à la date t |
|
A0 |
Activité de l’échantillon radioactif
à la date t0 = 0 s |
|
λ |
Constante radioactive (s –1) |
|
t |
Temps (s) |
►
Courbe de décroissance : A = f (t) pour
le carbone 14
-
Ordre de grandeur des activités : l’eau
de mer a une activité de l’ordre de 10 Bq par litre.
-
Le Radon, présent dans l’air, à l’état
de trace, a une activité de quelques centaines de Bq.
-
Le corps humain
A ≈
10 4 Bq,
-
Les sources
radioactives, utilisées au laboratoire, ont une activité comprise entre 4 × 104
Bq et 4 × 107 Bq.
-
L’activité d’un gramme
de radium est supérieure à 1010
Bq.
-
On utilise aussi le curie comme unité
de radioactivité :
-
1 Ci = 3,7 × 1010
Bq.
-
L’activité du Césium 137
est de l’ordre de 3 × 105
Bq.
►
La datation au carbone 14.
-
Elle est fondée sur l’utilisation de la
loi de décroissance radioactive de l’isotope
![]() , radioactif
β–.
, radioactif
β–.
-
La demi-vie du carbone 14 est fixée de
façon conventionnelle à t
½
= 5734 ± 40 ans (valeur admise en 1961).
-
Le carbone 14 est présent dans
l’atmosphère.
-
Il est régénéré par une réaction
nucléaire faisant intervenir des neutrons cosmiques et des noyaux d’azote 14 :
- ![]()
-
La proportion de carbone
14 par rapport au carbone 12 est de l’ordre de 10–12.
-
Il en est de même dans le dioxyde de
carbone atmosphérique.
-
On fait l’hypothèse que cette
proportion est à peu près constante à l’échelle de quelques dizaines milliers
d’années.
-
Tous les organismes vivants échangent
du dioxyde de carbone avec l’atmosphère, soit directement, via la photosynthèse,
soit indirectement via l’alimentation.
-
Les tissus fixent l’élément carbone.
-
La proportion de carbone 14 par rapport
au carbone 12 est la même que la proportion atmosphérique.
-
À leur mort, les organismes cessent de
fixer l’élément carbone et le carbone 14 n’est plus régénéré.
-
La quantité de carbone 14 présente dans
les tissus diminue alors selon la loi de décroissance radioactive.
-
Pour évaluer l’âge, il faut connaître :
-
L’activité
A0
de 1 g de carbone issu de matière organique vivante et
-
L’activité
A de 1 g de carbone
issu de l’objet à dater.
-
On calcule le temps
t écoulé à partir
de la relation suivante :
-
A (t)
= A0
. exp
( – λ .
t)
-
A (t)
= A0
e – λ . t
-
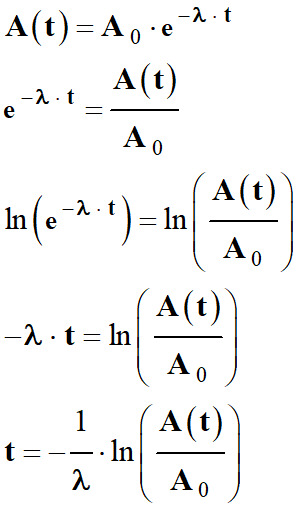
-
On peut calculer le temps écoulé en
utilisant la demi-vie du noyau :
-
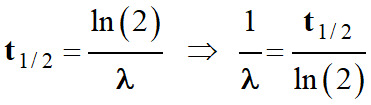
-
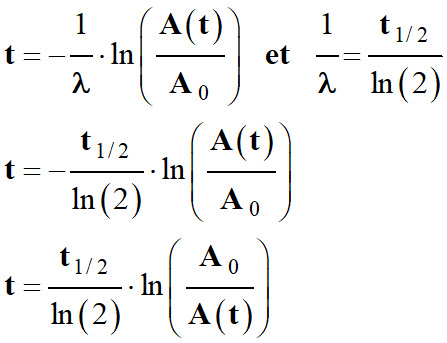
-
La quantité de carbone 14 restant dans
un échantillon est encore mesurable jusqu’à 50 000 ans environ.
3)- Médecine et radioprotection.
-
Les expositions aux radiations
radioactives sont de deux ordres :
- Les irradiations directes issues de sources extérieures au corps humain
- (certaines roches granitiques qui
contiennent du thorium 232, le radon 222 présent dans l’atmosphère, …les effets
de la centrale de Tchernobyl).
-
Les irradiations internes (iode 131
radioactif qui se fixe dans la glande thyroïde :
t1/2
= 8,02 j )
-
La dose reçue par une personne irradiée
détermine :
-
La gravité des effets immédiats
(rougeur de la peau, brûlures, ..)
-
La probabilité d’apparition des effets
aléatoires (anomalies génétiques ou héréditaires, cancers, leucémies,…)
-
Les particules
α (alpha) sont
directement ionisantes mais peu pénétrantes.
-
Ce rayonnement a un
pouvoir de pénétration très faible.
- Il ne parcourt que quelques centimètres dans l’air.
- Une feuille de papier ou les couches
superficielles de la peau l’arrêtent.
-
Les particules
β (bêta) sont plus
pénétrantes mais moins ionisantes que les particules
α.
-
Ce rayonnement ne peut
parcourir que quelques mètres dans l’air.
-
Il est stoppé par une
vitre ou une feuille d’aluminium.
-
Les rayonnements
X et
γ ne sont pas
directement ionisants, mais ils sont très pénétrants.
-
Ils parcourent dans
l’air plusieurs centaines de mètres.
-
Il faut des matériaux
denses et épais comme le béton (environ 2 m) et le plomb (plus de 20 cm) pour
les arrêter.
-
Ils peuvent traverser jusqu’à 20 cm de
plomb.
-
Par interaction avec les atomes des
substances traversées, ils peuvent donner naissance à des électrons qui eux sont
ionisants
-
La quantité de rayonnements absorbés :
-
Le gray (Gy) est l'unité qui permet de
mesurer la quantité de rayonnements absorbés – ou dose absorbée – par un
organisme ou un objet exposé aux rayonnements.
-
Le gray a remplacé le rad en 1986 : 1
gray = 100 rads = 1 joule par kilo de matière irradiée.
|
QCM réalisé avec le
logiciel QUESTY
Pour
s’auto-évaluer
La
désintégration radioactive
La loi de
décroissance radioactive
Applications et radioprotection |
|
Exercices : énoncé avec correction Préparation à l'ECE : Le technétium 1)- Exercice 03
page 122 : Reconnaître les particules : 2)- Exercice 05
page 122 : Utiliser les lois de conservations. 3)- Exercice 07
page 122 : écrire une équation de réaction nucléaire. 4)- Exercice 09
page 122 : Déterminer un type de radioactivité. 5)- Exercice 11
page 123 : Utiliser le diagramme (Z,
N). 6)- Exercice 13
page 123 : Déterminer un nombre de noyaux radioactifs. 7)- Exercice 15
page 123 : Calculer une durée. 8)- Exercice 17
page 124 : Déterminer une demi-vie. 9)- Exercice 19
page 124 : Utiliser une activité. 10)- Exercice 21
page 124 : Mesures de radioprotection pour une scintigraphie. 11)- Exercice 23
page 125 : La découverte d’un élément radioactif. 12)- Exercice 25
page 125 : Des galères grecques à Marseille. 13)- DS 01 : La découverte de la radioactivité artificielle et ses applications (60 min) : Exercice 32 page 128. 14)- DS 02 :
Datation à l’uranium 238 (40 min) : exercice 33 page 129
|
|
|