|
|
Méthodes d'analyse chimique Exercices 1 |
|
|
|
|
|
QCM r Méthodes d’analyse chimique Les méthodes de suivi d’un
titrage La composition d’un système
|
1)- Exercice 03 page 62 : Déterminer une concentration :
|
Déterminer une concentration : Pour préparer une solution S, un volume de 15,0 mL d’une solution commerciale d’acide sulfurique H2SO4 (ℓ), dont l’étiquette est ci-dessous, est versé dans une fiole jaugée de 1,0 L. La fiole est ensuite complétée jusqu’au trait de jauge avec de
l’eau distillée.
-
Déterminer la concentration de la
solution S en ions
H3O+.
-
Données :
-
Masse volumique de l’eau :
ρeau = 1,0 g
. mL–1
-
L’équation de la réaction de l’acide
sulfurique sur l’eau est la suivante : H2SO4 (ℓ) + 2
H2O (ℓ)
→ SO4– (aq)
+ 2 H3O+ (aq) |
||||||||||
|
Déterminer une concentration :
-
Données :
-
Solution commerciale
S0 :
-
Volume de solution commerciale :
-
V = 15,0 mL
-
Pourcentage en masse :
P = 90 % = 0,90
-
d = 1,815
-
Solution S :
-
Volume :
Vsol = 1,0 L
-
L’équation de la réaction de l’acide
sulfurique sur l’eau est la suivante : H2SO4 (ℓ) + 2
H2O (ℓ)
→ SO4– (aq)
+ 2 H3O+ (aq)
-
Concentration de la solution S
en ions H3O+.
-
Tableau d’avancement :
-
Il faut calculer la quantité de
matière d’acide sulfurique prélevée :
-
Et en déduire la quantité de matière
d’ions oxonium obtenue.
-
Masse
m de solution
commerciale prélevée :
-
m =
ρ .
V
-
avec :
-
ρ
=
d .
ρeau
-
m =
d .
ρeau . V
-
masse
m1 d’acide
sulfurique utilisée :
-
m1 =
P .
m = P .
d . ρeau
. V
-
m1
= P .
d . ρeau
. V
-
Quantité de matière n1
d’acide sulfurique :
-
-
Quantité de matière
n (H3O+)
d’ions oxonium :
-
n (H3O+)
= 2 n1
-
-
Concentration de la solution
S en ions oxonium :
-
-
Application numérique :
-
Masse volumique de l’eau :
ρeau = 1,0 g .
mL–1
-
-
[H3O+]
≈ 0,50 mol . L–1 |
||||||||||||||||||||||||||||||||||||||||||||||||
2)- Exercice 05 page 62 : Identifier une relation à l’équivalence :
|
Identifier une relation à l’équivalence : Pour contrôler la composition en ions calcium Ca2+ (aq) d’une solution, un titrage par une solution d’hydroxyde de sodium, Na+ (aq) + HO–
(aq), est réalisé. L’équation de la réaction support du titrage est : Ca2+ (aq) + 2 HO–
(aq) → Ca(OH)2 (s) 1.
Identifier les réactifs titrant et titré. 2.
Donner les caractéristiques d’une réaction support de
titrage. 3. La masse des ions calcium Ca2+ (aq) à doser et la quantité des ions hydroxyde HO– versés à l’équivalence sont notés respectivement n0 (Ca2+) et nE (HO–). Parmi les relations suivantes, identifier celle qui correspond au
titrage étudié : a. b. |
|
Identifier une relation à l’équivalence : 1.
Réactif titrant et réactif titré :
-
Réactif titrant : les ions
HO– (aq) de la
solution hydroxyde de sodium, ,
Na+ (aq) + HO–
(aq).
-
Réactif titré : les ions calcium
Ca2+ (aq). 2.
Caractéristiques d’une réaction support de
titrage.
-
L’outil de détermination de cette
quantité de matière est la réaction chimique : Ca2+ (aq) + 2 HO–
(aq) → Ca(OH)2 (s)
-
C’est une réaction de précipitation.
-
C’est la réaction de dosage ou de
titrage.
-
Cette réaction doit être rapide,
totale, spécifique et unique.
3.
Identification
de la relation :
-
Tableau simplifié :
-
Les relations données font intervenir
masses et quantités de matière :
-
Or :
-
-
En combinant les relations (1) et
(2) :
-
-
La bonne relation est la relation (a). |
|||||||||||||||||||||||||
3)- Exercice 06 page 62 : Établir une relation à l’équivalence :
|
Établir une relation à l’équivalence : Une solution S d’acide fumarique C4H4O4
(aq) est titrée par une solution d’hydroxyde de sodium, Na+ (aq) + HO–
(aq), telle que : [HO–] = CB = 1,00 × 10–2
mol . L–1. Pour un volume de solution titrée V1 = 10,0 mL, le volume versé à l’équivalence est VE = 15,7
mL. L’équation de la réaction support du titrage est : C4H4O4
(aq) + 2 HO– (aq) → C4H4O2–
(aq) + 2 H2O (ℓ) 1.
Établir la relation entre les quantités de
matière n1 (C4H4O4)
et nE (HO–) à l’équivalence de
ce titrage. 2.
En déduire la valeur de la concentration en
acide fumarique de la solution S. |
Établir une relation à l’équivalence :
L’équation de la réaction support du titrage est : C4H4O4
(aq) + 2 HO– (aq) → C4H4O2–
(aq) + 2 H2O (ℓ) 1.
Relation entre les quantités n1
(C4H4O4) et
nE (HO–) à l’équivalence de ce
titrage.
-
Équivalence : Équivalence d’un titrage :
À
l’équivalence, les réactifs sont dans les
proportions stœchiométriques définies
par
les coefficients de la réaction.
À
l’équivalence, il n’y a pas de réactif limitant.
-
Tableau d’avancement :
Équation de la
réaction de titrage
Équation
C4H4O4 (aq)
+
2
HO–
(aq)
→
C4H4O2–
(aq)
+ 2
H2O
(ℓ)
État du
système
Avanc.
n1
(C4H4O4)
n
(HO–)
n
(C4H4O2–)
solvant
État initial
(mol)
x =
0
n1
(C4H4O4)
n
(HO–)
0
solvant
Au cours
de la
transformation
x
n1
(C4H4O4)
– x
n
(HO–)
– 2 x
x
solvant
Équivalence
xE
n1
(C4H4O4)
– xE = 0
nE
(HO–)
– 2 xE = 0
xE
solvant
xE =
n1 (C4H4O4) et nE
(HO–) = 2 xE
-
Relation à l’équivalence :
- 2.
Valeur de la concentration C1
en acide fumarique de la solution S.
-
À l’équivalence :
-
n1 (C4H4O4)
= C1 .
V1 et nE
(HO–) =
CB .VE
-
-
Application numérique :
-
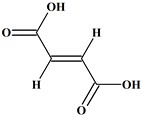
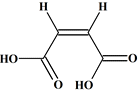
L’acide
fumarique :
C’est un acide dicarboxylique présentant une double
liaison. -
Formule
topologique : -
Nom : acide
E-but-2-ènedioïque. -
Il possède un
stéréoisomère : l’acide maléique -
Nom : acide
Z-but-2 ènedioïque
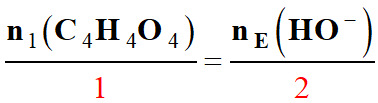
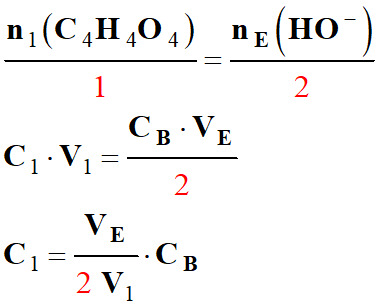
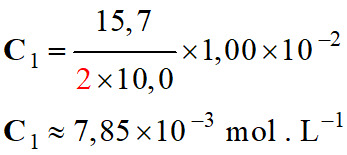
![]()
4)- Exercice 09 page 63 : Repérer l’équivalence d’un titrage conductimétrique :
|
Repérer l’équivalence d’un titrage conductimétrique : Le titrage d’un volume VA = 10,0 mL d’une solution S d’aspirine C9H8O4 (aq) par une solution d’hydroxyde de sodium, telle que [HO–] = 2,0 × 10–2 mol . L–1 est suivi par conductimétrie et permet de reporter les points
ci-après. L’équation de réaction support du titrage est : C9H8O4
(aq) + HO– (aq) → C9H7O4–
(aq) + H2O (ℓ) Tableau de valeurs
Graphe : 1.
Déterminer le volume versé à l’équivalence
VE en expliquant la méthode utilisée. 2.
Calculer la concentration CA
en aspirine de la solution. |
Repérer l’équivalence d’un titrage conductimétrique : 1.
Volume versé à l’équivalence VE
en expliquant la méthode utilisée.
-
Tableau des conductivités molaires ioniques : Ions
λ
(mS .
m2 . mol– 1)
Na+
5,01
H3O+
34,98
C9H7O4–
3,6
HO–
19,86
-
On dose, par titrage
conductimétrique,
-
une solution
S d’aspirine C9H8O4 (aq)
-
par une solution
SB d’hydroxyde de sodium, {Na+ (aq) +
HO–
(aq)}.
-
L’équation de la réaction de titrage
est : C9H8O4
(aq) + HO– (aq) → C9H7O4–
(aq) + H2O (ℓ)
-
Le suivi du titrage par
conductimétrie permet de tracer le graphe
σ =
f (VB).
-
On observe une rupture de pente.
-
La courbe est constituée de deux
segments de droite
Partie
AE de la courbe :
-
Au départ, la conductivité
σ de la solution varie très peu, mais augmente
légèrement
-
Après ajout de la solution
titrante,
-
Les ions présents dans le
mélange réactionnel sont :
-
les ions sodium Na+ et les ions
acétylsalicylate C9H7O4–.
-
Les ions hydroxyde HO–
ne sont pas
présents car ils sont totalement consommés.
-
Au cours de la
réaction, les molécules d’aspirine
C9H8O4 (aq)
sont remplacées par
des ions sodium Na+.
-
La concentration
en ion sodium Na+ augmente de même que
la concentration
des ions acétylsalicylate C9H7O4–.
-
La conductivité globale σ
de la solution augmente légèrement car les conductivités
de ces ions sont faibles.
-
L’ion
HO–
est le réactif limitant.
Le
point E de la courbe :
-
C’est le point de rupture de
pente de la courbe.
-
Ce point particulier est
appelé point équivalent, noté E.
-
En ce point, on change de
réactif limitant.
-
On passe d’un excès de molécules d’aspirine à un excès d’ion HO–.
Partie EB de la courbe :
La conductivité σ de la solution augmente
fortement.
-
Après l’équivalence :
-
Les ions présents dans le
mélange réactionnel sont :
-
Les ions hydroxyde
HO–, les ions sodium Na+,
les ions acétylsalicylate C9H7O4–
(aq).
-
Le réactif limitant est la molécule d’aspirine, elle est
totalement consommée.
-
La conductivité globale σ
de la solution augmente après l’équivalence car on
ajoute
des ions hydroxyde HO– et des
ions sodium Na+ dans le mélange
réactionnel.
-
La conductivité des ions
hydroxyde HO– est élevée.
-
C’est pour cette raison que
la conductivité augmente fortement après l’équivalence.
-
Exploitation graphique : ZOOM
-
Les mesures de la première partie de
la courbe (segment bleu) donnent un coefficient de détermination R²
≈ 0,75 du segment de droite qui n’est pas bon. - Ceci est lié au fait
que les ions présents dans la solution ont une conductivité qui est
faible.
-
Pour la deuxième partie de la courbe
(segment rouge), le coefficient de détermination R² ≈ 0,9987 ≈ 1,0.
. Le sésultat est bon. Dans ce cas les points sont sensiblement alignés.
-
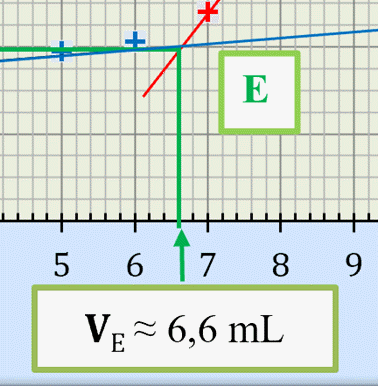
Coordonnées du point équivalent
E :
-
σE ≈ 400
μS
. cm-–1
et VE ≈
6,6 mL 2.
Concentration CA en
aspirine de la solution.
-
On peut déduire de ceci la
concentration de la solution titrée :
Solution titrante :
Réactif B
Na+
(aq) + HO– (aq)
CB
= [HO–] =
2,0 × 10–2
mol . L–1
VB
= VE ≈ 6,6 mL
Solution titrée :
Réactif A
C9H8O4
(aq)
CA
= ?
VA
= 10,0 mL
-
À l’équivalence :
-
n0 (C9H8O4)
= nE (HO–)
= xE
-
xE = CA
. VA = CB . VE
-
- Réactions entre
l'aspirine et les ions hydroxyde. - Bac Blanc :
L'aspirine
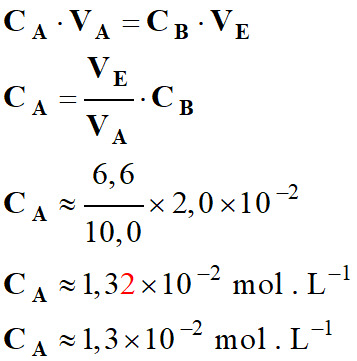
![]()
5)- Exercice 12 page 64 : Utiliser la méthode des tangentes (et la courbe dérivée) :
|
Utiliser la méthode des tangentes Une solution S0, de vitamine C de volume V0 = 100,0 mL, est préparée en dissolvant un comprimé dans de l’eau distillée. Le titrage d’un volume VA = 10,0 mL de S0
par une solution d’hydroxyde de sodium telle que : [HO–] = 4,00 × 10–2 mol . L–1 est suivi par pH-métrie. Les résultats obtenus sont donnés dans le tableau ci-dessous.
L’équation de
la réaction support du titrage est la suivante : C6H8O6
(aq) + HO– (aq) → C6H7O6–
(aq) + H2O (ℓ) 1.
Déterminer le volume versé à l’équivalence. 2.
Déterminer la concentration en quantité de
matière en acide ascorbique de la solution S0. 3.
En déduire la quantité n0
et la masse de vitamine C contenues dans un comprimé.
-
Données :
-
Masse molaire de la vitamine C :
M = 176 g . mol–1.
-
Vitamine C : C6H8O6 |
|
L’équation de la réaction support du titrage est la suivante : C6H8O6
(aq) + HO– (aq) → C6H7O6–
(aq) + H2O (ℓ) 1.
Détermination du volume versé à
l’équivalence.
-
L’équivalence :
►
Le point équivalent E :
-
Le point équivalent est le point
d’inflexion de la courbe pH
= f (VB).
-
Au point équivalent, on change de
réactif limitant et la courbe change de concavité.
-
Le point équivalent est caractérisé
par ses coordonnées : pHE
et VE.
-
On peut déterminer les coordonnées du
point équivalent par :
-
La méthode des tangentes.
-
La méthode de la courbe dérivée.
►
Méthode des tangentes :
-
Il faut tracer le graphe :
pH = f (VB) - On trace deux tangentes à la courbe pH = f (VB), parallèles et situées de part et d'autre du point d'équivalent (point d'inflexion de la courbe)
et suffisamment proche de
l'équivalence.
-
On trace ensuite la parallèle à ces
deux tangentes, équidistantes de celles-ci.
-
Son point d'intersection avec la
courbe définit le point équivalent
E.
-
Exploitation graphique :
-
Coordonnées du point équivalent
E :
-
pHE ≈ 7,8
et VE ≈ 14,0 mL
►
La méthode de la courbe dérivée. - Pour repérer le point équivalent E, on peut tracer la courbe représentant
le coefficient directeur
a de la tangente à la
courbe pH =
f (VB).
-
Le coefficient
a est défini par la relation :
-
L’abscisse
VE du point
équivalent E est
l’abscisse de l’extremum de la courbe représentant
-
Exploitation graphique :
-
On va tracer avec le
tableur Excel la courbe :
-
Formule et tableau de valeurs :
-
Formule que l’on recopie vers le bas
autant que nécessaire.
-
Graphe
ΔpH
/
ΔVB
=
g (VB) :
-
L’abscisse
VE du point
équivalent E est
l’abscisse de l’extremum de la courbe représentant
-
VE ≈ 14,0 mL 2.
Concentration en
quantité de matière en acide ascorbique de la solution S0.
-
Récapitulatif :
-
Concentration
CA en quantité de matière en acide ascorbique de la
solution S0 :
- 3.
Quantité n0 et la masse
m0 de vitamine C contenues dans un comprimé.
-
Une solution S0, de
vitamine C de volume V0 = 100,0 mL, est
préparée en dissolvant un comprimé dans de l’eau distillée.
-
Quantité de matière
n0 de vitamine C :
-
n0
=
CA . V0
-
n0
≈ 5,6 × 10–2 ×
100,0 × 10–3
-
n0
≈ 5,6 × 10–3 mol
-
Masse m0 de
vitamine C contenues dans un comprimé :
-
m0
=
n0 . M
-
m0
≈ 5,6 × 10–3 ×176
-
m0
≈ 9,85
× 10–1 g
-
m0
≈ 9,9 × 10–1 g
-
Il doit s’agir d’un comprimé de
vitamine C 1000 mg
-
TP : Dosage d’un comprimé de vitamine
C (500 mg)
-
La molécule d’acide ascorbique.
-
Acide ascorbique / ion ascorbate.
|
6)- Exercice 13 page 64 : Établir la composition d’un système :
|
Établir la composition d’un système : Un volume V1 = 20,0 mL d’une solution S de concentration CA = 2,00 10–2 mol . L–1 en acide maléique, noté AH2 (aq) est titré par une solution d’hydroxyde de sodium telle que [HO–] =
1,00 × 10–1 mol .
L–1. L’équation de la réaction support du titrage s’écrit : AH2 (aq) + 2 HO–
(aq) → A2– (aq) + 2 H2O
(ℓ) 1.
Établir la composition de la solution
contenue dans le bécher après ajout d’un volume d’hydroxyde de
sodium égal à : a.
VB = 5,0 mL ; b.
VB = 15,0 mL ; |
|
Établir la composition d’un système : 1.
Composition de la solution contenue dans le
bécher après ajout d’un volume d’hydroxyde de sodium : a.
VB = 5,0 mL ;
-
Quantités de matière initiales :
-
n0 (AH2) = CA . VA
-
n0 (AH2) ≈ 0,40 mmol
-
n0 (HO–)
= CB . VB =
1,00 × 10–1 × 5,0 × 10–3
-
n0 (HO–)
≈ 5,0 × 10–4 mol
-
n0 (HO–)
≈ 0,50 mmol
-
Tableau d’avancement :
-
Détermination de la valeur de
xf :
-
Hypothèse 1 : le réactif
limitant est AH2
:
-
n0 (AH2) –
xf1 = 0
-
Dans ce cas :
xf1 =
n0 (AH2) = 0,40 mol
-
Hypothèse 2 : le réactif
limitant est HO–
:
-
n (HO–)
– 2 xf2 = 0
-
Dans ce cas :
xf2 = 0,50 /
2
-
xf2 = 0,25
mmol
-
L’avancement final est égal à la plus
petite des deux valeurs :
-
xf2 = 0,25
mmol < 0,40 mmol = xf1
-
Tableau final :
b.
VB = 15,0 mL ;
-
Quantités de matière initiales :
-
n0 (AH2) = CA . VA
-
n0 (AH2) ≈ 0,40 mmol
-
n0 (HO–)
= CB . VB =
1,00 × 10–1 × 15,0 × 10–3
-
n0 (HO–)
≈ 1,5 × 10–3 mol
-
n0 (HO–)
≈ 1,50 mmol
-
Tableau d’avancement :
-
Détermination de la valeur de
xf :
-
Hypothèse 1 : le réactif
limitant est AH2
:
-
n0 (AH2) –
xf1 = 0
-
Dans ce cas :
xf1 =
n0 (AH2) = 0,40 mmol
-
Hypothèse 2 : le réactif
limitant est HO–
:
-
n (HO–)
– 2 xf2 = 0
-
Dans ce cas :
xf2 = 1,50 /
2
-
xf2 = 0,75
mmol
-
L’avancement final est égal à la plus
petite des deux valeurs :
-
xf1 = 0,40
mmol < 0,75 mmol = xf2
2.
Réactif limitant et
volume versé est inférieur,
égal ou supérieur au volume VE versé à
l’équivalence.
-
Volume versé à l’équivalence :
-
Tableau d’avancement :
-
D‘autre part :
-
xE = CA
. VA = 2,00 × 10–2
× 20,0 × 10–3
-
xE ≈ 4,0
× 10–4 mol
-
xE ≈ 0,40 mmol a.
VB = 5,0 mL :
-
Dans ce cas
VB <
VE
-
Le réactif limitant est l’ion
hydroxyde HO–. b.
VB = 15,0 mL :
-
Dans ce cas
VB >
VE
-
Le réactif limitant est l’acide
maléique.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7)- Exercice 15 page 64 : Justifier l’évolution de la conductivité :
|
Justifier l’évolution de la conductivité : Une solution d’acide chlorhydrique est titrée par une solution
d’hydroxyde de sodium. Le titrage suivi par conductimétrie permet de tracer le graphe
ci-dessous. Graphe σ = f (VB) : L’équation de la réaction support du titrage est : H3O+
(aq) + HO–
(aq) → 2 H2O (ℓ)
-
Interpréter qualitativement le
changement de pente observé.
-
Données :
-
Conductivité molaire ionique des
différents ions.
|
|
Justifier l’évolution de la conductivité : Interprétation qualitative du changement de pente observé
►
Caractéristiques du graphe σ =
f (VB) :
-
On observe une rupture de pente.
-
La courbe est constituée de deux
segments de droite
-
Partie AE :
-
Le point
E de la courbe :
-
Partie EB :
-
Exploitation graphique :
►
Le point équivalent E :
-
Le point équivalent est le point de
rupture de la courbe de σ =
f (VB). ZOOM
-
Coordonnées du point équivalent
E :
-
σE ≈ 0,90 mS .
cm–1 et
VE ≈ 10,8 mL - On peut déduire de ceci la concentration de la solution titrée : Solution d’acide
chlorhydrique.
-
À l’équivalence : xE
= CA . VA = CB
. VE
-
|
8)- Exercice 18 page 65 : Réaliser un contrôle de qualité :
|
Réaliser un contrôle de qualité : L’étiquette d’un sachet d’aspirine AH prescrit au titre de la prévention des accidents vasculaires cérébraux porte la mention :
« teneur en aspirine : 100 mg ». En pharmacie, un contrôle qualité est considéré comme satisfaisant si l’écart relatif entre la grandeur de référence indiquée par le fabricant et la même grandeur déterminée expérimentalement est strictement inférieure à 1 %. A.
Titrage d’un cachet d’aspirine. Une solution S est obtenue en dissolvant un sachet
d’aspirine dans une fiole jaugée de 500,0 mL. Le titrage d’un volume VA = 10,0 mL de la solution S par une solution aqueuse d’hydroxyde de sodium telle que : [HO–] = 1,00 × 10–3 mol . L–1 est suivi par pH-métrie et permet de tracer le graphe ci-dessous :
-
Graphe : ZOOM
1.
Déterminer le volume
VE versé à
l’équivalence en expliquant la méthode
utilisée. 2.
Écrire l’équation de la réaction support du
titrage. 3.
Établir la relation d’équivalence. 4.
En déduire la quantité n0
et la masse d’aspirine contenue dans un comprimé. 5.
Le cachet d’aspirine satisfait-il au
contrôle qualité ?
-
Données :
-
Masse molaire de l’aspirine AH :
M = 180 g . mol–.
-
Couples acide-base : AH (aq)
/ A– (aq) et H2O (ℓ) / HO–
(aq) |
Réaliser un contrôle de qualité : 1.
Volume
VE versé à
l’équivalence en expliquant la méthode
utilisée.
►
Le point équivalent E :
-
Le point équivalent est le point
d’inflexion de la courbe pH = f (VB).
-
Au point équivalent, on change de
réactif limitant et la courbe change de concavité.
-
Le point équivalent est caractérisé
par ses coordonnées : pHE et VE.
-
On peut déterminer les coordonnées du
point équivalent par :
-
La méthode des tangentes.
-
La méthode de la courbe dérivée.
-
Dans le cas présent, on va utiliser
la méthode de la courbe dérivée :
►
La méthode de la courbe dérivée.
-
L’abscisse VE du
point équivalent E est l’abscisse de l’extremum de la courbe
représentant
-
Exploitation graphique :
-
Volume de la solution d’hydroxyde de
sodium versé à l’équivalence :
-
VE ≈ 11,0 mL 2.
Équation de la réaction support du titrage.
-
Solution titrante :
-
Réactif B
-
Na+ (aq) + HO–
(aq)
-
CB = [HO–]
= 1,00 × 10–3 mol . L–1
-
VB = VE
≈ 11,0 mL
-
Solution titrée :
-
Solution aqueuse d’aspirine :
-
AH (aq)
-
CA = ?
-
VA = 10,0 mL AH (aq) + HO– (aq) → A–
(aq) + H2O (ℓ) 3.
Relation d’équivalence.
-
Tableau d’avancement :
Équation de la
réaction de titrage
Équation
AH
(aq)
+
HO–
(aq)
→
A–
(aq)
+ H2O
(ℓ)
État du
système
Avanc.
n
(AH)
n
(HO–)
n
(A–)
solvant
État initial
(mol)
x =
0
n0
(AH)
n
(HO–)
0
solvant
Au cours
de la
transformation
x
n0
(AH) – x
n
(HO–)
– x
x
solvant
Équivalence
xE
n0
(AH) – xE = 0
nE
(HO–)
– xE = 0
xE
solvant
-
n0 (AH) =
nE (HO–)
= xE
-
CA . VA
= CB . VE
-
Ou :
-
CA . VA
= [HO–]
. VE 4.
Quantité n0 et masse m0
d’aspirine contenue dans un comprimé.
-
Récapitulatif : Solution titrante :
Réactif B
Na+
(aq) + HO– (aq)
CB
= [HO–] = 1,00 × 10–3 mol . L–1
VB
= VE ≈ 11,0 mL
Solution titrée :
Solution aqueuse d’aspirine :
AH
(aq)
CA
= ?
VA
= 10,0 mL
-
Une solution S est obtenue en
dissolvant un sachet d’aspirine dans une fiole jaugée de volume
V = 500,0 mL.
-
CA . VA
= [HO–]
. VE
-
-
Application numérique :
-
-
Quantité n0
d’aspirine :
-
n0
= CA . V
-
-
Il faut exprimer
VA et VE
dans la même unité.
-
Mais le volume
V doit être exprimé en litre (L).
-
Application numérique :
-
-
Masse
m0 d’aspirine
contenue dans un comprimé :
-
m0 =
n0 .
M
-
-
Application numérique :
-
5.
Cachet d’aspirine et contrôle qualité :
-
Cachet d’aspirine : « teneur en
aspirine : 100 mg ».
-
En pharmacie, un contrôle qualité est
considéré comme satisfaisant si l’écart relatif entre la grandeur de
référence indiquée par le fabricant et la même grandeur déterminée expérimentalement est strictement inférieure à 1 %.
-
Écart relatif :
-
-
Le contrôle de qualité est
satisfaisant.
![]() en fonction de VB.
en fonction de VB.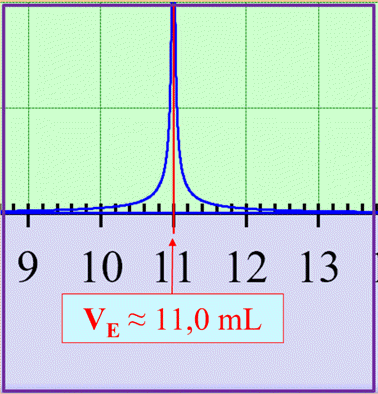
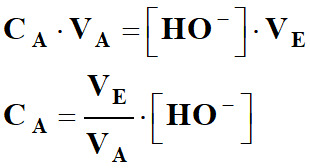
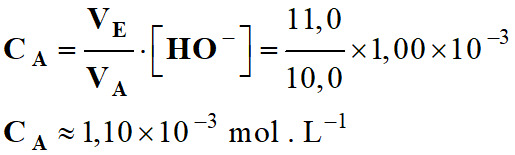
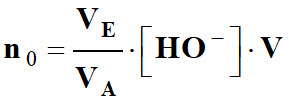
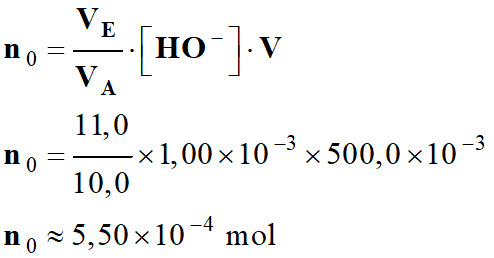
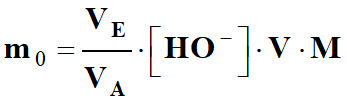
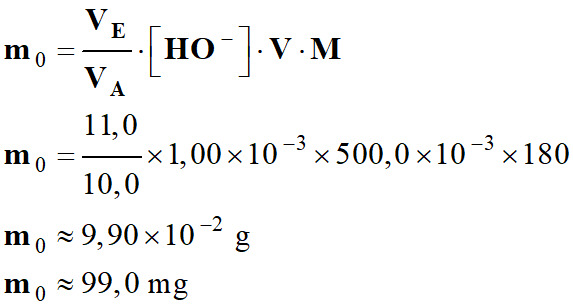
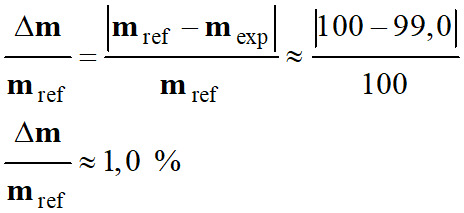
![]()
9)- Exercice 21 page 67 : Algues et alimentation :
|
Algues et alimentation : Les algues brunes telles les algues Kombu breton sont une source d’iode, élément essentiel au fonctionnement du corps humain. Après une série d’étapes en laboratoire, l’élément iode est extrait sous forme iodure I– (aq) de 50 g d’algues sèches Kombu breton. L’extrait est dilué de façon à obtenir 100,0 mL d’une solution
aqueuse S. Le titrage suivi par conductimétrie de V = 50,0 mL de la solution S par une solution de concentration 5,00 × 10–2 mol . L–1
en ions plomb (II) Pb2+ (aq) est réalisé. L’équation de la réaction support du titrage s’écrit : Pb2+ (aq) + 2 I–
(aq) → PbI2 (s) La courbe de titrage est donnée ci-dessous : - Déterminer la masse journalière d’algue Kombu breton séchée que peut consommer
un adolescent pour satisfaire aux besoins nutritionnels en iode
de son organisme.
-
Données :
-
M (I)
= 126,9 g . mol–1
-
Apport quotidien en iode d’un
adolescent :
-
Apport nutritionnel recommandé : 150 μg . j–1.
-
Apport maximal : 900 μg . j–1. |
Algues et alimentation :
-
Masse journalière d’algue Kombu
breton séchée que peut consommer
un adolescent pour satisfaire aux besoins nutritionnels en iode
de son organisme :
-
On utilise une masse
m = 50 g d’algues sèches Kombu breton pour préparer un volume V = 100,0 mL
d’une solution S.
-
Solution titré :
Solution titrée :
Réactif
A
On titre l’élément iode
sous forme d’ions iodure
I–
(aq)
CA
= ?
VA
= 50,0 mL
-
Solution titrante :
Solution titrante :
Réactif B
Solution qui contient
les
ions plomb (II)
Pb2+
(aq)
CB
= 5,00 × 10–2 mol . L–1
VB
= VE = ?
-
Il faut déterminer les coordonnées du
point équivalent E.
►
Le point équivalent E :
-
Le point équivalent est le point de
rupture de la courbe de σ
= f (VB).
-
Exploitation du graphe :
-
Coordonnées du point équivalent
E :
-
σE ≈ 1,45 mS .
cm–1 et VE
≈ 10,1 mL
-
Pour pouvoir calculer la
concentration en ions iodure de la solution
S, il faut connaître la relation à l’équivalence : cette relation découle de la réaction support du titrage.
-
Tableau d’avancement : Pb2+ (aq) + 2 I–
(aq) → PbI2 (s)
Équation de la
réaction de titrage
Équation
Pb2+
(aq)
+ 2
I–
(aq)
→
PbI2
(s)
État du
système
Avanc.
n (Pb2+)
n (I–)
État initial
(mol)
x =
0
n0 (Pb2+) =
CB
. VB
n0 (I–) =
CA
. VA
0
Au cours
de la
transformation
x
CB . VB – x
CA
. VA –
2 x
x
Équivalence
VB
= VE
xE
= CB . VE
ou
2 xE
= CA . VA
CB . VE – xE
= 0
CA
. VA –
2 xE
= 0
xE
-
Relation à l’équivalence :
-
-
Concentration de la solution
S en ions iodure :
-
-
Quantité de matière
n d’ions iodure présente dans le volume
V = 100,0 mL de la solution S :
-
n
= CA . V
-
-
Masse d’ions iodure présente dans la
solution S :
-
m =
n .
M (I)
-
-
Application numérique :
-
Il faut exprimer
VA et VE
dans la même unité.
-
Mais le volume
V doit être exprimé en litre (L).
-
-
Conclusion : dans 50 g d’algues
sèches Kombu breton, il y a environ 256 mg d’élément iode sous forme d’ions iodure.
-
Le besoin en iode pour un adolescent
est de 150 μg . jour–1.
-
Tableau de proportionnalité : Algues
sèches
Kombu
breton
Apport
en
iode
50 g
256
mg
malgues
0,150
mg
malgues
0,900
mg
-
Apport nutritionnel recommandé : 150 μg . j–1.
-
-
Apport maximal : 900 μg . j–1.
-
-
Cette algue est très iodée
-
En consommant cette algue, on peut
facilement dépasser l’apport maximal tolérable.
![]()
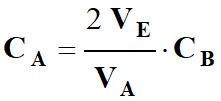
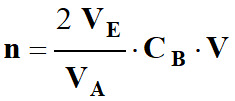
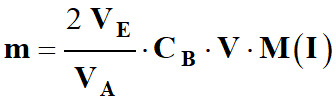
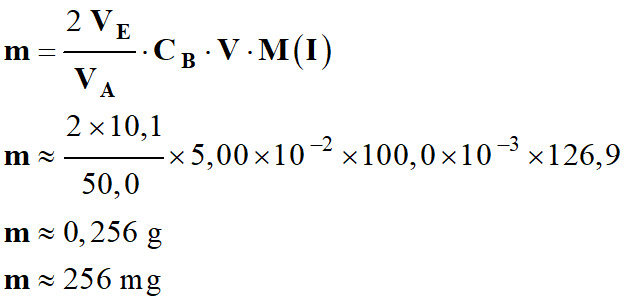
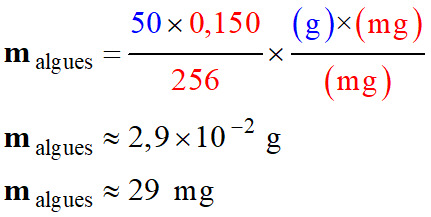
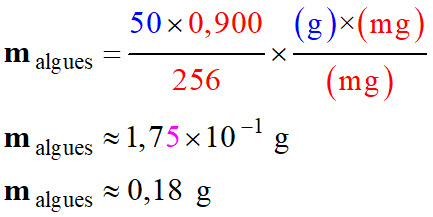
![]()
|
|