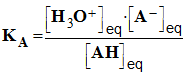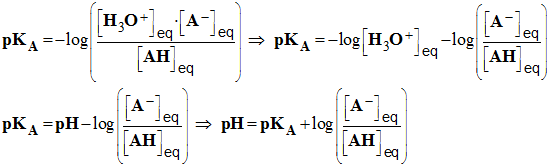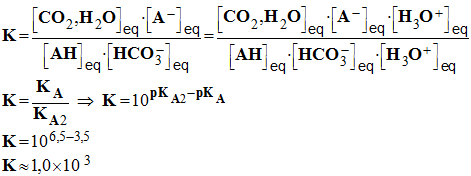|
On se propose de comprendre ce phénomène d’effervescence.
Le comprimé effervescent contient de l’acide acétylsalicylique ou
aspirine et
de l’hydrogénocarbonate de sodium de formule
NaHCO3.
L’aspirine est préparée à partir de l’acide salicylique et d’un acide
carboxylique.
On donne :
Masse molaire de l’aspirine : M = 180 g / mol,
pKA du couple faisant intervenir l’acide acétylsalicylique:
pKA = 3,5.
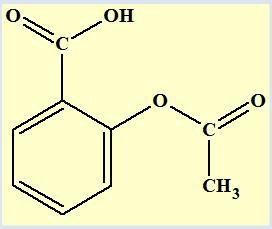
Les formules :
|
Aspirine ou
Acide acétylsalicylique
|
Acide salicylique
|
|
|
|

I-
L’acide
acétylsalicylique.
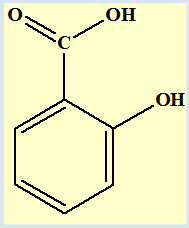
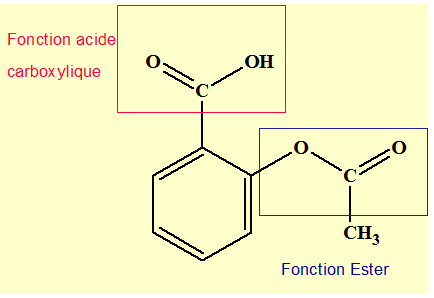
1)- Reproduire la
formule de l’aspirine et encadrer les deux groupes ''caractéristiques''
(ou fonctionnels) que l’on nommera.
Dans la suite de l’exercice l’acide
acétylsalicylique sera noté AH.
- Groupes ‘’caractéristiques’’ de
l’aspirine :
2)-
écrire l’équation de la
réaction acido-basique de l’acide acétylsalicylique avec l’eau.
-
Équation de la réaction acido-basique de
l’acide acétylsalicylique avec l’eau.
AH
(aq)
+
H2O
(ℓ)
=
A– (aq)
+
H3O+
(aq)
3)- Définir la
constante d’acidité KA et le
pKA
du couple faisant intervenir
l’acide acétylsalicylique.
En déduire l’expression du
pH d’une solution
aqueuse d’acide acétylsalicylique fonction du
pKA et
des concentrations des espèces en solution.
- cette
réaction fait intervenir les couples acide / base suivants :
- AH / A–
et
H3O+
/ H2O
- La constante d’équilibre associée à cette
réaction est appelée constante d’acidité notée
KA.
- Expression :
-
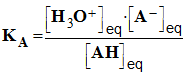
- Constante d’acidité du couple :
AH / A–
-
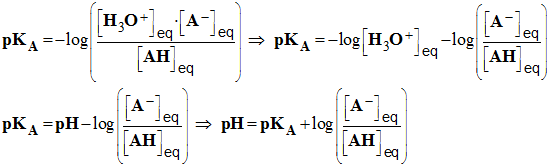
4)- Le pH
est voisin de 1 dans l’estomac et de 8 dans l’intestin. Sous quelle forme prédominante se trouve ce
médicament dans ces deux organes.
Justifier la réponse.
- Dans l’estomac, le
pH = 1, il est
inférieur au
pKA = 3,5 de l’acide
acétylsalicylique.
- C’est l’espèce acide
AH qui prédomine (acide acétylsalicylique).
- Dans l’intestin, le
pH = 8, il
supérieur au
pKA = 3,5 de l’acide
acétylsalicylique.
- C’est l’espèce basique
A– qui prédomine
(l’ion acétylsalicylate).

II-
Le rôle de
l’hydrogénocarbonate de sodium.
Ce composé est soluble dans l’eau.
Sa dissolution donne des ions sodium
Na+ et
des ions
hydrogénocarbonate HCO3–.
L’ion hydrogénocarbonate appartient à deux couples acide-base :
|
Couple 1
|
Couple 2
|
|
HCO3–
/ CO32–
|
(CO2.
H2O) /
HCO3–
|
|
pKA1 = 10.3
|
pKA2 =
6,5
|
1)- Donner la
définition d’une base selon Brönsted.
- Définition d’une base selon Brönsted ;
- Espèce chimique capable de capter au
moins un proton.
2)-
écrire l’équation de la
réaction entre l’acide acétylsalicylique et l’ion hydrogénocarbonate.
- Équation de la réaction entre l’acide
acétylsalicylique :
AH
(aq)
+
HCO3– (aq)
=
A– (aq)
+ (CO2. H2O) (aq)
3)- Calculer la
constante K de l’équation de la réaction.
Que pouvez-vous déduire de
cette valeur ?
- Constante
K de l’équation de la
réaction :
-
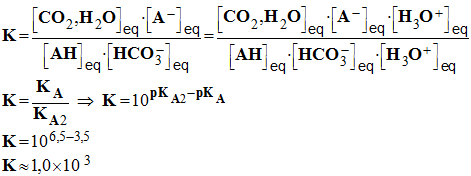
- La réaction est fortement déplacée dans
le sens de la formation des ions acétylsalicylate et du dioxyde de
carbone.
4)- Sachant
qu’une partie du dioxyde de carbone formé passe à l’état gazeux,
quel
est le rôle de l’hydrogénocarbonate de sodium ?
- Le rôle de l’hydrogénocarbonate de sodium
est d’obtenir l’ion acétylsalicylate car l’aspirine est peu soluble dans
l’eau.
- Cela permet de dissoudre l’aspirine dans
l’eau et d’obtenir une solution dont le pH est moins acide.

III-
Préparation
de l’aspirine.
1)- Comment
s’appelle la réaction qui permet d’obtenir de l’aspirine à partir de
l’acide salicylique et d’un acide carboxylique dont on précisera le
nom ?
- La réaction qui permet d’obtenir
l’aspirine à partir de l’acide salicylique est une réaction
d’estérification :
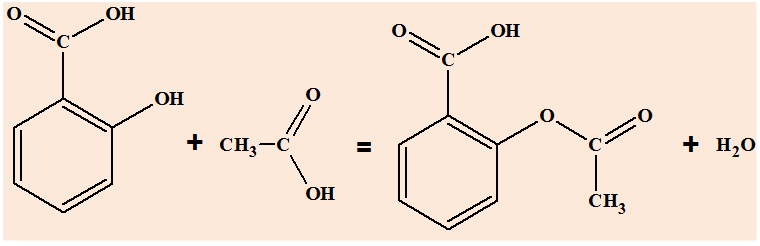
- Comme acide carboxylique, on utilise
l’acide éthanoïque (acide acétique).
2)- On peut
préparer de l’aspirine en utilisant un dérivé de cet acide :
a)- Préciser le nom et la formule de ce
dérivé.
- On peut aussi utiliser un anhydride
d’acide : l’anhydride éthanoïque
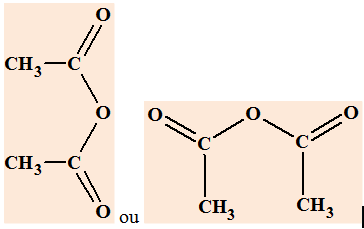
b)- Quel est l’intérêt de cette méthode ?
- Avec l’acide éthanoïque, on est en
présence d’un équilibre chimique, alors qu’avec l’anhydride éthanoïque,
la réaction est totale.
3)-
étude quantitative.
À l’issu d’une préparation de l’aspirine, on a obtenu 400 mg de fins
cristaux
blancs.
On les dissout dans une fiole jaugée de volume
V = 100 mL et on complète
avec
de l’eau distillée jusqu’au trait de jauge.
La totalité de la solution obtenue est transvasée dans un bécher avec
les eaux
de rinçage de la fiole.
Après ajout d’un indicateur coloré approprié, on effectue son dosage par
une
solution aqueuse d’hydroxyde de sodium de concentration
CB = 0,100 mol /
L.
Il faut verser un volume Veq = 20,0 mL pour obtenir l’équivalence.
a)- écrire
l’équation de la réaction qui sert de support au dosage. Pour simplifier
l’écriture, l’acide acétylsalicylique sera noté AH.
- Équation de la réaction qui sert de
support au dosage :
AH
(aq)
+
HO–
(aq)
→
A–
(aq) +
H2O
(ℓ)
b)- Calculer la quantité d’aspirine contenue
dans la solution. En déduire la masse d’aspirine contenue dans les
cristaux. Conclure.
- À l’équivalence, la quantité de matière
d’ions hydroxyde ajouté est égale à la quantité de matière d’aspirine
initialement présente :
- n (aspirine) =
n (HO
–)
- n (aspirine) =
CB .
Veq
- n
(aspirine) = 0,100
×
20
×
10–3
- n (aspirine) = 2,00
× 10
– 3 mol
- Masse d’aspirine présente dans la
solution :
- m (aspirine)=
n
(aspirine)
× M (aspirine)
=>
m
(aspirine) = 2,00
× 10–3
× 180
- m (aspirine) = 360
mg
- m
(aspirine) < 400
mg
- Les cristaux blancs (400 mg) ne sont pas
de l’aspirine pure.
|