|
Méthodes d'analyse chimique |
|
|
|
|
|
|
QCM N°
03
Méthodes
d’analyse chimique
Les méthodes
de suivi d’un titrage
La composition
d’un système
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Un dosage par
titrage
nécessite : |
Une réaction
chimique |
Le tracé
d’une courbe
d’étalonnage |
Des réactifs
titrant
et tiré |
AC |
|
2 |
La réaction
support
d’un titrage
doit
toujours
être : |
Rapide |
Du type
acide-base |
totale |
AC |
|
3 |
À
l’équivalence d’un
titrage : |
Le volume
du réactif
titré
est égal
à celui du
réactif
titrant |
Les réactifs
titré et
titrant
ont été
introduits en
proportions
stœchiométriques. |
Le réactif
titré a
totalement
réagi |
BC |
|
4 |
L’équation de
la réaction
support du
titrage d’une
solution
d’acide fumarique
C4H4O4
(aq) par une
solution
d’hydroxyde de
sodium
s’écrit : C4H4O4 (aq)
+ 2 HO– (aq) → C4H2O42– (aq)
+ 2 H2O (ℓ)
À
l’équivalence du titrage : |
|
|
|
B |
|
5 |
Un titrage peut être
suivi par : |
Conductimétrie |
Colorimétrie |
pH-métrie |
ABC |
|
6 |
L’équivalence
d’un titrage suivi par conductimétrie
est repérée grâce : |
Au saut de
conductivité |
Au changement
de pente de
la courbe
σ
= f (Vtitrant) |
À la méthode
de la courbe
dérivée |
B |
|
7 |
L’équivalence
d’un titrage
suivi par
pH-métrie est
repérée grâce : |
À la méthode
des tangentes |
À la méthode
de la courbe
dérivée |
Au changement
de pente de
la courbe
σ
= f (Vtitrant) |
AB |
|
8 |
Lors d’un
titrage suivi
par
conductimétrie : |
De verser la
solution
titrante
mL par mL |
De resserrer
les mesures
à l’approche
de
l’équivalence |
D’ajouter
un grand
volume d’eau
avant titrage |
AB |
|
9 |
Soit le
titrage suivi par
conductimétrie
d’une
solution
d’acide
chlorhydrique
par une
solution
d’hydroxyde
de sodium.
L’équation
de la réaction
support
du titrage
s’écrit : H3O+ (aq)
+
HO–
(aq)
→
2 H2O
(ℓ) |
Avant
l’équivalence :
la quantité
d’ions oxonium
H3O+
(aq)
diminue |
Avant
l’équivalence :
la quantité
d’ions
hydroxyde
HO–
(aq)
diminue |
Avant
l’équivalence :
la quantité
d’ions
chlorure
Cℓ–
(aq)
diminue |
A |
|
10 |
Soit le
titrage suivi par
conductimétrie
d’une
solution
d’acide
chlorhydrique
par une
solution
d’hydroxyde
de sodium.
L’équation
de la réaction
support
du titrage
s’écrit : H3O+ (aq)
+
HO–
(aq)
→
2 H2O
(ℓ) |
Après
l’équivalence :
la quantité
d’ions oxonium
H3O+
(aq)
est nulle |
Après
l’équivalence :
la quantité
d’ions hydroxyde
HO–
(aq)
augmente |
Après
l’équivalence :
la quantité
d’ions
chlorure
Cℓ–
(aq)
augmente |
AB |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Principe d’un titrage :
|
Titrer une
espèce chimique en solution,
c’est
déterminer sa concentration molaire dans la solution |
|
Le but du
titrage ou d’un dosage est de déterminer
la
concentration molaire d’une espèce chimique
M présente
dans un volume
donné et précis d’une solution. |
La réaction support du titrage :
Équivalence d’un titrage :
|
Équivalence
d’un titrage :
À
l’équivalence, les réactifs sont dans
les
proportions stœchiométriques définies
par les
coefficients de la réaction.
À
l’équivalence, il n’y a pas de réactif limitant. |
L’équivalence du titrage :
|
L’équivalence
d’un titrage
est atteinte lorsqu’on a réalisé
un mélange
stœchiométrique des réactifs titré et titrant. |
|
La relation à
l’équivalence permet de déterminer
la quantité de
réactif titré. |
Relation à l’équivalence :
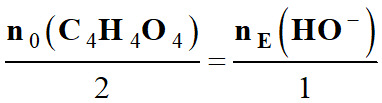 ou
ou
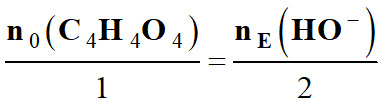 ou
ou
![]()
|
Équation de titrage :
|
a
A |
+
b B |
→ |
c C |
+ d D |
|
Quantités de
matière
à
l’équivalence |
n0
(A)
|
nE
(B)
|
|
|
|
|
Coefficient
stœchiométriques
|
a
|
b |
|
|
|
|
Relation à
l’équivalence |
|
|
|
|
|
Pour les volumes et les concentrations :
![]()
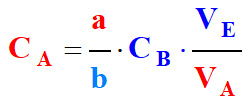
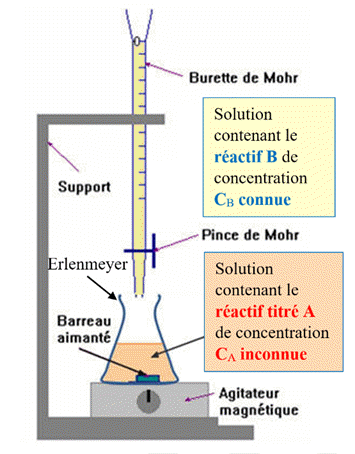
Schéma du montage :
Au cours titrage :
|
Avant l’équivalence |
|
Le
réactif titrant
est
totalement consommé,
c’est le
réactif limitant
Il reste
encore du réactif titré :
il est en excès. |
|
À l’équivalence : |
|
Le
réactif titrant
et le
réactif titré
sont
totalement consommés.
Ils sont tous les deux limitants
(mélange stœchiométrique). |
|
Après l’équivalence |
|
Le
réactif titré
est totalement
consommé :
c’est le
réactif limitant.
Maintenant,
c’est le réactif titrant
qui est
en excès. |
|
En conclusion |
|
À l’équivalence du titrage,
il y a changement de réactif limitant |
Repérage de l’équivalence :
Densité d’un liquide.
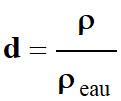 |
|
|
d |
Densité sans
unité |
|
ρ |
Il faut
exprimer les deux masses
volumiques
dans la même unité
Le plus
souvent : (g . L–1) ou (kg . L–1)
ou (kg . m–3) |
Le titre massique en pourcent (ou pourcentage massique)
|
|
|
|
Pm
(E) |
Titre massique
en pourcent sans unité |
|
m
(E) |
Il faut
exprimer les deux masses
dans la même unité
Le plus
souvent : (g) ou (kg) |
Densité et titre massique :
|
|
|
|
t
(E) |
Concentration
en masse (g . L–1) |
|
m
(E) |
Masse de
l’espèce chimique E (g) |
|
Vsolution |
Volume de la
solution (L) |
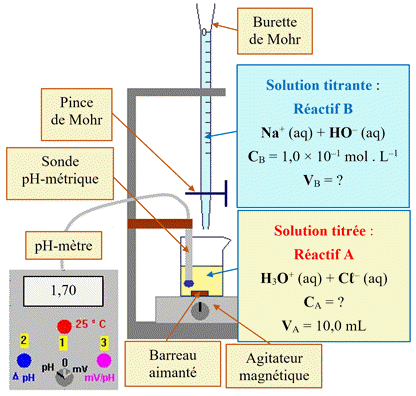
Les méthodes de suivi d’un titrage :
Suivi par pH-métrie :
H3O+
(aq) +
HO–
(aq) →
2 H2O
(ℓ)
Repérage de l’équivalence.
►
Méthode des tangentes :
ZOOM
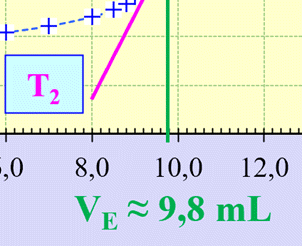
►
La méthode de la courbe dérivée.
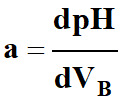
Suivi par conductimétrie :
H3O+
(aq) + HO– (aq) → 2
H2O
(ℓ)
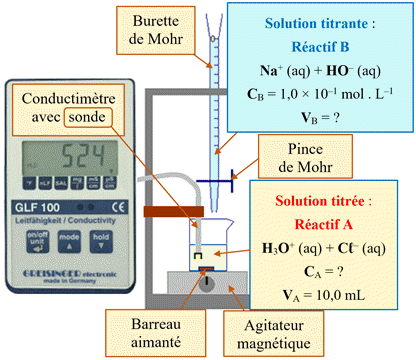
Repérage de l’équivalence.
►
Le point équivalent E :
ZOOM
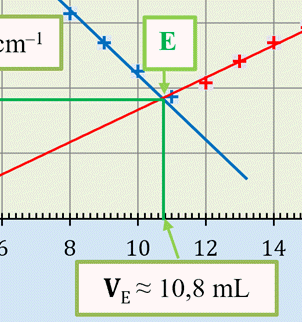
|
Avant l’équivalence |
||
|
Ions |
VB
< VE |
|
|
Na+ |
Ion spectateur
versé :
n
(Na+)
|
|
|
HO– |
Réactif limitant
n
(HO–)
= 0 |
0 |
|
H3O+ |
Réactif en
excès :
n
(H3O+)
|
|
|
Cℓ– |
Ion spectateur
contenu dans le bécher :
n
(Cℓ–) constante |
= |
|
Segment
de droite |
La courbe est
un segment de droite de coefficient
directeur négatif, Car λ (Na+) < λ (H3O+) Le coefficient directeur de la droite est proportionnel à :{ λ (Na+)
– λ (H3O+)} |
|
|
Après l’équivalence |
||
|
Ions |
VB
> VE |
|
|
Na+ |
Ion spectateur
versé :
n
(Na+)
|
|
|
HO– |
Réactif en
excès :
n
(HO–)
|
|
|
H3O+ |
Espèce
entièrement consommée :
n
(H3O+–) = 0 |
0 |
|
Cℓ– |
Ion spectateur
contenu
dans le bécher :
n
(Cℓ–) constante |
= |
|
Segment
de droite |
La courbe est un segment de droite de coefficient directeur positif. Car n (HO–)
et n (Na+) Le coefficient
directeur de la droite est proportionnel
à :{ λ (Na+) + λ (HO–)}
|
|
Composition d’un système lors d’un titrage :
|
Établir la composition d’un système, au
cours d’un titrage,
consiste à
déterminer les quantités de matière des différentes
espèces
présentes dans le milieu réactionnel |
Composition du système dans le bécher :
|
Équation de la réaction de
titrage |
||||||
|
Équation |
|
AH2
(aq) |
+
2
HO–
(aq)
|
→ |
A2–
(aq) |
+ 2
H2O
(ℓ) |
|
État du
système |
Avanc. |
n
(AH2) |
n
(HO–) |
|
n
(A2–) |
solvant |
|
État initial
(mmol) |
x =
0 |
0,40 |
0,50 |
|
0 |
solvant |
|
Au cours
de la
transformation
(mmol) |
x |
0,40
– x |
0,50
– 2 x |
|
x |
solvant |
|
Avancement
Final
(mmol) |
xf |
n0
(AH2)
– xf = 0 |
0 |
|
xf |
solvant |
|
0,25 |
0,15 |
0
Réactif
limitant |
|
0,25 |
solvant |
|
|
|