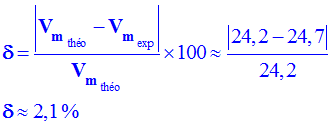|
TP Chimie. N° 10 |
Le volume molaire. Correction |
|
|
Programme 2010 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
|
|
Matériel : |
|
deux balances électroniques, coupelle ou verre de montre, cristallisoir,
éprouvette
graduée de 250 mL. |
|
recharge
de butane pour briquet de 300 mL, tuyau plastique.
|
- Déterminer le volume molaire du butane gazeux dans les conditions de température
et de pression du laboratoire.
![]() Première étape :
Première étape :
- Prendre une recharge de butane, la peser à l’aide d’une balance et noter la valeur de sa masse : m1 ≈ 389,12 g
- Remplir d’eau une éprouvette graduée de 250 mL.
-
Remplir le cristallisoir d’eau aux
¾
environ.
- Retourner l’éprouvette graduée sur le cristallisoir (l’éprouvette
doit être remplie d’eau).
![]() Deuxième étape :
Deuxième étape :
- À l’aide du tube en plastique, remplir l’éprouvette graduée de
butane (gaz) par déplacement de liquide.
- Lorsque le volume de gaz est de 200 mL, arrêter de remplir.
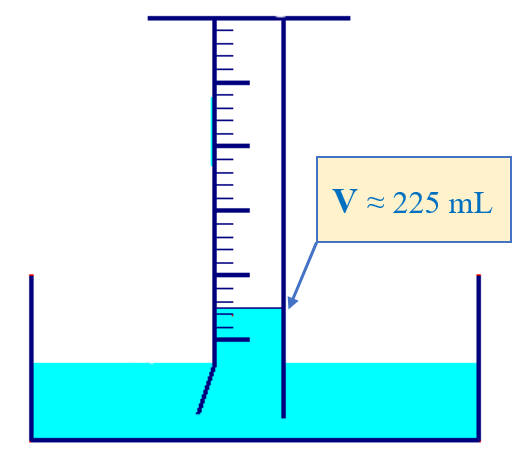
- Laisser reposer quelques minutes, puis noter la valeur exacte du volume de butane à l’état gazeux :
- V = 225
mL .
- Après avoir séché la recharge la peser et noter la nouvelle valeur de
la masse :
m2
≈ 388,60 g
![]() Schématiser les différentes étapes de la manipulation en indiquant la
verrerie utilisée.
Schématiser les différentes étapes de la manipulation en indiquant la
verrerie utilisée.
-
On pèse la recharge de butane à l’aide de la balance électronique :
-
Valeur de la masse :
m1 ≈
389,13 g
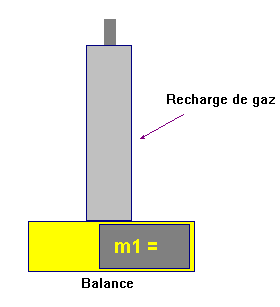
-
Première étape :
-
On remplit l’éprouvette graduée d’eau et on place
délicatement une feuille de papier.
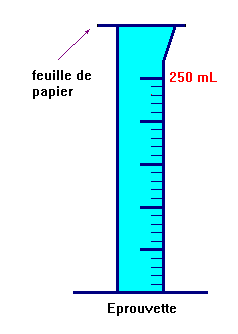
-
Deuxième étape :
-
On retourne délicatement l’éprouvette tout en maintenant la feuille de papier
-
Puis on la plonge dans le cristallisoir et on retire la feuille de papier.
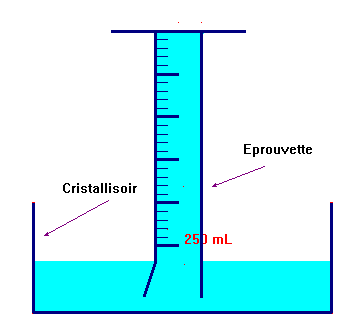
-
Troisième étape :
-
On remplit l’éprouvette de gaz butane de 200 mL environ.
-
On laisse reposer quelques minutes puis on note la valeur exacte du volume de
butane à l’état gazeux :
-
V
≈ 225 mL.
-
On pèse la recharge de gaz
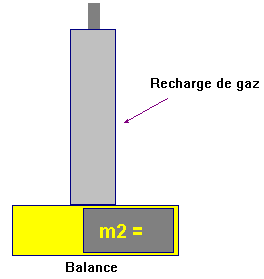
-
m2 ≈ 388,60 g
-
Valeur de la masse :
![]() Indiquer les conditions de température et de pression de l’expérience :
Indiquer les conditions de température et de pression de l’expérience :
- θ
= 21 ° C
et
P =
- déterminer la valeur de la masse
m de butane contenu dans l’éprouvette. Justifier la
réponse.
-
Valeur de la masse m de butane contenu dans l’éprouvette :
-
m
= m1 – m2
-
m
= 389,13 – 388,60
-
m ≈
0,530 g
- Calculer la valeur de la masse molaire
M du butane de formule brute
C4H10.
-
Masse molaire M du butane de formule brute C4H10.
-
M
= 4 M (C) + 10 M (H)
-
M
= 4
x
12,01 + 10
x 1,01
-
M
≈ 58,1 g / mol
- Déterminer la quantité de matière
n de butane contenu dans l’éprouvette graduée.
-
Quantité de matière n de butane contenu dans l’éprouvette graduée.
-
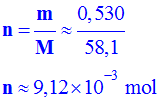
- En déduire la valeur du volume molaire
Vm
exp du butane dans les conditions de température et de pression du laboratoire.
-
Valeur du volume molaire
Vm
exp du
butane dans les conditions de température et de pression du laboratoire :
|
Quantité de matière (mol) |
9,12 x 10–3 |
1 |
|
Volume (L) |
0,225 |
Vm
exp |
-
Vm
exp ≈
24,7 L / mol
- Tirer une conclusion en utilisant la loi d’Avogadro – Ampère.
-
Loi d’Avogadro – Ampère :
-
Énoncé :
-
Des volumes égaux de gaz différents, pris dans les mêmes conditions de
température et de pression, renferment le même nombre de molécules.
-
Il découle de cette loi que des volumes égaux de gaz différents, pris dans les
mêmes conditions de température et de pression, renferment le même nombre de
moles.
-
Ainsi :
-
Une mole de dihydrogène, une
mole de butane, une mole de
méthane occupent le même volume
dans les mêmes conditions de
température et de pression.
a)- Additif :
- Le ° C n’est pas l’unité de température du Système International (S.I).
- L’unité du S.I est le Kelvin (K).
- La température absolue
T s’exprime en Kelvin de symbole K .
- Et la température
θ
s’exprime en degré Celsius : ° C.
- Il existe une relation entre ces deux températures :
- Relation :
T≈θ
+ 273
b)- Volume molaire théorique dans les conditions de l’expérience.
- Sachant que dans les Conditions Normales de Température et de Pression :
- θ = 0 °C et P = 1013 hPa,
- Le volume molaire Vm≈22,4 L / mol.
- Avec la relation suivante :
|
|
P . Vm |
|
|
|
= cte |
|
|
T |
![]() Déterminer la valeur du volume molaire théorique
Vm
théo
dans les conditions de l’expérience.
Déterminer la valeur du volume molaire théorique
Vm
théo
dans les conditions de l’expérience.
-
Les conditions de l’expériences :
T1
= (237 + 21) K et que P1
= 1009 hPa
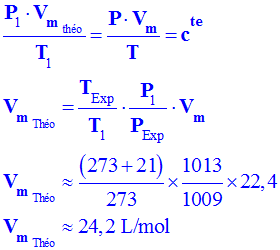
![]() En déduire la valeur du pourcentage d’erreur :
En déduire la valeur du pourcentage d’erreur :
|
δ = |
| Vm théo - Vm exp| |
|
|
|
x 100 |
|
|
Vm théo |
-
La valeur du pourcentage d’erreur :
-