|
conductimétrique Dosage pH-métrique |
Dilution et allure des courbes Utilisation d'un logiciel de simulation de dosage : DOZZZAQUEUX |
|
|
|
|
Dilution et allure des courbes.
Le logiciel de simulation Dozzzaqueux permet de simuler les
courbes de titrage conductimétrique d’une solution SA d’acide
chlorhydrique [H3O+ (aq) + Cℓ–
(aq)] de concentration en quantité de matière CA par une
solution SB d’hydroxyde de sodium (soude) [Na+
(aq) + HO– (aq)] de concentration en quantité de matière CB = 0,100
mol . L–1.
L’objectif est de comparer l’allure des courbes obtenues
pour deux simulations présentant un volume à l’équivalence VB,éqv
= 10,0 mL, mais avec un volume de solution titrée différent :
Cas 1 : VA1 = 100 mL ;
Cas 2 : VA2 = 10 mL.
1)- Vérifier que la
quantité de matière d’espèce titrée est identique dans ces deux cas.
2)- Déterminer les
concentrations des solutions d’acide chlorhydrique CA1 et CA2
dans les cas 1 et 2 respectivement.
3)- Identifier le cas
permettant une détermination de l’équivalence la plus précise.
4)- Conclure sur la précaution à prendre avant d’effectuer un titrage conductimétrique.
1)- Additif : Étude
préliminaire
-
Le but du titrage ou d’un dosage est de
déterminer la concentration molaire d’une espèce chimique
M présente dans un
volume donné et précis d’une solution.
-
L’outil de détermination de cette quantité de
matière est la réaction chimique :
-
C’est la réaction de dosage.
-
Cette réaction doit être rapide, totale,
spécifique et unique.
-
De plus cette transformation doit présenter une
caractéristique physique variant au cours du dosage et facilement mesurable,
ceci afin de suivre l’évolution du système.
b)-
Les réactifs : Dans le cas présent
-
Solution
SA d’acide chlorhydrique [H3O+
(aq) + Cℓ– (aq)]
-
Solution
SB d’hydroxyde de sodium (soude) [Na+
(aq) + HO– (aq)]
-
Réaction chimique :
H3O+ (aq) + HO– (aq) → H2O (ℓ)
-
On est bien en présence d’une réaction rapide,
totale, spécifique et unique.
-
Les ions
Cℓ– (aq) et Na+
(aq) sont des ions spectateurs, mais ils sont présents dans la solution et il
faut en tenir compte lors d’un dosage conductimétrique.
-
Réactif
titrant :
-
Solution
SB d’hydroxyde de sodium (soude) [Na+
(aq) + HO– (aq)]
-
Concentration connue : CB = 0,100
mol . L–1.
-
Réactif
titré :
-
Solution
SA d’acide chlorhydrique [H3O+
(aq) + Cℓ– (aq)]
-
Concentration inconnue : CA = ?
-
il
y a équivalence lorsque les réactifs ont été mélangés dans les proportions
stœchiométriques de la réaction.
-
C’est-à-dire lorsqu’on a réalisé un mélange
stœchiométrique des réactifs titré et titrant.
-
Les deux réactifs de la réaction sont alors
totalement consommés.
d)-
Relation à l’équivalence :
-
Les données :
|
Solution
titrante : Acide |
|
|
Concentration
|
CA1
= ? |
|
Volume d'acide
: |
VA1 |
|
|
|
|
Solution
titrée : Base |
|
|
Concentration
|
CB |
|
Volume de base
|
VBE
= ? |
-
On peut
déterminer la valeur de
VBE,
à l’aide d’une méthode graphique ou à l’aide d’un indicateur coloré suivant le
cas.
-
En conséquence,
à l’équivalence, la quantité de matière d’acide apporté est égale à la quantité
matière de base apportée :
-
nA
= nBE
-
CA1
.
VA1 = CB
.
VBE
-
Cette dernière relation
permet de calculer la concentration inconnue
-
![]()
-
Type de dosage : Dosage conductimétrique :
-
Schéma du montage :
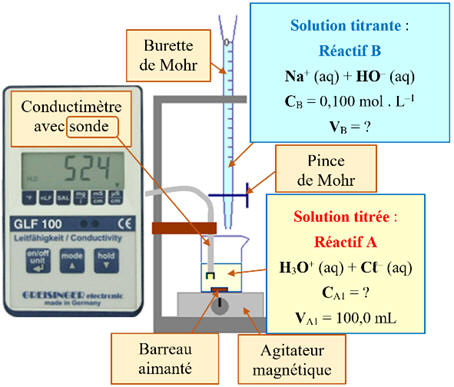
2)- Quantité de matière
d’espèce titrée dans ces deux cas.
-
Cas 1 :
-
Solution
titrée :
-
Solution SA d’acide
chlorhydrique [H3O+ (aq) + Cℓ–
(aq)]
-
Volume initial de la solution :
-
VA1
= 100 mL
-
Concentration initiale de la solution
-
CA1
= ?
-
Solution
titrante :
-
Solution SB d’hydroxyde de
sodium (soude) [Na+ (aq) + HO– (aq)]
-
CB = 0,100 mol . L–1.
-
Volume versé à l’équivalence :
-
VBE
= 10,0 mL
-
Relation à l’équivalence :
-
CA1
.
VA1 = CB
.
VBE
-
Concentration de la solution d’acide
chlorhydrique dans le cas 1 :
-
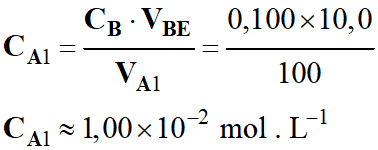
-
Cas 2 :
-
Solution
titrée :
-
Solution SA d’acide
chlorhydrique [H3O+ (aq) + Cℓ–
(aq)]
-
Volume initial de la solution :
-
VA2
= 10 mL
-
Concentration initiale de la solution
-
CA2
= ?
-
Solution
titrante :
-
Solution SB d’hydroxyde de
sodium (soude) [Na+ (aq) + HO– (aq)]
-
CB = 0,100 mol . L–1.
-
Volume versé à l’équivalence :
-
VBE
= 10,0 mL
-
Relation à l’équivalence :
-
CA2
.
VA2 = CB
.
VBE
-
Concentration de la solution d’acide
chlorhydrique dans le cas 2 :
- 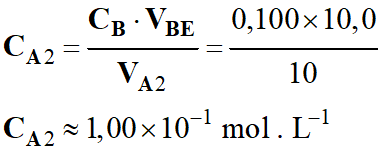
III- Simulation de dosage
à l’aide du logiciel Dozzzaqueux.
-
Le logiciel de simulation Dozzzaqueux permet de
simuler les courbes de titrage conductimétrique d’une solution
SA d’acide chlorhydrique
[H3O+
(aq) + Cℓ– (aq)]
de concentration en quantité de matière
CA par une solution SB
d’hydroxyde de sodium (soude) [Na+
(aq) + HO– (aq)] de
concentration en quantité de matière CB
= 0,100 mol . L–1.
-
Le logiciel :
-
Logiciel libre et gratuit de simulation de
courbes de dosage en solution aqueuse.
-
Dozzzaqueux est un logiciel de simulation de
courbes de dosage en solution aqueuse.
-
Il est librement téléchargeable à l’adresse :
http://jeanmarie.biansan.free.fr/dozzzaqueux.html
-
L'utilisateur sélectionne les réactifs présents
dans le bécher et dans la burette.
-
Dozzzaqueux calcule, pour diverses valeurs du
volume versé, les quantités de matière des espèces présentes à la fin de la
réaction.
-
Une fois les calculs faits, Dozzzaqueux permet
différents tracés dont les courbes de titrage conductimétrique ou pH-métrique.
b)-
Construction pas à pas du dosage
-
La construction se fait par validation des
onglets successifs.
-
Vous pouvez toujours revenir sur un onglet
antérieur en cliquant sur l'onglet voulu.
-
Si vous faites des modifications, il faudra les
revalider.
a)-
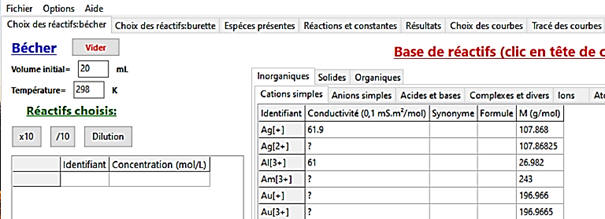
Paramétrage du contenu du bécher.
-
Dans le bécher :
-
La solution titrée : Solution SA
d’acide chlorhydrique [H3O+ (aq) + Cℓ–
(aq)]
-
Dans le
cas 1 :
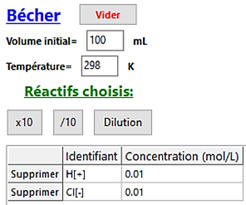
-
Cliquer sur le bouton en bas à gauche « Valider
et passer à la burette »
-
Explication pour les différentes valeurs :
-
Dans le
cas 1 :
|
Solution titrée :
Réactif A
H3O+
(aq) + Cℓ– (aq)
CA1
= 1,00 × 10–2 mol . L–1
VA1
= 100,0 mL |
b)-
Paramétrage du contenu de la burette :
-
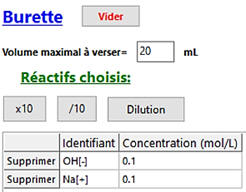
Dans la burette :
|
Solution titrante :
Réactif B
Na+
(aq) + HO– (aq)
CB
= 0,100 mol . L–1
VB
= 20,0 mL |
-
Explication pour les différentes valeurs :
-
Dans le cas de la burette, on choisit comme
volume versé, VB
= 20,0 mL, car le volume de soude versé à l’équivalence est VBE
= 10,0 mL
-
Valider vos choix en cliquant sur « Valider et
passer au recensement ».
c)-
Recensement des espèces présentes :
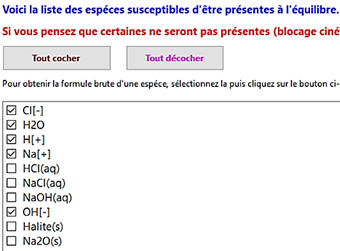
-
Il faut décocher les espèces qui ne sont pas
présentes.
-
Cliquer sur « Valider » et passer aux constantes
de réaction.
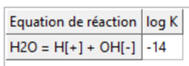
-
Cliquer sur Valider et lancer les calculs.
-
C’est la constante de la réaction suivante :
-
Réaction acide – base :
-
H3O+
(aq) +
HO– (aq) → H2O (ℓ) :
K = 1014
-
Réaction quasi totale
-
C’est la réaction inverse de l’autoprotolyse de
l’eau :
-
H2O
(ℓ) = H3O+
(aq) + HO– (aq) K
= Ke = 10–14
-
Réaction très limitée.
-
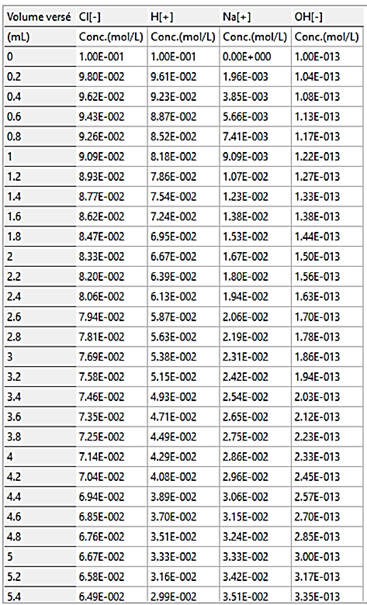
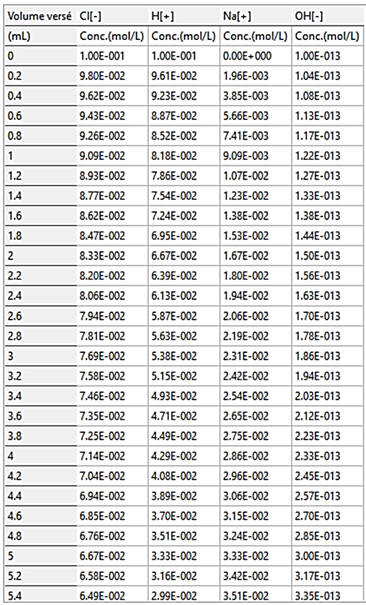
On peut exporter les résultats bruts (format
.csv) et les exploiter avec le tableur Excel.
-
Exemple : Une partie du tableau
|
VB |
Cl- |
H+ |
Na+ |
HO- |
|
mL |
(mol/L) |
(mol/L) |
(mol/L) |
(mol/L) |
|
0,00 |
0,01 |
0,01 |
0 |
1,00E-12 |
|
0,20 |
0,00998004 |
0,00978044 |
0,0001996 |
1,02E-12 |
|
0,40 |
0,00996016 |
0,00956175 |
0,00039841 |
1,05E-12 |
|
0,60 |
0,00994036 |
0,00934394 |
0,00059642 |
1,07E-12 |
|
0,80 |
0,00992063 |
0,00912698 |
0,00079365 |
1,10E-12 |
|
1,00 |
0,00990099 |
0,00891089 |
0,0009901 |
1,12E-12 |
|
1,20 |
0,00988142 |
0,00869565 |
0,00118577 |
1,15E-12 |
|
1,40 |
0,00986193 |
0,00848126 |
0,00138067 |
1,18E-12 |
|
1,60 |
0,00984252 |
0,00826772 |
0,0015748 |
1,21E-12 |
|
1,80 |
0,00982318 |
0,00805501 |
0,00176817 |
1,24E-12 |
|
2,00 |
0,00980392 |
0,00784314 |
0,00196078 |
1,27E-12 |
|
… |
… |
… |
… |
… |
|
… |
… |
… |
… |
… |
f)-
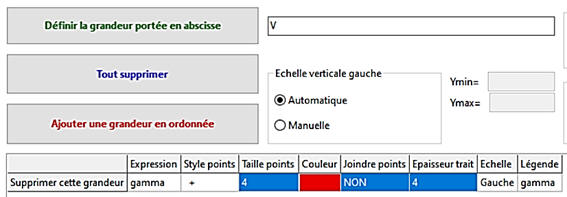
Représentation graphique :
-
En abscisse, on met la grandeur
V qui représente le volume versé de
solution.
-
En ordonnée, on met la grandeur « gamma »
qui représente la conductivité de la solution en S . m–1
-
On peut choisir le type de marque, la taille, la
couleur et l’épaisseur du trait.
-
Ne pas joindre les différents points.
-
Mise en
forme du graphique obtenu :
-
On peut modifier le titre du graphique, la
couleur, les axes, …
-
On peut mettre l’échelle de l’ordonnée à droite
ou à gauche du graphique.
-
Graphique après les différents choix :
-
Cliquer sur « Export graphe » :
type d’image, on peut choisir « JPEG »
-
Comme taille d’image, on peut choisir :
-
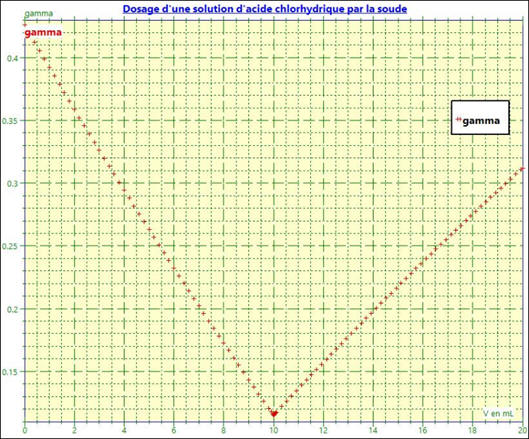
On obtient le graphe suivant :
-
Avant de poursuivre, on enregistre le film de la
simulation.
Nom : dosage01.doz
4)-
Cas 2 :
On réalise une nouvelle simulation :
a)-
Paramétrage du contenu du bécher.
-
Dans le bécher :
-
La solution titrée : Solution SA
d’acide chlorhydrique [H3O+ (aq) + Cℓ–
(aq)]
-
Dans le
cas 2 :
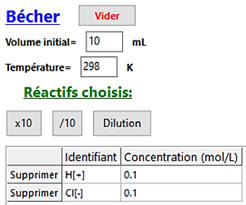
-
Cliquer sur le bouton en bas à gauche « Valider
et passer à la burette »
-
Explication pour les différentes valeurs :
-
Dans le
cas 2 :
|
Solution titrée :
Réactif A
H3O+
(aq) + Cℓ– (aq)
CA2
= 1,00 × 10–1 mol . L–1
VA2
= 10,0 mL |
b)-
Paramétrage du contenu de la burette : Idem que
précédemment.
-
Dans la burette :
les données de la burette ne changent pas.
|
Solution titrante :
Réactif B
Na+
(aq) + HO– (aq)
CB
= 0,100 mol . L–1
VB
= 20,0 mL |
-
Explication pour les différentes valeurs :
-
Dans le cas de la burette, on choisit comme
volume versé, VB
= 20,0 mL, car le volume de soude versé à l’équivalence est VBE
= 10,0 mL

-
Valider vos choix en cliquant sur « Valider et
passer au recensement ».
c)-
Recensement des espèces présentes : Idem que
précédemment

-
Il faut décocher les espèces qui ne sont pas
présentes.
-
Cliquer sur « Valider » et passer aux constantes
de réaction.
d)-
Constantes de réaction. Idem que précédemment.

- Il se produit la même réaction chimique
-
Cliquer sur Valider et lancer les calculs.
-
On peut exporter les résultats bruts (format
.csv) et les exploiter avec le tableur Excel.
f)-
Représentation graphique :
-
En abscisse, on met la grandeur
V qui représente le volume versé de
solution.
-
En ordonnée, on met la grandeur « gamma »
qui représente la conductivité de la solution en S . m–1
-
On peut choisir le type de marque, la taille, la
couleur et l’épaisseur du trait.
-
Ne pas joindre les différents points.
-
Mise en
forme du graphique obtenu :
-
On peut modifier le titre du graphique, la
couleur, les axes, …
-
On peut mettre l’échelle de l’ordonnée à droite
ou à gauche du graphique.
-
Graphique après les différents choix :
-
Cliquer sur « Export graphe » :


-
On obtient le graphe suivant :
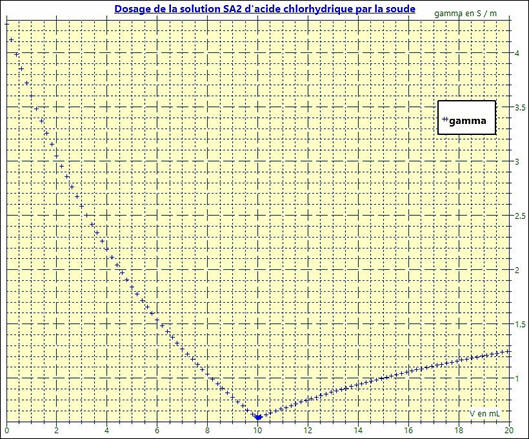
-
Avant de poursuivre, on enregistre le film de la
simulation.

Nom : dosage02.doz
5)- Superposition des
deux courbes :
-
Cliquer sur « Superposer »
-
Puis cocher les courbes à superposer.
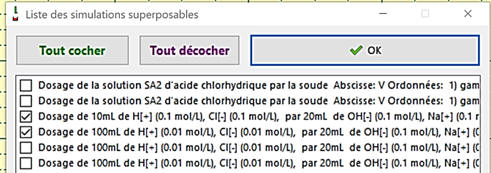
-
Cocher la case : Superp.
-
Cliquer sur « Export graphe » :
type d’image, on peut choisir « JPEG »

-
Comme taille d’image, on peut choisir :

-
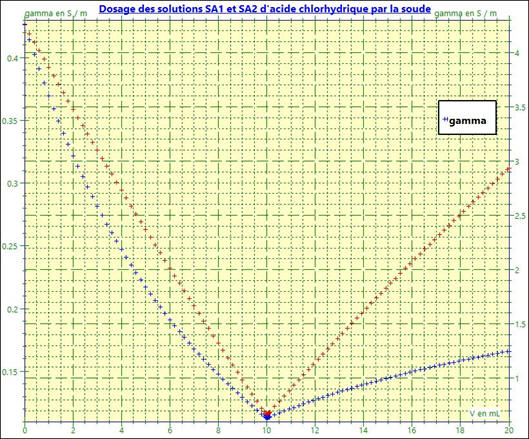
On obtient le graphe suivant :
Pour aller plus loin : Dosage conductimétrique :
6)- Cas permettant une
détermination de l’équivalence la plus précise :
-
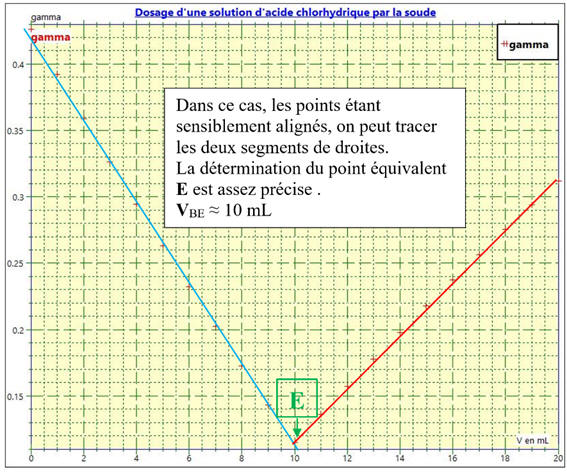
La courbe rouge : Dans le
cas 1 :
-
Dosage de la solution
SA1 par la soude
-
Les points sont sensiblement alignés.
-
On obtient deux portions de droite.
-
Le point équivalent
E :
-
Le point
équivalent E est le point de rupture
de la courbe de σ = f (VB).
-
Au point équivalent
E, on change de réactif
limitant et la courbe change de segment de droite.
-
Le point équivalent
E est caractérisé par ses
coordonnées : σE et VE.
-
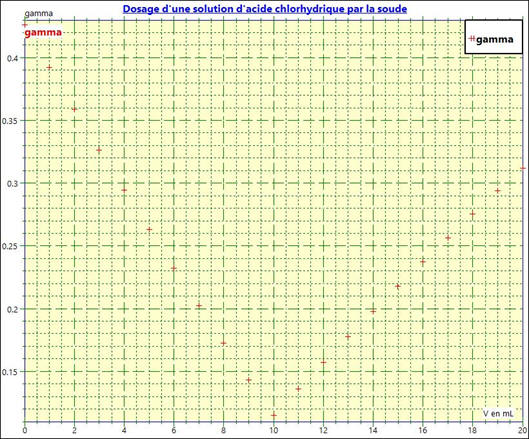
Pour bien montrer le phénomène, on va prendre le
cas ou l’on possède une vingtaine de mesures :
-
Pour simuler le dosage avec un nombre moins
important de points.
-
Puis :
-
On obtient le graphe suivant :
-
Exploitation du graphe :
-
Le point
équivalent E est situé à
l’intersection des deux segments de droite.
-
Il est facile à repérer.
-
Dans ce cas, l’effet de dilution lors du dosage
est faible. On peut le négliger.
- Le volume de la solution de départ est VA1 = 100 mL.
-
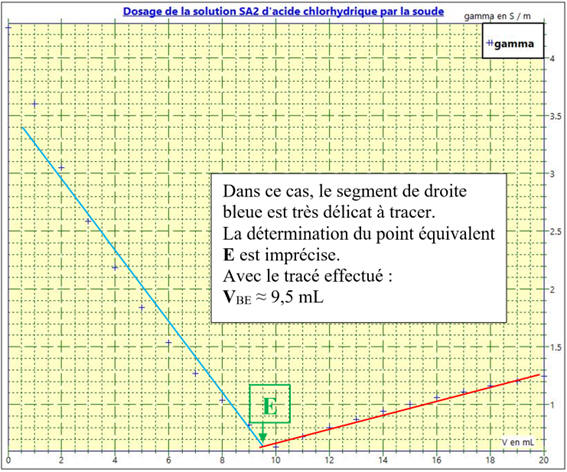
La courbe bleue :
Dans le cas 2
-
On simule le dosage avec un nombre moins
important de points.

-
Puis :

-
On obtient le graphe suivant :
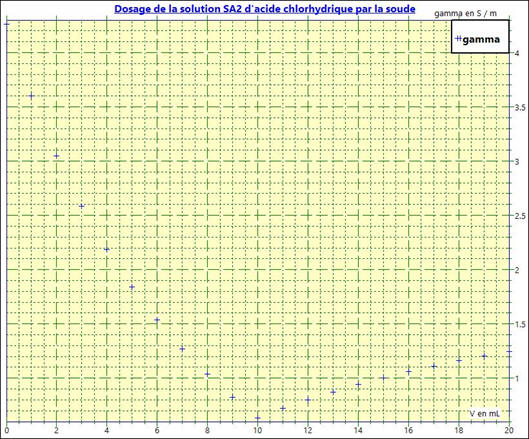
-
Dosage de la solution
SA2 par la soude
-
Les points ne sont pas alignés.
-
Le repérage du point équivalent
E est imprécis.
-
Exploitation du graphe :
-
Lorsque les courbes obtenues ne sont pas des
droites, la détermination du point équivalent
E est moins précise.
-
Dans ce cas, l’effet de dilution lors du dosage
est important.
-
Le volume de solution de réactif titrant à la fin
du dosage n’est pas négligeable par rapport au volume de la solution de réactif
titré.
-
Dans ce cas, il faut diluer la solution à titrer.
-
Le plus souvent on ajoute de l’eau distillée.
-
Cela permet :
-
D’une part de diluer la solution sans changer la
quantité de matière à titrer et de ce fait on ne modifie pas l’équivalence ;
-
D’autre part de mieux repérer l’équivalence et de
mieux immerger l’électrode.
Suivi d’un dosage par conductimétrie :
-
Courbe d’un titrage suivi par conductimétrie :
-
Lors d’un dosage conductimétrique, il faut faire
attention au phénomène de dilution.
-
Il ne faut pas travailler avec des solutions trop
concentrées.
-
Le volume de solution de réactif titrant à la fin
du dosage doit être négligeable par rapport au volume de la solution de départ.
-
Ainsi dans le
Cas 1,
VA1 = 100 mL,
VBE = 10,0 mL et
VBfinal = 20,0 mL
-
Alors que dans le
Cas 2 :
VA2 = 10 mL,
VBE = 10,0 mL et
VBfinal = 20,0 mL
-
Ouvrir le logiciel : Dozzaqueux.
Sélectionner : dosage01.doz

-
Lorsque le fichier est chargé,
-
On peut visualiser :
-
Le contenu du bécher,
-
Le contenu de la burette,
-
Les espèces présentes,
-
Réactions et constantes,
-
Résultats,
-
Choix des courbes,
-
Tracé des courbes.
b)-
Affichage de la courbe
pH =
f (VB)
-
Cliquer sur l’icône : « Choix des courbes »
-
En abscisse, on choisit
V qui représente le volume de soude
versé
-
En ordonnée, on choisit
pH.
-
On peut supprimer la grandeur « gamma ».
-
On clique sur « Valider et tracer les courbes »
-
La courbe
pH = f (VB) :
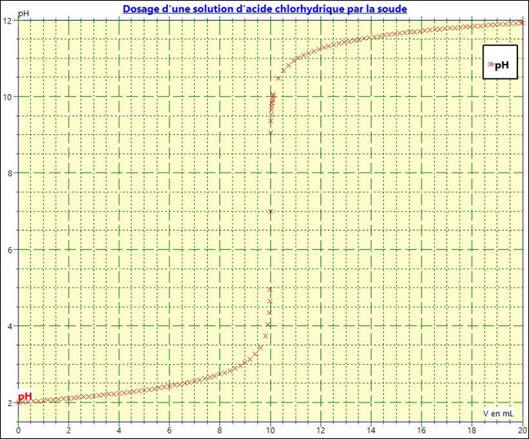
-
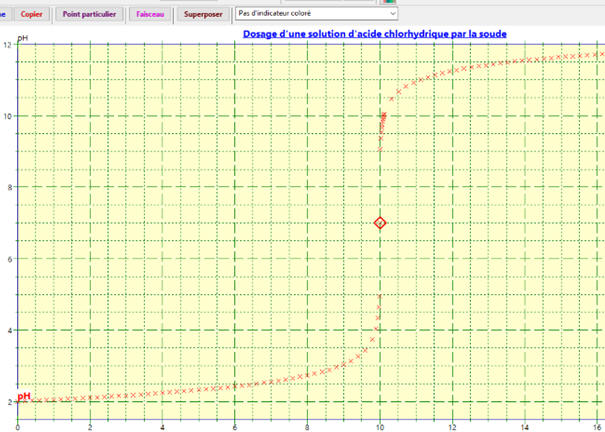
On peut rajouter un indicateur coloré : dans le
cas présent le B.B.T
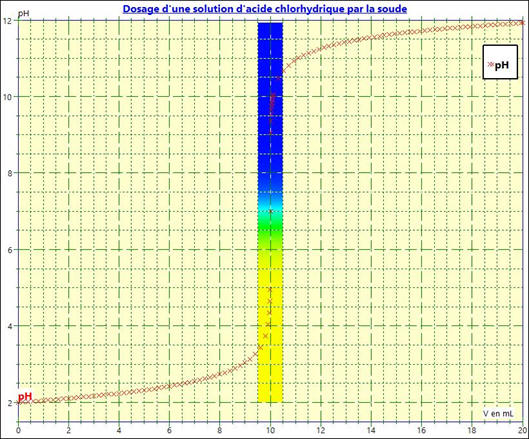
-
En cliquant sur point particulier, on a toutes
les données relatives au point équivalent
E.

-
Ouvrir le logiciel : Dozzaqueux.

Sélectionner : dosage02.doz

-
Lorsque le fichier est chargé,
b)-
Affichage de la courbe
pH =
f (VB)
-
Courbe pH
= f (VB)
:
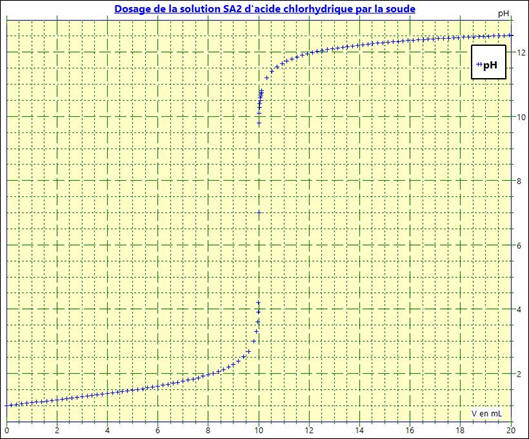
3)- Superposition des
deux courbes :
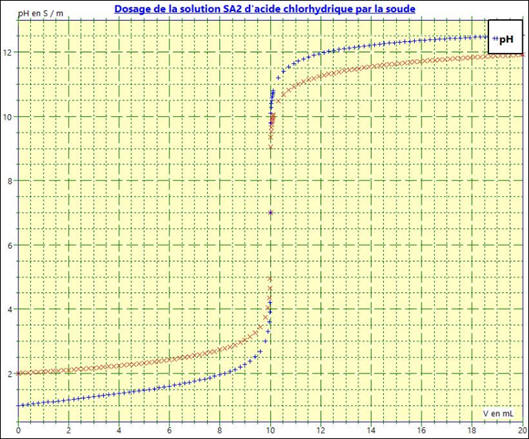
-
La courbe rouge :
-
Cas 1,
VA1 = 100 mL,
VBE = 10,0 mL et
VBfinal = 20,0 mL
-
CA1
= 1,00 × 10–2 mol . L–1
-
La courbe bleue :
-
Cas 2 :
VA2 = 10 mL,
VBE = 10,0 mL et
VBfinal = 20,0 mL
-
CA2
= 1,00 × 10–1 mol . L–1
-
Le phénomène de dilution réduit l’ampleur du saut
de pH.
-
Le point équivalent
E reste le même.
-
Pour déterminer les coordonnées du point
équivalent E, on peut utiliser la
méthode des tangentes.
-
On peut aussi utiliser la courbe de la fonction
dérivée ![]() .
.
Contrôle de qualité par dosage.
Les différents types de dosage.