|
Méthodes d’analyse d’un système chimique |
|
|
|
|
|
|
QCM N° 02
Méthodes d’analyse d’un système chimique Pour
chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’absorbance d’une
solution : |
Est
grande si
la solution est
opaque |
Est
grande si
la solution est
transparente |
Est
nulle si
la solution est
parfaitement
transparente |
AC |
|
2 |
Une solution qui
absorbe uniquement le bleu
paraît :
|
Rouge |
Bleue |
Jaune |
C |
|
3 |
D’après la loi de Beer-Lambert, l’absorbance d’une solution est proportionnelle
à ; |
La
concentration de
l’espèce
chimique
absorbante |
L’épaisseur de
la solution
traversée |
La
longueur
d’onde de
travail |
AB |
|
4 |
Un spectre
d’absorption est la représentation
graphique : |
De
la
longueur d’onde en
fonction de
la
concentration |
De
l’absorbance en
fonction de
la
concentration |
De
l’absorbance en
fonction de
la
longueur d’onde |
C |
|
5 |
Un spectre
infrarouge donne la
représentation graphique : |
De
la
transmittance en
fonction du
nombre
d’onde |
Du
nombre
d’onde en
fonction de la
transmittance |
De
la
Transmittance en
fonction de
la
longueur
d’onde |
A |
|
6 |
L’équation de la
réaction de dissolution de
Fe2(SO4)3
(s) est : |
Fe2(SO4)3
(s) → 2
Fe3+ (aq) + 3
SO42– (aq) |
Fe2(SO4)3
(s) → 3
Fe3+ (aq) + 2
SO42– (aq) |
Fe2(SO4)3
(s) → 2
Fe23+ (aq) + 3
(SO4)32– (aq) |
A |
|
7 |
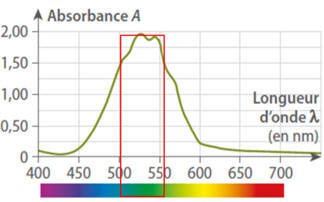
Selon le spectre
d’absorption d’une solution de permanganate de potassium, la
couleur absorbée par la solution
est : |
Le
jaune |
Le
vert |
Le
violet |
B |
|
8 |
Une solution
absorbant la radiation vers 530
nm paraît : |
Jaune |
Verte |
Magenta |
C |
|
9 |
Dans un dosage par étalonnage colorimétrique, il
faut : |
Réaliser une
échelle des
teintes en
diluant la
solution à
tester |
Parfois diluer la
solution à
tester |
Réaliser une
échelle des
teintes en
diluant une
solution connue |
BC |
|
10 |
On trace l’évolution de l’absorbance en fonction de la concentration. Si la loi de Beer-Lambert est vérifiée, la courbe-modèle
est : |
Une
parabole |
Une
droite
passant par
l’origine |
Une
droite ne
passant pas
par
l’origine |
B |
|
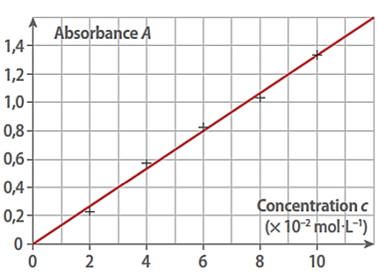
11 |
On obtient la
courbe suivante lors du dosage par
étalonnage spectroscopique
d’une solution de sulfate de
cuivre II : L’absorbance de la solution est A = 1,2.
La concentration de la solution est donc :
|
C
= 6 × 10–2 mol
. L–1 |
C
= 8 × 10–2 mol
. L–1 |
C
= 9 × 10–2 mol
. L–1 |
C |
|
12 |
Un spectre infrarouge permet : |
De
déterminer les
groupes
caractéristiques
d’une molécule |
De
déterminer le
nombre
d’atomes de
carbone
qu’une
molécule
contient |
De
déterminer les
liaisons
présentes dans une
molécule |
AC |
|
13 |
La molécule dont le spectre infrarouge est représenté ci-dessous :
|
Contient une
liaison O
– H |
Contient une
liaison C
= O |
Peut
être un
alcool |
AC |
Méthodes d’analyse d’un système chimique
Pour s’auto-évaluer
Mesure de l’absorbance d’une solution par
spectrophotométrie.
-
On utilise le fait que toute solution colorée absorbe la lumière visible
(400 nm < λ0 < 800 nm).
-
Lorsqu’un faisceau de lumière monochromatique traverse un milieu
absorbant, l’intensité lumineuse I du faisceau transmis est inférieure à
l’intensité lumineuse I0 du faisceau incident.
-
L’absorbance A : 
Couleurs complémentaires :
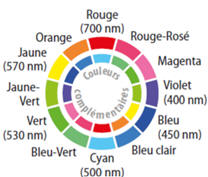
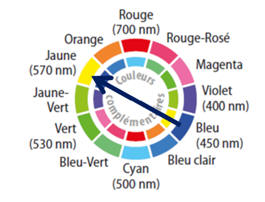
Loi de Beer-Lambert.
-
Pour les solutions suffisamment diluées, l’absorbance A est
proportionnelle à la concentration C de l’espèce colorée : A =
k . C
-
Définition :
|
L’absorbance d’une
solution diluée contenant une espèce colorée est proportionnelle
à la concentration (effective) C de cette espèce et à l’épaisseur
ℓ (cm) de la solution traversée par le faisceau lumineux. |
|
A
(λ) = ε (λ) . ℓ . C |
|
A :
absorbance : grandeur sans unité |
|
ℓ :
largeur de la cuve (épaisseur de la solution traversée) (cm) |
|
ε
(λ) : coefficient d’extinction molaire (mol– 1. L.
cm– 1) |
|
C :
concentration de l’espèce absorbante (mol . L– 1) |
-
ε (λ) est appelé coefficient d’extinction molaire ou
coefficient d’absorption molaire
-
Il dépend de la nature de l’espèce dissoute et de la longueur d’onde de
la radiation utilisée.
-
La courbe A = f (C) constitue la courbe d’étalonnage
de la substance étudiée.
-
Elle permet de déterminer la concentration d’une solution de la substance
étudiée.
-
Elle permet donc de doser une espèce chimique colorée.
-
Remarque : la solution colorée doit être suffisamment diluée,
-
C ≤ 1,0 × 10–2 mol . L–1, et le
spectrophotomètre ne doit pas saturer.
Cas d’une solution aqueuse de diiode :
-
Au plus l’absorbance est élevée, au plus la valeur de l’absorbance est
grande.
-
La solution aqueuse de diiode I2 (aq), absorbe
principalement dans le bleu clair et un peu dans le vert.
-
La solution est jaune à jaune-orangé en lumière blanche (cela dépend de
la concentration).
Présentation d’un spectre IR.
-
La spectroscopie IR est une spectroscopie d’absorption.
-
Les composés organiques absorbent aussi dans le domaine de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance T ou intensité lumineuse transmise par
l’échantillon analysé en ordonnée (elle s’exprime en pourcentage)
-
Lorsqu’un faisceau de lumière monochromatique traverse un milieu
absorbant, l’intensité lumineuse I du faisceau transmis est inférieure à
l’intensité lumineuse I0 du faisceau incident.
-
Pour évaluer cette diminution, on utilise :
-
La transmittance T : 
-
Le nombre d’ondes σ en abscisse.
-
Le nombre d’ondes σ est l’inverse de la longueur d’onde λ.
-

-
Unité :
-
Généralement, le nombre d’ondes σ s’exprime en cm–1 en
chimie organique.
-
En chimie organique, les radiations infrarouges exploitées vont de 400 cm–1
à 4000 cm–1.
-
(25 μm à 250 μm)
-
Cette spectroscopie peut se faire en phase gazeuse ou en phase condensée.
-
Exemple : Spectre de la propanone.
-
Remarque :
-
Une faible valeur de transmittance correspond à une forte absorption.
-
Les bandes d’absorption sont orientées vers le bas.
-
L’axe des abscisses est orienté vers la gauche. Cette échelle n’est pas
toujours linéaire.
Équation de dissolution :
-
Écriture d’une équation de dissolution :
-
Il faut respecter la conservation de l’élément chimique et la
conservation de la charge électrique.
-
Formule des ions hydratés : on utilise la notation simplifiée suivante :
-
Fe3+ (aq) et SO42– (aq)
-
On ne précise pas le nombre de molécules d’eau qui entoure chaque ion.
|
|
H2O |
|
|
Fe2(SO4)3
(s) |
→ |
2 Fe3+
(aq) + 3 SO42– (aq) |
La solution de permanganate de potassium absorbe dans le
vert.
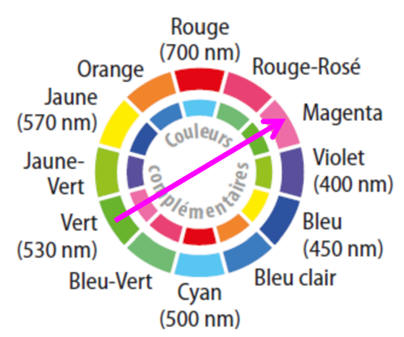
- La solution aqueuse de permanganate de potassium est de couleur violette (magenta) en lumière blanche
- Le filtre magenta absorbe la lumière verte. Il laisse passer la lumière bleue et la lumière rouge.

Couleurs complémentaires :
-
La couleur complémentaire du vert est le magenta.
-
En synthèse additive, deux couleurs sont dites complémentaires si leur
synthèse additive donne du blanc.
|
La couleur complémentaire
du
rouge
est
le
cyan
: |
|
|
La couleur
complémentaire
du
vert
est
le magenta
: |
|
|
La couleur
complémentaire
du
bleu
est
le jaune
: |
|
-
En synthèse soustractive, deux couleurs sont dites complémentaires si
leur synthèse soustractive donne du noir.
|
La couleur complémentaire
du
cyan
est
le
rouge : |
|
|
La couleur
complémentaire
du
magenta
est
le
vert : |
|
|
La couleur
complémentaire
du
jaune
est
le
bleu : |
|
Dosage par étalonnage :
|
Réaliser un
dosage par étalonnage consiste à déterminer la concentration
d’une espèce en solution en comparant une grandeur
physique, caractéristique de la solution, à la même grandeur
physique mesurée pour des solutions étalon. |

Loi de Beer-Lambert :
Exploitation graphique :
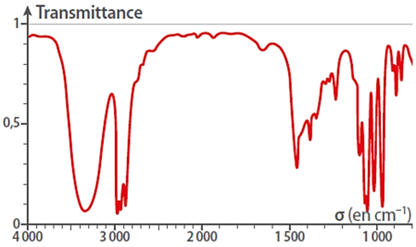
Exemple de spectre infrarouge (IR).
Spectre IR de l’éthanol à l’état condensé :
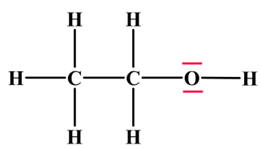
Éthanol : CH3 – CH2
– OH
Schéma de Lewis de l’éthanol :
|
|