|
Structures et propriétés. Synthèses organiques. |
|
|
|
|
|
|
QCM N° 10
Structures et
propriétés. Synthèses organiques.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une
représentation topologique fait
apparaitre :
|
Tous les atomes
sauf les atomes
de C et de
H
non fonctionnels |
Tous les atomes
sauf H et
C |
Tous les atomes |
A |
|
2 |
|
Est une
formule
développée |
Est une formule
semi-développée |
Est une formule
topologique |
C |
|
3 |
CH3
̶ CH2
̶ Br
est : |
Un alcène |
Un halogénoalcane |
Une amine |
B |
|
4 |
Une amine
comporte : |
Au moins un atome
d’oxygène O |
Un atome
d’azote N
doublement lié
à un atome
de carbone C |
Un atome
d’azote N
simplement lié
à un atome
de carbone C |
C |
|
5 |
Un polymère est :
|
Un assemblage
d’éléments qui se
répètent un grand
nombre de fois |
Une
macromolécule |
Un type de
molécule très
répandu et aux
usages multiples |
ABC |
|
6 |
Peut être
obtenu à
partir de :
|
|
|
|
B |
|
7 |
Une
polymérisation : |
Est une synthèse
donnant
deux isomètres |
Est une synthèse
donnant une
macromolécule
appelée polymère |
Est une synthèse
formant un
matériau
plastique |
B |
|
8 |
Une
polyaddition : |
Est l’addition
d’un grand nombre
de fois d’un
monomère sur
lui-même sans
perte d’atomes |
Est l’addition
d’un grand nombre
de fois d’un même
monomère sur une
seule molécule |
Est le résultat
de
plusieurs
additions
de différents
monomères sur
une seule
molécule |
A |
|
9 |
En spectroscopie
UV-visible : |
2 espèces
chimiques
différentes
peuvent
posséder le même
λmax. |
Le λmax
d’une
espèce chimique
dépend de sa
concentration en
solution |
Une espèce
chimique
donnée possèdera
toujours le même
λmax. |
C |
|
10 |
Un spectre IR
permet
de déterminer :
|
La formule
topologique
d’un composé |
Les liaisons
covalentes
qui composent
lala molécule |
Les groupes
caractéristiques
de la molécule |
C |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Représentation topologique :
-
La chaîne carbonée est représentée sous forme de ligne brisée.
-
Les atomes autres que de carbone C et
d’hydrogène H sont représentés de
manière explicite ainsi que les atomes d’hydrogène
H qu’ils portent.
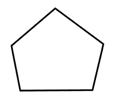
Le cyclopentane :
-
Formule semi-développée :
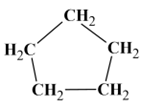
-
Formule topologique :
Halogénures d’alkyle : lien
-
On appelle halogénures d’alkyle tout composé
organiques possédant un atome d’halogène (
Cl,
Br,
I,
F) lié à un atome de
carbone par une simple liaison.
-
Formule générale :
R ̶
X
-
Leur nom s’obtient en faisant précéder le nom de
l’alcane correspondant du préfixe chloro, bromo, iodo ou fluoro, précédé
de son indice de position.
- Chimie N° 08 Les groupes caractéristiques
Les amines : lien
-
On appelle amine tout composé organique obtenu en remplaçant dans la molécule
d’ammoniac NH3, un, deux
ou trois atomes d’hydrogène par un, deux ou trois groupes alkyles.
-
On distingue les amines primaires, les amines secondaires et les amines
tertiaires.
-
Nomenclature des amines primaires :
- On nomme l’amine à partir du nom de l’alcane
R –
H correspondant,
avec élision du
e,
que l’on fait suivre de la terminaison amine
en précisant la position du groupe
– NH2.
Les polymères :
-
Un polymère est un composé obtenu par polymérisation.
-
La polymérisation est une réaction chimique consistant à lier des monomères pour
obtenir une macromolécule.
-
Un polymère est une macromolécule constituée
d'une chaîne d'unités répétitives appelées monomères,
liées entre elles par des liaisons covalentes.
-
Les polymères ont généralement une masse moléculaire élevée.
Polymérisation :
-
-
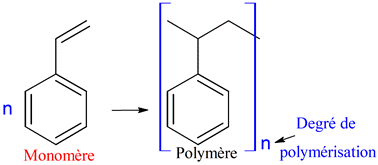
Une réaction de polymérisation permet d’obtenir les macromolécules constituant
le polymère à partir d’un grand nombre de molécules identiques appelées
monomères.
-
Dans la macromolécule, une unité structurale appelée motif se répète un grand
nombre de fois.
-
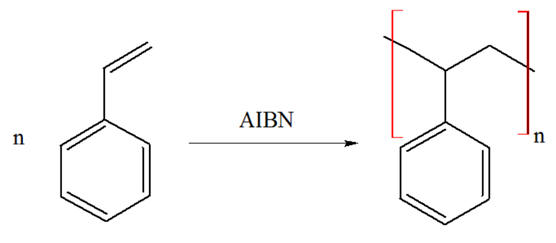
Exemple : le polystyrène
Polyaddition :
-
C’est une polymérisation par additions successives d’une molécule.
-
La polyaddition de molécules d’éthène (ou éthylène) conduit à un polymère, le
polyéthylène.
-
La polymérisation par polyaddition permet de rallonger la chaîne carbonée d’un
composé organique comportant une double liaison
C = C par réaction d’addition, les unes à la suite des autres, d’un
nombre de ces molécules, appelées monomères.
-
Le produit de cette addition est une macromolécule.
Spectroscopie UV-visible :
-
Les solutions colorées absorbent certaines radiations dans le domaine du
visible, dont la longueur d’onde est comprise entre :
-
400 nm ≤ λ ≤ 800 nm
-
Les solutions incolores peuvent absorber des radiations dans le domaine
ultraviolet :
-
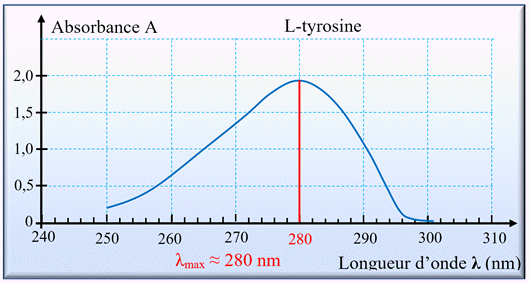
Pour une espèce chimique colorée, on peut tracer le graphe donnant l’absorbance
A en fonction de la longueur d’onde λ.
-
On obtient alors le spectre d’absorption de l’espèce chimique.
-
La valeur de la longueur d’onde correspondant à l’absorbance maximale λmax
du spectre d’absorption peut permettre l’identification d’une espèce chimique.
-
Exemple :
- Spectre d’absorption de la L-tyrosine :
Structure des entités organiques
Spectroscopie IR :
-
La spectroscopie IR est une spectroscopie d’absorption.
-
Les composés organiques absorbent aussi dans le domaine de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance T ou intensité lumineuse transmise par l’échantillon
analysé en ordonnée (elle s’exprime en pourcentage)
-
Le nombre d’ondes σ en abscisse.
-
Le nombre d’ondes σ est l’inverse de la longueur d’onde λ.
-
Un spectre infrarouge nous renseigne sur la nature des liaisons présentes
dans la molécule et permet d’en identifier les groupes caractéristiques
- Exemple :
|
|