|
Chim. N° 08 |
Les Groupes caractéristiques. Cours. |
|
|
|
Programme 2011 :
Chim. N° 06 De la structure aux propriétés des alcanes et des
alcools.
Chim. N° 08 Composés organiques oxygénés.
Chim. N° 09 Synthèses organiques. Programme 2011 :
Physique et
Chimie
Programme 2020 :
Physique et chimie
|
IV - Les acides carboxyliques.
|
|
VI- Les composés halogénés ou les halogénures d’alkyle.
|
|
VII- Oxydation ménagée des alcools. 2)- Oxydation ménagée des alcools primaires. |
|
|
|
QCM Les alcanes et les alcools 01 : Questy Les Alcanes et les alcools 01 : Tableau Les Alcanes et les alcools 02 : Questy Les Alcanes et les alcools 02 : Tableau Composés oxygénés 01 : Tableau. |
|
1)- Exercice 1 page 228. |
|
2)- Exercice 3 page 228. |
|
3)- Exercice 4 page 228. |
|
4)- Exercice 6 page 228. |
Pour aller plus loin :
|
Logiciel pour la construction de molécule |
Chemsketch | Gratuit |
|
Mots clés : groupes fonctionnels ; alcools ; aldéhydes ; cétones ; acides carboxyliques ; amines ; composés halogénés ; ... |
|
|
|
- Un groupe fonctionnel (ou caractéristique) est un atome ou un groupement d’atomes qui confère des propriétés spécifiques aux molécules qui le possèdent. - Les composés ayant le même groupe fonctionnel appartiennent à une même famille et ils ont des propriétés chimiques analogues. |
|
Définition générale d'un alcool : On appelle alcool tout composé organique possédant un groupe hydroxyle – OH lié à un atome de carbone tétragonal. Formule générale d’un alcool : R – OH |
- Exemple : l'éthanol : CH3 – CH2 – OH
- On distingue :
|
Les alcools primaires |
Les alcools secondaires |
Les alcools tertiaires |
|
R – CH2OH ou
L’atome de carbone fonctionnel n’est lié qu’à des atomes d’hydrogène ou à un seul atome de carbone |
L’atome de carbone fonctionnel est lié à deux atomes de carbone |
L’atome de carbone fonctionnel est lié à trois atomes de carbone |
- Exemples :
|
Éthanol |
propan-2-ol |
2-méthylpropan-2-ol |
|
CH3 – CH2OH |
|
|
- Complément :
|
Tous les alcools ont une grande importance industrielle.
Les alcools dont la chaîne carbonée comporte moins de 10 atomes de carbone sont des liquides incolores à la température ordinaire. La température d'ébullition des alcools est nettement plus importante que celle des alcanes correspondants. Cette
particularité est liée à la présence du groupe hydroxyle. La plupart des alcools sont miscibles à l'eau en toutes proportions. Toutefois cette miscibilité décroît avec la longueur de la chaîne carbonée.
La molécule d'un alcool possède
deux parties : Une partie
hydrophobe : la chaîne
carbonée
Une partie hydrophile : le groupe
hydroxyle. La miscibilité est liée à
l'importance relative de ces deux parties. Les deux alcools les plus importants
sont : L'éthanol (alcool éthylique) que l'on retrouve dans les boissons alcoolisées. Des petites quantités d'éthanol provoquent un état euphorique. Des doses plus importantes dépriment gravement le système nerveux :
à consommer avec modération ! Le méthanol ou alcool de bois que l'on peut retrouver dans les alcools frelatés.
Il provoque la cécité et la
mort. On utilise les alcools comme solvant en
pharmacie, en cosmétologie… |
|
Méthode : - On cherche la chaîne carbonée la plus longue contenant l’atome de carbone qui porte le groupe hydroxyle : – OH. - On met en place la numérotation qui donne à cet atome de carbone l’indice le plus petit. - On nomme l’alcool grâce au nom de l’alcane correspondant à cette chaîne avec élision du e final que l’on fait suivre du suffixe ol affecté de l’indice de position qui lui correspond. |
- Exemples :
|
Nom |
formule semi-développée |
Classe |
|
Propan-1-ol |
|
Alcool primaire |
|
Propan-2-ol |
|
Alcool secondaire |
|
2-méthylpropan-2-ol |
|
Alcool tertiaire |
III-
Les aldéhydes et les cétones.![]()
- Les aldéhydes et les cétones sont des composés carbonylés.
- Ils possèdent le groupe caractéristique :
|
|
|
|
|
Groupe
carbonyle |
Aldéhydes |
Cétones |
- Le carbone fonctionnel est trigonal.
|
Nomenclature des aldéhydes : - Le nom d'un aldéhyde dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison al. - Le carbone fonctionnel est toujours en bout de chaîne et porte le numéro 1. |
|
Nomenclature des cétones : - Le nom d'une cétone dérive de celui de l'alcane de même squelette carboné, en remplaçant le e final par la terminaison one précédée de la position du groupe carbonyle dans la chaîne principale. - Le carbone fonctionnel ne peut pas être en bout de chaîne. |
- Le méthanal
: Il est gazeux à la température ordinaire
(θeb
= –
- La solution à 37 % dans l'eau, donne le formol qui permet la conservation des spécimens et sert à la fabrication de la bakélite et du formica.
- Éthanal : ou acétaldéhyde ou aldéhyde acétique.
- Il a une odeur de pomme
(θeb
=
- Il sert à la fabrication de l'acide éthanoïque ou acide acétique.
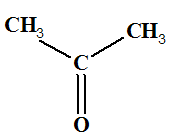
- L'acétone ou propanone sert comme solvant (dissolvant pour le rouge à ongle).
|
butanal |
2-méthylbutanal |
|
|
|
|
pentan-3-one |
propanone (acétone). |
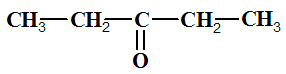 |
 |
4)- Tests des aldéhydes et des cétones.
a)- Test commun : Test à la 2,4 D.N.P.H
|
La D.N.P.H est l’abréviation de 2,4‑dinitrophénylhydrazine. Prépartion de la solution test : - La solution s’obtient en dissolvant 4g de D.N.P.H (composé solide jaune) dans 20 mL d’acide sulfurique concentré, 30 mL d’eau distillée et 100 mL d’éthanol. |
![]() Dans un tube à essais introduire :
Dans un tube à essais introduire :
- 1 à 2 mL de solution de D.N.P.H
- Et ajouter quelques gouttes d’un composé carbonylé (éthanal pour l’aldéhyde et propanone pour l’acétone), puis agiter.

- Les aldéhydes et les cétones donnent un précipité jaune-orangé avec la 2,4 D.N.P.H.
b)- Test à
|
Préparation de la solution test : - On mélange une solution de sulfate de cuivre II et une solution de tartrate double de sodium et de potassium (sels de Seignette). - La solution obtenue est appelée Liqueur de Fehling. - C’est une solution basique qui contient des ions Cu2+ complexés par les ions tartrate T2–. - Le complexe obtenu est noté [Cu T2]2–.
Complexe plan-carré : Il empèche la formation du précipité d'hydroxyde de cuivre II : Cu (OH)2 (s) Ion tartrate en 3 D :
|
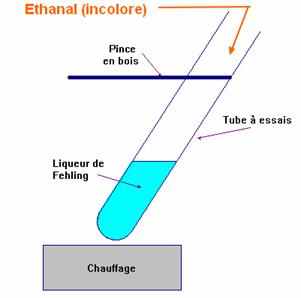
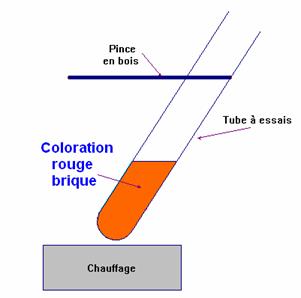
- Ce test est caractéristique des aldéhydes.
- Dans un tube à essai, on verse environ 2mL de liqueur de Fehling (solution de couleur bleue).
- On ajoute environ 1mL de la solution d'éthanal (solution incolore) (aldéhyde).
- On chauffe légèrement à la flamme du bec Bunsen en maintenant le tube avec une pince en bois.
- On observe la formation d'un précipité rouge brique dans le tube contenant l'éthanal.
- Les acides carboxyliques possèdent en commun le groupe caractéristique : – COOH
|
|
|
R – COOH |
|
Groupe
carboxyle |
Formule
générale |
Autre
formulation |
- Le carbone fonctionnel est trigonal et il est lié à deux atomes d'oxygène.
|
Nomenclature des acides carboxyliques : - Le nom de l'acide carboxylique dérive de celui de l'alcane de même squelette carboné en remplaçant le e final par la terminaison oïque, le tout étant précédé du mot acide. - Le carbone fonctionnel est toujours en bout de chaîne et porte le numéro 1. |
|
Acide
méthanoïque (acide
formique) |
Acide
éthanoïque (acide
acétique) |
|
|
|
|
Acide
propanoïque |
Acide
benzoïque |
|
|
|
- Les acides carboxyliques saturés dont la chaîne carbonée comprend moins de 9 atomes de carbone sont des liquides incolores à l'odeur piquante et désagréable.
- D'autant plus désagréable que la chaîne carbonée est longue.
- Ils sont assez solubles dans l'eau grâce au caractère hydrophile du groupe fonctionnel carboxyle.
- Les acides à longue chaîne carbonée sont peu solubles dans l'eau.
- Le caractère hydrophobe de la chaîne carbonée devient prépondérant.
- Les solutions aqueuses ont un pH < 7, d'où le nom d'acide.
- L'acide méthanoïque (acide formique : formica fourmis), l'acide éthanoïque (acide acétique : acetum : vin aigre)
- Acide butanoïque ou butyrique qui donne au beurre rance son odeur caractéristique.
- L'acide pentanoïque ou valérique (odeur des racines de la valériane du latin Valère être fort),
- Les acides hexanoïques ( caproïques), octanoïques (capryliques), décanoïques (capriques) sont responsables de l'odeur insupportable des chèvres.
- On appelle amine tout composé organique obtenu en remplaçant dans la molécule d’ammoniac NH3, un, deux ou trois atomes d’hydrogène par un, deux ou trois groupes alkyles.
- On distingue les amines primaires, les amines secondaires et les amines tertiaires.
- Formule générale : R – NH2
- Nomenclature :
|
Nomenclature des amines primaires : - On nomme l’amine à partir du nom de l’alcane R – H correspondant, avec élision du e, que l’on fait suivre de la terminaison amine en précisant la position du groupe – NH2 . |
- Exemples :
|
éthanamine |
CH3 – CH2 – NH2 |
|
Propan-1-amine |
CH3 – CH2 – CH2 – NH2 |
|
Propan-2-amine |
|
|
2-méthylpropan-2-amine
|
|
3)- Les amines secondaires et tertiaires symétriques.
- Formule générale :
|
R – NH – R |
|
|||||||||||||||
- Nomenclature :
|
Nomenclature des amines secondaires et tertiaires symétriques : - On fait suivre le nom de l’alkyle R – précédé de di ou tri, de la terminaison amine. |
- Exemples :
|
Diméthylamine
Ou
N-méthylméthanamine |
CH 3 – NH – CH 3 |
|
Triméthylamine
Ou
N,N-diméthylméthanamine |
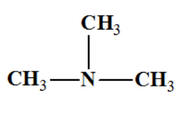 |
4)- Les animes secondaires et tertiaires non symétriques.
- Formule générale :
|
R – NH – R' |
|
|||||||||||||||
- Nomenclature :
|
Nomenclature des amines secondaires et tertiaires non symétriques : - On les nomme comme des dérivés de substitution sur l’azote de l’amine R – NH2 où R – est le groupe le plus long. - On écrit le ou les groupes substituants sur l’azote dans l’ordre alphabétique, précédés de la lettre N et suivis du nom de l’amine R – NH2. |
- Exemples :
|
N-méthyléthanamine |
CH3 – NH – CH2 – CH3 |
Amine secondaire |
|
N-éthyl-N-méthylpropan-1-amine |
|
Amine tertiaire |
|
N-éthyl-N-méthylpropan-2-amine |
|
Amine tertiaire |
VI-
Les composés halogénés ou les halogénures d’alkyle.![]()
- On appelle halogénures d’alkyle tout composé organiques possédant un atome d’halogène ( Cl, Br, I, F) lié à un atome de carbone par une simple liaison.
- Formule générale :
|
R
– X |
R – Cl |
|
R – Br |
|
|
R
– I |
|
|
R
– F |
- Nomenclature :
|
Nomenclature des halogénures d'alkyle : - Leur nom s’obtient en faisant précéder le nom de l’alcane correspondant du préfixe chloro, bromo, iodo ou fluoro, précédé de son indice de position. |
- Exemples :
|
1-chloropropane |
|
|
1,2,3-trichloropropane |
|
|
3-bromo-1,2-dichlorobutane |
|
VII-
Oxydation ménagée des alcools.![]()
- Une oxydation ménagée est une oxydation qui s’effectue sans rupture de la chaine carbonée.
- La chaine carbonée est conservée.
- Exemple :
- Lors de la combustion complète de l’éthanol, il se forme du dioxyde de carbone et de l’eau.
- Écrire l’équation bilan de la réaction :
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
- Ici, il s’agit d’une oxydation brutale.
- La chaine carbonée est détruite.
2)- Oxydation ménagée des alcools primaires.
a)- Exemple :
- Première étape :
- Dans un tube à essai N° 1 contenant du propan-1-ol, on ajoute une solution acidifiée de permanganate de potassium.
- La coloration violette due aux ions permanganate disparaît progressivement.
- On laisse reposer le mélange réactionnel.
- Il apparaît deux phases.
- Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux tubes à essai A et B.
- Dans le tube à essais
A,
on réalise le test à la 2,4-D.N.P.H et dans le tube
B,
le test à
- Les deux tests sont positifs.
- Questions :
- Comment interpréter l’évolution de la coloration dans le mélange réactionnel ?
- Quelle est la nature de l’espèce chimique formée ? Donner sa formule semi-développée.
- Écrire les demi-équations électroniques (on donne le couple MnO4- / Mn2+)
- En déduire l’équation chimique correspondante.
|
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont positifs, il s’agit d’un aldéhyde. - Comme l’oxydation est ménagée, la chaine carbonée est conservée. - On obtient du propanal
|
- Deuxième étape :
- On verse un excès de solution acidifiée de permanganate de potassium dans le tube à essai N° 1 ccontenant du propan-1-ol.
- On observe toujours la disparition de la coloration violette.
- Si l’excès est trop important, la coloration violette persiste.
- Si on prélève un peu de solution organique et que l’on réalise les tests précédents, ils sont tous les deux négatifs.
- Comment interpréter la disparition de la coloration lorsque l’on ajoute un excès de solution de permanganate de potassium ?
|
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme les deux tests sont négatifs, il ne s’agit ni d’un aldéhyde, ni d’une cétone. - Comme l’oxydation est ménagée, la chaine carbonée est conservée. - On obtient un acide carboxylique : l’acide propanoïque
|
b)- Conclusion :
- L’oxydation ménagée d’un alcool primaire donne la formation d’un aldéhyde, puis d’un acide carboxylique si l’oxydant est introduit en excès.
|
R – CH2 – OH
Alcool primaire |
Oxydant →
|
Oxydant en excès →
|
R – COOH Acide carboxylique |
||
|
|
|||||
|
Aldéhyde |
3)- Oxydation ménagée des alcools secondaires.
a)- Exemple :
- Dans un tube à essai N° 1 contenant du propan-2-ol, on ajoute une solution acidifiée de permanganate de potassium.
- La coloration violette due aux ions permanganate disparaît progressivement.
- OOn laisse reposer le mélange réactionnel.
- Il apparaît deux phases.
- Une phase organique située au-dessus et une phase aqueuse.
- On prélève un peu de la phase organique que l’on verse dans deux tubes à essai A et B.
- Dans le tube à essais
A,
on réalise le test à la 2,4-D.N.P.H et dans le tube
B,
le test à
- Le test à la 2,4-D.N.P.H est positif et celui à
- Questions :
- Comment interpréter l’évolution de la coloration dans le mélange réactionnel ?
- Quelle est la nature de l’espèce chimique formée ? Donner sa formule semi-développée.
- Écrire les demi-équations électroniques (on donne le couple MnO4- / Mn2+)
- En déduire l’équation chimique correspondante :
|
|
|
|
Propan-2-ol |
Propanone |
|
|
Oxydant |
||
|
→ |
|
||
|
Propan-2-ol |
Propanone |
|
- Réponses : - Lors de la réaction, les ions permanganate (teinte violette) sont réduits en ions manganèse II (incolore). - Comme le test à la 2,4 D.N.P.H est positif, il s'agit d'un composé carbonylé (aldéhyde ou cétone). - Mais le tyest à la Liquer de Fehling est négatif, Ce n'est pas un aldéhyde, c'est une cétone. - La propan-2-one ou propanone.
- Propanone
:
|
||||||||||||||||||||||||||||||||||||
b)- Conclusion.
- L’oxydation d’un alcool secondaire conduit à la formation d’une cétone.
|
|
Oxydant |
|||
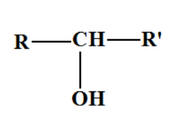 |
→ |
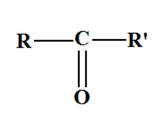 |
||
|
Alcool secondaire |
cétone |
|||
4)-
Oxydation des alcools tertiaires.
-
Un alcool tertiaire ne subit pas d’oxydation ménagée.
|
QCM : |
|
Les alcanes et les alcools 01 : Questy Les Alcanes et les alcools 01 : Tableau Les Alcanes et les alcools 02 : Questy Les Alcanes et les alcools 02 : Tableau Composés oxygénés 01 : Tableau. |
|
1)- Exercice 1 page 228. |
|
2)- Exercice 3 page 228. |
|
3)- Exercice 4 page 228. |
|
4)- Exercice 6 page 228. |