|
Préparation
à l’ECE : Étude d’un
solvant : l’éthanoate d’éthyle
L’éthanoate d’éthyle : un solvant.
-
Formule brute : C4H8O2
(ℓ) ;
-
Masse molaire : M1 =
88,11 g . mol–1
-
Formule semi-développée :
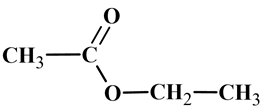
-
Formule topologique :
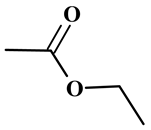
-
Représentation 3D :
Réaction entre l’éthanoate d’éthyle et les ions hydroxyde HO–
(aq) :
C4H8O2
(ℓ) + HO– (aq) → C2H3O2–
(aq) + C2H6O (aq)
C’est une réaction totale et lente à température ambiante.
1.
Suivi cinétique en utilisant la
variation au cours du temps de la conductivité du mélange réactionnel.
-
Quantité de matière des différents
réactifs :
-
Quantité de matière initiale d’éthanoate
d’éthyle :
-
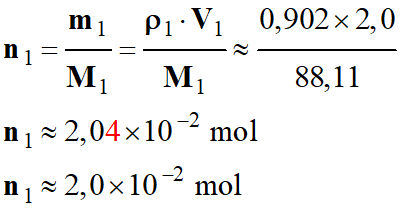
-
Quantité de matière initiale d’ions
hydroxyde :
-
n0 = C0 ×
V0
-
n0 = 2,5 × 10–2
× 20,0 × 10–3
-
n0 = 5,0 × 10–4
mol
-
Tableau d’avancement de la réaction :
-
On ne fait pas apparaître les ions sodium Na+
(aq) dans le tableau d'avancement
|
Équation
|
C4H8O2
(ℓ)
|
+ HO–
(aq)
|
→
|
C2H3O2–
(aq)
|
+ C2H6O
(aq)
|
|
État du
système
|
Avancement
|
n
(C4H8O2)
|
n
(HO–)
|
|
n
(C2H3O2–)
|
n
(C2H6O)
|
|
État
initial
(mol)
|
x =
0
|
n1
≈ 20 mmol
|
n0
≈ 0,50 mmol
|
0,0
|
0,0
|
|
Au cours
de la
transf.
|
x
|
n1
– x
|
n0
– x
|
x
|
x
|
|
État
(mol)
|
|
En excès
|
Réactif
limitant
|
|
|
-
Les différentes espèces chargées
présentes dans le mélange réactionnel :
-
L’ion sodium Na+ (aq)
et l’ion hydroxyde HO– (aq),
-
Et ion éthanoate C2H3O2–
(aq) ou CH3 – COO– (aq)
-
Volume du mélange réactionnel :
-
On néglige le volume d’éthanoate
d’éthyle pur devant le volume d’eau distillée et le volume de soude
versée :
-
V = V0 + Veau
-
V ≈ 100 mL
-
Cela revient à négliger un volume de 2,0
mL devant un volume de 100 mL.
-
Concentration des différentes espèces
chargées à l’instant t :
-
Concentration des ions sodium Na+
(aq) :
-
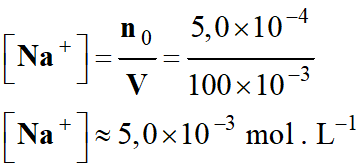
-
La concentration des ions sodium Na+
(aq) ne varie pas au cours de la réaction.
-
[Na+] = Ci
= 5,0 × 10–3 mol . L–1
-
Concentration des ions hydroxyde HO–
(aq)
-
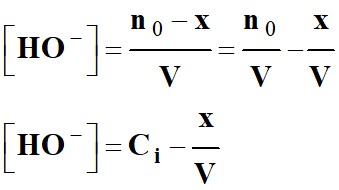
-
Au cours de la réaction, la
concentration en ions hydroxyde HO– (aq) diminue.
-
Concentration en ion éthanoate C2H3O2–
(aq) :
-
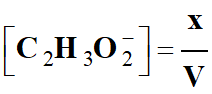
-
Au cours de la réaction la concentration
en ions éthanoate C2H3O2–
(aq) augmente.
-
Évolution de la conductivité de la
solution au cours de la réaction :
-
La conductivité σ de la solution
est égale à la somme des conductivités due aux cations
et aux anions.
-
On écrit :
-
σ
= σ (+) + σ (–)
-
Formule générale :
-

-
La conductivité σ d’une solution
ionique dépend de la nature des ions présents Xi et de
leur concentration [ Xi ] respectives.
-
Dans le cas présent :
-
σ = λ (HO–)
. [ HO–
] + λ (Na+)
. [ Na+
] + λ (C2H3O2–)
. [C2H3O2–
]
-
Au cours de la réaction, les ions
hydroxyde HO– (aq) disparaissent.
-
Ils sont remplacés par les ions
éthanoate C2H3O2–
(aq).
-
En conséquence, la concentration en ions
hydroxyde HO– (aq) diminue.
-
La concentration en ions éthanoate C2H3O2–
(aq) augmente
-
Et la concentration en ions sodium Na+
(aq) ne varie pas.
-
En résumé :
-
Lorsqu’un ion hydroxyde HO–
est consommé, un ion éthanoate C2H3O2–
est formé.
-
Les ions sodium Na+ ne
participent pas à la réaction, ils ne jouent aucun rôle sur la variation
de la conductivité du mélange réactionnel.
-
Tout se passe comme si on remplaçait un
ion hydroxyde HO– par un ion éthanoate C2H3O2–
-
Comme λ (HO–) >
λ (C2H3O2–)
la conductivité globale de la solution diminue au cours du temps.
-
λ (C2H3O2–)
= 4,09 × 10–3 S . m2 . mol–1 ;
-
λ (HO–) = 19,9
× 10–3 S . m2 . mol–1
-
On peut suivre l’évolution de
l’avancement de la réaction à partir de la mesure de la conductivité de
la solution :
-
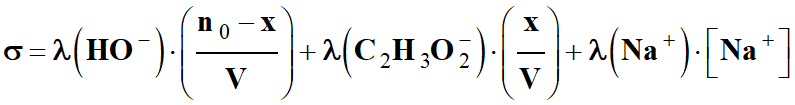
-
Le suivi cinétique de cette réaction
chimique est possible grâce à l’utilisation d’un conductimètre.
2.
Protocole expérimental détaillé
permettant d’effectuer le suivi cinétique.
-
Mélange d’un volume :
-
V0 = 20,0 mL).
d’hydroxyde de sodium de concentration C0,
-
Eau distillée :
-
Veau = 80 mL
-
Volume d’éthanoate d’éthyle pur :
-
V1 = 2,0 mL (en excès)
 Verser environ 50 mL de solution
d’hydroxyde de sodium dans un bécher de 100 mL
Verser environ 50 mL de solution
d’hydroxyde de sodium dans un bécher de 100 mL
-
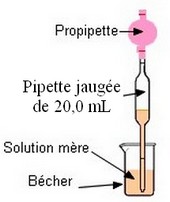
Prélever 20,0 mL de la solution
d’hydroxyde de sodium de concentration C0 à l’aide
d’une pipette jaugée de 20,0 mL munie de sa propipette.
-
Introduire ce volume dans un bécher de
200 mL.
|
On ne pipette jamais
directement dans le
flacon qui contient
la solution Mère
|
|
|

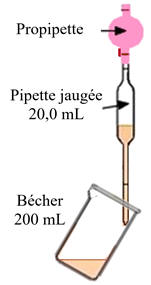
Dans l’éprouvette graduée de 100 mL :
-
Prélever environ 80 mL d’eau distillée.
-
Les ajouter dans le bécher précédent.
 Dans le bécher :
Dans le bécher :
-
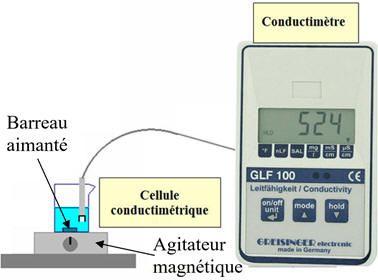
Plonger un barreau aimanté
-
Positionner le bécher sur un agitateur
magnétique.
 Cellule conductimétrique :
Cellule conductimétrique :
-
Positionner la cellule conductimétrique.
-
Elle doit être bien immergée et ne pas
être en contact avec le barreau aimanté.
-
Mettre en marche l’agitateur magnétique.
-
Effectuer le réglage pour obtenir une
agitation douce.
-
Le conductimètre, relié à l’interface
d’un ordinateur, permet le suivi de la conductivité du mélange
réactionnel au cours du temps t,
ceci grâce à une application adaptée.
-
La température de la solution reste
égale à 25 ° C.
 Les mesures :
Les mesures :
-
Prélever 2 mL d’éthanoate d’éthyle pur à
l’aide de la pipette graduée munie de sa propipette

-
Les introduire rapidement dans le bécher
et déclencher l’enregistrement.
-
L’application, utilisée par
l’ordinateur, permet de relever la valeur de la conductivité du mélange
réactionnel
à intervalles de temps
t réguliers.
-
Les mesures :
|
t
(min)
|
x
(μmol)
|
|
0,0
|
0,0
|
|
0,5
|
96,7
|
|
1,0
|
174,7
|
|
1,5
|
237,7
|
|
2,0
|
288,4
|
|
2,5
|
329,4
|
|
3,0
|
362,4
|
|
3,5
|
389,0
|
|
4,0
|
410,5
|
|
4,5
|
427,8
|
|
5,0
|
441,8
|
|
5,5
|
453,0
|
|
6,0
|
462,1
|
|
6,5
|
469,4
|
|
7,0
|
475,4
|
|
7,5
|
480,1
|
|
8,0
|
484,0
|
|
8,5
|
487,1
|
|
9,0
|
489,6
|
|
9,5
|
491,6
|
|
10,0
|
493,2
|
|
10,5
|
494,5
|
|
11,0
|
495,6
|
|
11,5
|
496,4
|
|
12,0
|
497,1
|
|
12,5
|
497,7
|
|
13,0
|
498,1
|
|
13,5
|
498,5
|
|
14,0
|
498,8
|
|
14,5
|
499,0
|
|
15,0
|
499,2
|
|
15,5
|
499,4
|
|
16,0
|
499,5
|
- Graphe :
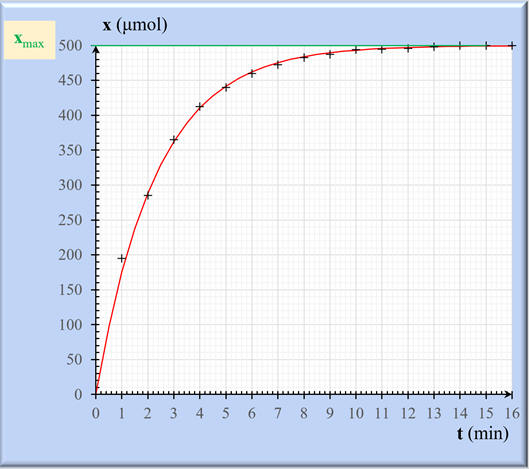
-
À l’instant initial : t = t0
-
On verse les 2,0 mL d’éthanoate de
sodium :
-
L’avancement de la réaction x = 0
et σ = σ0
-
Expression de σ0 à
l’instant initial :
-
σ0 = λ (HO–)
. [ HO–
]0 + λ (Na+)
. [ Na+
]0
-
σ0 = (λ (HO–)+
λ (Na+))
. Ci
-
À l‘instant t :
-
σ (t)= λ (HO–)
. [ HO–
]t + λ (Na+)
. [ Na+
]t + λ (C2H3O2–)
. [C2H3O2–
]t
-
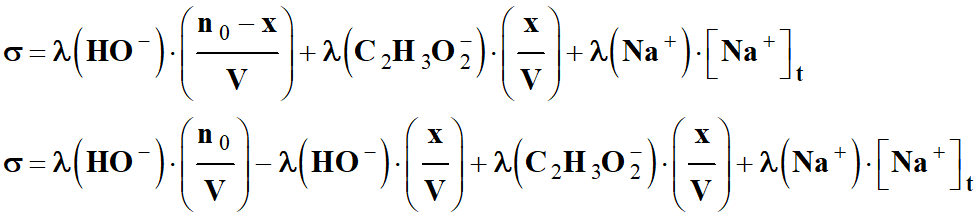
-
Or :
-
[
Na+ ]0 = [
Na+
]t = Ci
-
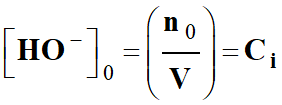
-
En ordonnant :
-
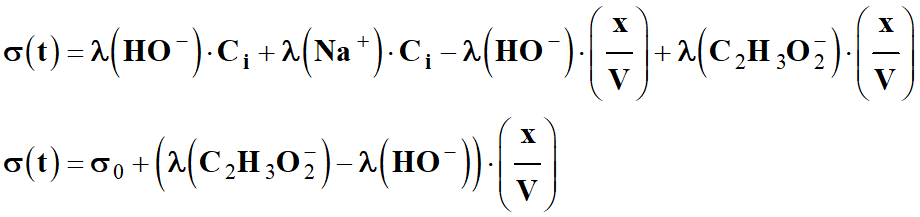
-
Comme la réaction est totale,
-
La valeur de l’avancement x
augmente au cours du temps :
-
0 ≤ x ≤ n0 ≈
0,50 mmol
-
Dans l’état initial
-
x = 0 et σ (0) = σ0
-
Dans l’état final :
-
x = xmax = n0
≈ 0,50 mmol
-
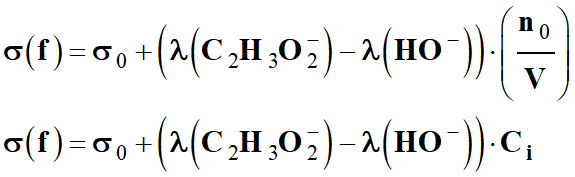
-
Or :
-
Initialement : S . m2 . mol–1
-
σ0 = (λ (HO–)+
λ (Na+))
. Ci
-
σ0 = (19,9 × 10–3
+ 5,01 × 10–3) × 10–3 × 5,0 × 10–4
-
σ0 ≈ 1,1455
× 10–8 S
-
σ0 ≈ 1,15 × 10–8
S
-
Finalement :
-
σ (f) = (λ (C2H3O2–)
+ λ (Na+))
. Ci
-
σ (f) = (4,09 × 10–3
+ 5,01 × 10–3) × 10–3 × 5,0 × 10–4
-
σ (f) ≈ 4,55 × 10–9
S
-
Ainsi la conductivité diminue bien au
cours du temps t.
►
Étude cinétique :
-
Vitesse
d’apparition
d'un produit
P :
-
La vitesse
va (P)t
d’apparition, d’un produit
P, est égale à la dérivée par rapport au temps de sa quantité de
matière nP :
-
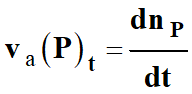
-
Dans le cas qui nous intéresse :
-
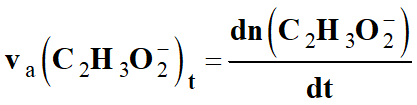
-
Or à chaque instant, n (C2H3O2–) =
x
-
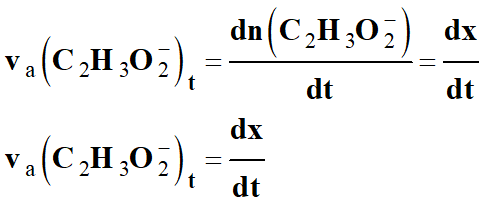
-
Comme le volume du mélange réactionnel
est constant au cours de la réaction :
-
n (C2H3O2–) =
x = [C2H3O2–]
. V
-
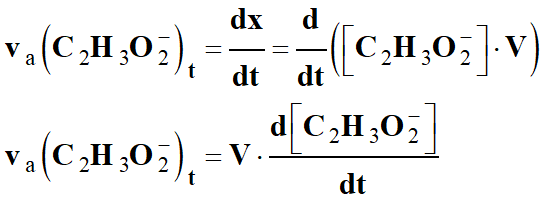
-
La vitesse volumique d’apparition de
l’ion éthanoate à la t est
définie par la relation suivante :
-
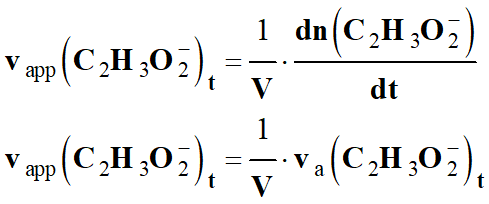
►
Vitesse volumique d’apparition d’un
produit P :
-
La vitesse volumique d’apparition, de
l’ion éthanoate vapp
(C2H3O2–)t,
est égale à la dérivée par rapport au temps de sa concentration :
-
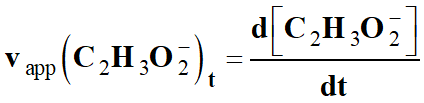
-
La vitesse d’apparition de l’ion
éthanoate va (C2H3O2–)t,
est égale à la dérivée par rapport au temps de l’avancement
x de la réaction :
-
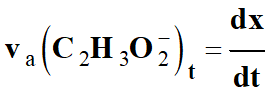
-
Comme le volume V est constant, la
vitesse volumique vapp
(C2H3O2–)
est proportionnelle à
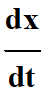 . .
-
Or graphiquement, le terme
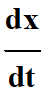 représente le coefficient
directeur de la tangente à la courge
x =
f (t). représente le coefficient
directeur de la tangente à la courge
x =
f (t).
-
Ce terme diminue au cours du temps, car
les tangentes sont de moins en moins pentues.
-
La vitesse volumique diminue au cours du
temps et s’annule lorsque la réaction est terminée (tangente
horizontale).
-
Graphe
►
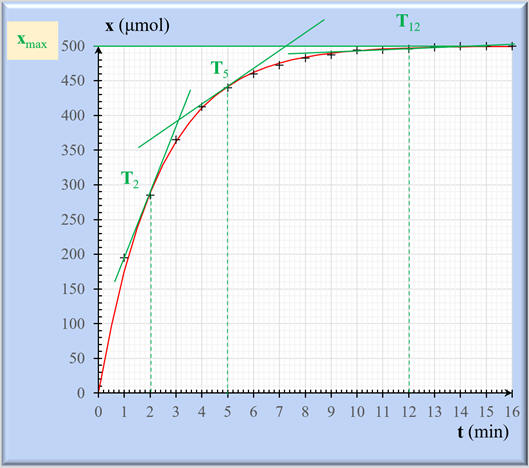
Le temps de demi-réaction :
-
Le temps de demi-réaction est la durée
au bout de laquelle l’avancement x atteint la moitié de sa valeur
finale :
-
Dans le cas présent :
xf = xmax
= 500 μmol.
-
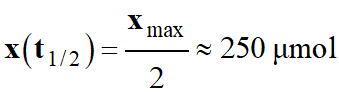
-
Exploitation graphique :
-
On trace la droite
x (t1/2) = 250
μmol.
-
Cette droite coupe le graphe
x =
f (t) en un point dont
l’abscisse est t1/2.
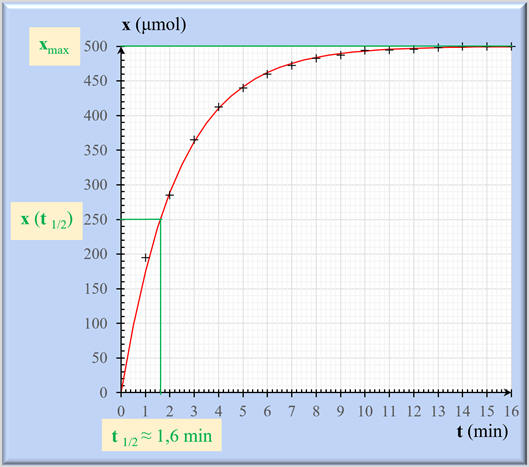
-
t1/2
≈ 1,6 min
-
Le temps de demi-réaction
t1/2 permet d’évaluer la durée nécessaire à l’achèvement
de la transformation chimique étudiée.
-
L’expérience montre qu’un système siège
d’une réaction caractérisée par le temps de réaction
t1/2 cesse pratiquement d’évoluer
au bout d’une durée de
l’ordre de quelques t1/2
(4 à 7 suivant la précision recherchée).
►
Loi des vitesse d’ordre 1 :
-
Réaction étudiée :
C4H8O2
(ℓ) + HO– (aq) → C2H3O2–
(aq) + C2H6O (aq)
-
L’espèce
chimique C4H8O2
(ℓ) a été introduite en large
excès :
-
Pour montrer que la réaction est d’ordre
1 par rapport à l’ion hydroxyde,
-
Il faut vérifier que les vitesses
volumiques de disparition des réactifs ou d’apparition des produits sont
proportionnelles
à la concentration [HO–]t
de l’espèce HO– (aq) au cours du temps.
-
C’est -à-dire :
-
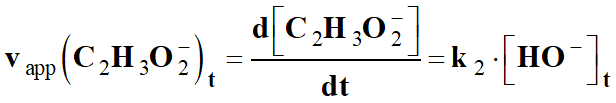
-
Étude avec le tableur Excel :
-
Il faut calculer
-
Dans la cellule
H5, on tape la formule suivante :
-
(F5
– F4) / (B5 – B4) / 0,1 / 1000
-
On obtient ainsi la valeur en mmol / L /
min
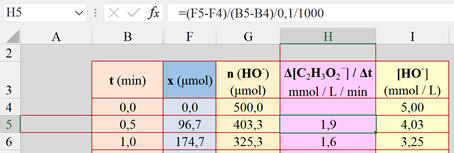
-
On recopie vers le bas autant que
nécessaire.
|
t
(min)
|
x
(μmol)
|
n
(HO-)
(μmol)
|
Δ[C2H3O2–]
/ Δt
mmol / L / min
|
[HO-]
(mmol / L)
|
|
0,0
|
0,0
|
500,0
|
|
5,00
|
|
0,5
|
96,7
|
403,3
|
1,9
|
4,03
|
|
1,0
|
174,7
|
325,3
|
1,6
|
3,25
|
|
1,5
|
237,7
|
262,3
|
1,3
|
2,62
|
|
2,0
|
288,4
|
211,6
|
1,0
|
2,12
|
|
2,5
|
329,4
|
170,6
|
0,8
|
1,71
|
|
3,0
|
362,4
|
137,6
|
0,7
|
1,38
|
|
3,5
|
389,0
|
111,0
|
0,5
|
1,11
|
|
4,0
|
410,5
|
89,5
|
0,4
|
0,90
|
|
4,5
|
427,8
|
72,2
|
0,3
|
0,72
|
|
5,0
|
441,8
|
58,2
|
0,3
|
0,58
|
|
5,5
|
453,0
|
47,0
|
0,2
|
0,47
|
|
6,0
|
462,1
|
37,9
|
0,2
|
0,38
|
|
6,5
|
469,4
|
30,6
|
0,1
|
0,31
|
|
7,0
|
475,4
|
24,6
|
0,1
|
0,25
|
|
7,5
|
480,1
|
19,9
|
0,1
|
0,20
|
|
8,0
|
484,0
|
16,0
|
0,1
|
0,16
|
|
8,5
|
487,1
|
12,9
|
0,1
|
0,13
|
|
9,0
|
489,6
|
10,4
|
0,1
|
0,10
|
|
9,5
|
491,6
|
8,4
|
0,0
|
0,08
|
|
10,0
|
493,2
|
6,8
|
0,0
|
0,07
|
|
10,5
|
494,5
|
5,5
|
0,0
|
0,05
|
|
11,0
|
495,6
|
4,4
|
0,0
|
0,04
|
|
11,5
|
496,4
|
3,6
|
0,0
|
0,04
|
|
12,0
|
497,1
|
2,9
|
0,0
|
0,03
|
|
12,5
|
497,7
|
2,3
|
0,0
|
0,02
|
|
13,0
|
498,1
|
1,9
|
0,0
|
0,02
|
|
13,5
|
498,5
|
1,5
|
0,0
|
0,02
|
|
14,0
|
498,8
|
1,2
|
0,0
|
0,01
|
|
14,5
|
499,0
|
1,0
|
0,0
|
0,01
|
|
15,0
|
499,2
|
0,8
|
0,0
|
0,01
|
|
15,5
|
499,4
|
0,6
|
0,0
|
0,01
|
|
16,0
|
499,5
|
0,5
|
0,0
|
0,01
|
-
Graphe :
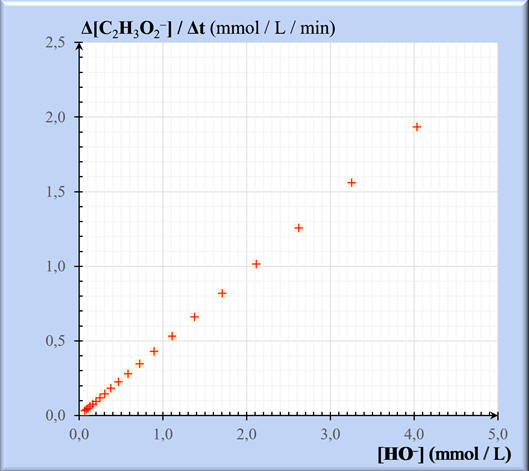
-
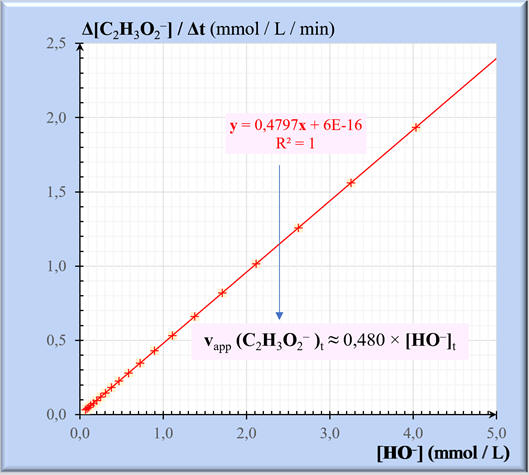
Les points sont sensiblement alignés.
-
La droite moyenne passe par l’origine.
-
La vitesse d’apparition de l’ion
éthanoate est proportionnelle à la concentration en ions hydroxyde.
-
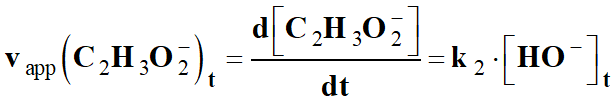
-
On peut faire un traitement statistique
grâce au tableur Excel :
-
Les différentes sélections :
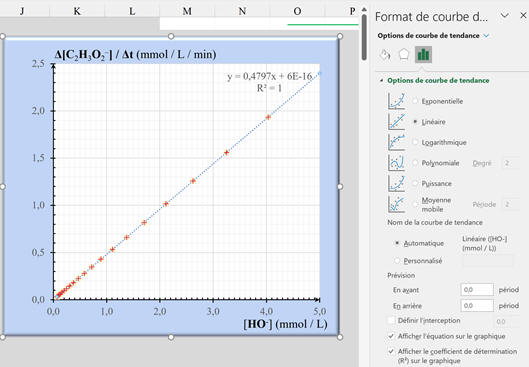
-
Mise en forme de la courbe :
-
Le tableur Excel affiche l’équation de
la droite et le coefficient de détermination
R2.
-
Équation :
y = 0,4797 x – 6 × 10–16
-
En donnant le résultat avec 3 chiffres
significatifs :
-
y
≈ 0,480 x
-
Traduction :
-
vapp
(C2H3O2–)t
(mmol . L–1 . min–1)
≈ 0,480 × [HO–]t
(mmol . L–1)
-
La constante
k2 :
-
k2
= 0,480 min–1
-
Type de réaction chimique :
|
Une réaction chimique est d’ordre 1
par rapport au réactif
A,
si
lorsque le réactif B est en large excès,
les
vitesses volumiques de disparition des réactifs
ou
d’apparition des produits sont proportionnelles à la
concentration [A]t
de l’espèce A au cours du temps :
Ainsi, on
peut écrire :
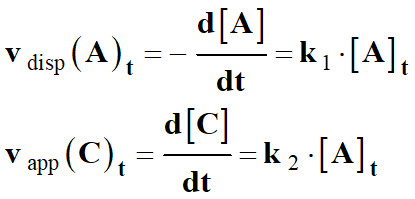
|
-
La relation est du type :
-
vapp
(C2H3O2–)t
= k2 × [HO–]t
-
En conclusion :
-
La réaction est d’ordre 1 par rapport
aux ions hydroxyde HO– (aq).
-
La vitesse d’apparition des ions
éthanoate C2H3O2–
(aq) est proportionnelle à la concentration des ions hydroxyde HO–
(aq).
|