|
|
Modélisation microscopique de l'évolution d'un système Exercices |
|
|
|
|
|
Les molécules ont été réalisées avec le logiciel : ChemSketch Exercices : énoncé avec correction
Préparation à l’ECE : Catalyse et mécanisme d’une réaction :
1)- Exercice 03 page 104 : Identifier les mélanges
réactionnels.
2)- Exercice 05 page 104: Écrire une équation de
réaction.
3)- Exercice 06 page 104 : Compléter un mécanisme
réactionnel.
4)- Exercice 07 page 104 : Identifier un catalyseur.
5)- Exercice 09 page 105 : Repérer des sites donneurs et
accepteurs.
6)- Exercice 11 page 105 : Modéliser un déplacement de
doublet.
7)- Exercice 13 page 106 : La nitration du benzène.
8)- Exercice 19 page 107 : Un biocarburant. DS 01 : Synthèse d’un explosif : exercice 20 page 108. DS 02 : Origine de la vie dans l’espace (20 min): exercice 21 page 108 |
|
QCM r
|
1)- Exercice 03 page 104 : Identifier les mélanges réactionnels :
|
Identifier les mélanges réactionnels : On modélise, par des boules colorées, les entités des réactifs dans deux mélanges réactionnels. Les chocs efficaces entre entités qui
réagissent sont modélisées par un « flash ». Lequel des mélanges a la température la plus
élevée ? Justifier.
|
|
Identifier les mélanges réactionnels :
-
Mélange dont la température est la
plus élevée :
►
Température du milieu réactionnel : - Plus la température est élevée, plus l’agitation thermique est grande, plus l’énergie cinétique des espèces chimiques sera importante
et plus la vitesse des espèces
chimiques sera grande.
-
Il découle de ceci que le nombre de
chocs et de chocs efficaces entre les espèces chimiques augmente
avec la température.
-
Les deux mélanges contiennent le même
nombre d’entités chimiques.
-
Le mélange, dont la température est
la plus élevée, est le mélange 2.
-
Le nombre de chocs et de chocs
efficaces est plus grand dans le mélange réactionnel 2. |
2)- Exercice 05 page 104: Écrire une équation de réaction :
|
Écrire une équation de réaction : Le mécanisme associé à la réaction entre l’acide iodhydrique et le peroxyde d’hydrogène est le suivant :
1.
Identifier l’intermédiaire réactionnel. 2.
Établir l’équation de la réaction de la
synthèse sachant que toutes les espèces sont en solution aqueuse. |
|
Écrire une équation de réaction : 1.
Intermédiaire réactionnel :
-
Entité produite au cours d’un acte
élémentaire puis totalement consommée dans un autre.
-
Étape (1) : formation de l’espèce
HIO.
-
Étape (2) : disparition de
HIO.
-
L’intermédiaire réactionnel est
l’acide hypoiodeux HIO.
-
Il ne faut pas confondre
intermédiaire réactionnel et catalyseur.
-
Un
intermédiaire réactionnel
est produit lors d’une
des étapes du mécanisme réactionnel, puis totalement
consommé dans une autre
étape.
-
Alors qu’un
catalyseur est
consommé puis totalement
régénéré. 2.
Équation de la réaction de la synthèse :
-
Additif : Intermédiaire réactionnel :
HIO
-
Schéma de Lewis :
|
3)- Exercice 06 page 104 : Compléter un mécanisme réactionnel :
|
Compléter un mécanisme réactionnel : Le 2-bromo-2-méthylpropane réagit lentement avec les ions
hydroxyde suivant la réaction d’équation : (CH3)3CBr (ℓ)
+ HO– (aq) → (CH3)3COH
(ℓ) + Br– (aq)
-
Recopier et compléter le mécanisme
réactionnel associé à cette réaction :
|
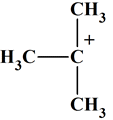
Compléter un mécanisme réactionnel : Étape (1)
(CH3)3CBr
(CH3)3C+
+ Br–
Étape
(2)
(CH3)3C+
+
HO–
→
(CH3)3COH
Équation
(CH3)3CBr
(ℓ) + HO– (aq)
→
(CH3)3COH
(ℓ) + Br–
(aq)
-
Intermédiaire réactionnel :
-
L’ion 2-méthylprop-2-ylium : (CH3)3C+
-
On peut proposer le mécanisme
suivant : Étape (1)
2-bromo-2-méthylpropane
Ion 2-méthylprop-2-ylium
Ion bromure
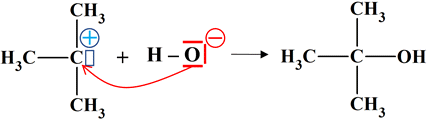
Étape
(2)
Ion 2-méthylprop-2-ylium
Ion hydroxyde
2- méthylpropan-2-ol
Équation
(CH3)3CBr
(ℓ) + HO– (aq)
→
(CH3)3COH
(ℓ) + Br–
(aq)
![]()
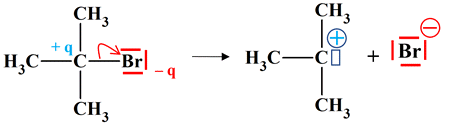
![]()
4)- Exercice 07 page 104 : Identifier un catalyseur :
|
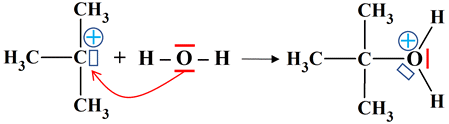
Identifier un catalyseur : Le chlorure de tertiobutyle s’hydrolyse à température ambiante
selon le mécanisme suivant :
Le peroxyde d’hydrogène peut décomposer selon le mécanisme
réactionnel suivant :
1.
Dans quel mécanisme réactionnel les ions
hydrogène H+ catalysent-ils la réaction ?
Justifier. 2.
Écrire l’équation de chacune des réactions
sans préciser l’état physique des espèces. |
Identifier un catalyseur : 1.
Ions hydrogène H+ : un
catalyseur :
-
Un catalyseur est une espèce chimique
qui accélère une réaction chimique.
-
Au cours de la transformation, il est
consommé puis régénéré.
-
En conséquence, sa formule n’apparaît
pas dans l’équation de la réaction.
-
Décomposition du peroxyde d’hydrogène
en milieu acide : Étape (1)
H2O2
+ H+
=
H3O2+
Étape
(2)
H3O2++
Br–
→
HOBr
+
H2O
Étape
(3)
HOBr
+
H2O2
→
O2
+ H+
+ Br–
+ H2O
-
Les ions hydrogène disparaissent lors
de la première étape et sont régénérés lors de la troisième étape.
-
Ils catalysent la réaction de
décomposition du peroxyde d’hydrogène. 2.
Équation de chacune des réactions.
-
Hydrolyse du chlorure de
tertiobutyle : Étape (1)
(CH3)3CCℓ
=
(CH3)3C+
+
Cℓ–
Étape
(2)
(CH3)3C+
+
H2O
→
(CH3)3COH2+
Étape
(3)
(CH3)3COH2+
→
(CH3)3COH
+ H+
Équation
(CH3)3CCℓ
+ H2O
→
(CH3)3COH
+ H+ + Cℓ–
-
Décomposition du peroxyde d’hydrogène
en milieu acide : Étape (1)
H2O2
+ H+
=
H3O2+
Étape
(2)
H3O2++
Br–
→
HOBr
+
H2O
Étape
(3)
HOBr
+
H2O2
→
O2
+ H+
+ Br–
+ H2O
Équation
H2O2
+ H2O2
→
O2
+
2
H2O
-
On peut proposer le mécanisme
suivant pour la réaction d’hydrolyse du chlorure de tertiobutyle : Étape (1)
2-chloro-2-méthylpropane
Ion 2-méthylprop-2-ylium Ion chlorure
Étape
(2)
Ion
2-méthylprop-2-ylium Eau
Ion tert-butyloxonium
Étape
(3)
Ion
tert-butyloxonium 2-méthylpropan-2-ol
Ion hydrogène
Équation
(CH3)3CCℓ
+ H2O
→
(CH3)3COH
+ H+ + Cℓ–
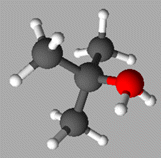
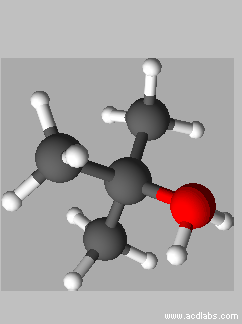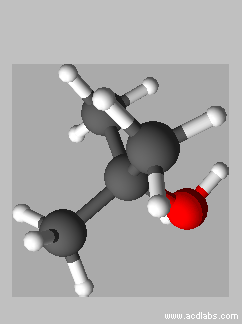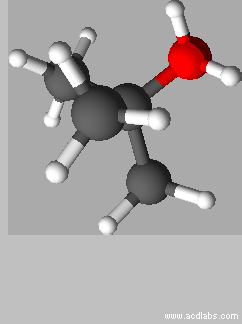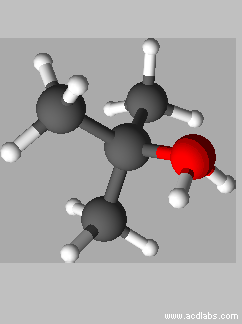
-
Vue
3 D de l’ion
tert-butyloxonium :
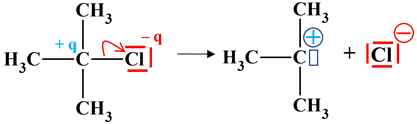
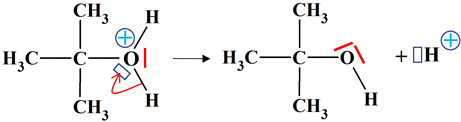
![]()
5)- Exercice 09 page 105 : Repérer des sites donneurs et accepteurs.
|
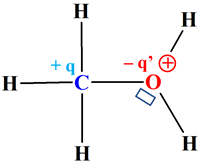
Repérer des sites donneurs et accepteurs : On donne les schémas de Lewis suivants :
1. dentifier
les liaisons polarisées de chacune des molécules. 2. Identifier le(s) site(s) donneur(s) ou
accepteur(s) de doublet d’électrons.
- Données :
- La liaison
C –
H est non polarisée.
- χ (H)
= 2,2 ; χ (C)
= 2,6 ; χ (O)
= 3,4 ; χ (I)
= 2,7 |
|
Repérer des sites donneurs et accepteurs :
1.
Liaisons polarisées de
chacune des molécules. -
Molécule de iodoéthane :
-
La liaison C – I est polarisée. - Bien que les différences d’électronégativité entre le carbone (χ (C) = 2,6 ) et l’iode (χ (I) = 2,7 ) soient faibles, -
L’atome d’iode possède 3 doublets non liants et un
doublet liant. -
Molécule de méthanol :
-
La liaison C – O est polarisée ainsi que
la liaison O – H - L’atome d’oxygène O (χ (O) = 3,4 ) est plus électronégatif que l’atome de carbone C (χ (C) = 2,6 ) et
que l’atome d’hydrogène H (χ (H) = 2,2 ). -
L’atome d’oxygène possède deux doublets non liants et
deux doublets liants. 2.
Site(s) donneur(s) ou accepteur(s) de doublet d’électrons. -
Molécule de iodoéthane :
-
Le carbone C, de la liaison C – I,
est un site accepteur de doublet d’électrons. -
L’iode I est un site donneur de doublet
d’électrons (il possède 3 doublets non liants) -
Molécule de méthanol :
-
Le carbone C, de la liaison C – O,
est un site accepteur de doublet d’électrons. -
L’hydrogène H de la liaison O – H,
est un site accepteur de doublet d’électrons. -
L’oxygène O, de la liaison C – O,
est un site donneur de doublet d’électrons (il possède 2 doublets non liants. |
6)- Exercice 11 page 105 : Modéliser un déplacement de doublet :
|
Modéliser un déplacement de doublet : Le mécanisme de la réaction entre le propan-1-ol et l’acide
chlorhydrique conduisant au 1-chloropropane, est donné ci-après :
- Recopier les équations (a) et (b) des étapes de ce mécanisme puis représenter par des flèches courbes,
le mouvement des doublets
d’électrons expliquant la formation et la rupture des liaisons. |
|
Modéliser un déplacement de doublet :
- Mouvement des doublets d’électrons :
- Intermédiaire réactionnel :
- L’ion propyloxonium :
- Il présente une lacune électronique
au niveau de l’atome d’oxygène. -
Représentation 3D de l’ion oxonium :
-
Représentation 3D de l’ion propyloxonium :
-
Les ions oxonium sont l'ion de formule chimique H3O+
et ses dérivés substitués : -
R1R2R3O+ :
(R1, R2 et R3,
radicaux alkyles)
-
Exemple : l’ion triméthyloxonium : (CH3)3O+
|
7)- Exercice 13 page 106 : La nitration du benzène :
|
La nitration du benzène : (a) La nitration est un procédé chimique qui permet d’introduire un ou plusieurs groupement nitro – NO2 dans une molécule. Elle est, entre autres, utilisée pour la synthèse de colorants alimentaires. Le mécanisme réactionnel de la
nitration du benzène C6H6 (ℓ)
par l’acide nitrique pur s’écrit :
-
L’étape (1) est la plus lente. (b) La nitration du benzène peut également être réalisée dans des conditions plus « douces » à l’aide d’un mélange d’acide nitrique et
d’acide sulfurique concentrés suivant le mécanisme réactionnel
ci-dessous :
-
L’étape (3) est la plus lente. 1.
Pour chaque mécanisme réactionnel,
identifier les intermédiaires réactionnels. 2.
À partir du mécanisme (a), établir
l’équation de la réaction de synthèse sachant que toutes les espèces sont
liquides. 3.
Catalyse : a.
Montrer que l’acide sulfurique peut être
considéré comme un catalyseur dans le mécanisme (b). b.
Comparer les étapes (2) et (3) des deux
mécanismes, puis justifier qu’une modification du mécanisme réactionnel change
la cinétique de la réaction. |
|
La nitration du
benzène : 1.
Identification
des intermédiaires réactionnels.
-
Réaction
(a) :
-
Comme
intermédiaire réactionnel, on a :
-
L’espèce
H2NO3+ : dihydroxy(oxo)ammonium
-
Schéma de
Lewis :
-
L’atome
d’azote possède 4 électrons (en propre).
-
Il lui
manque donc 1 électron. Pour mettre ceci en évidence,
-
On lui
attribue une charge formelle positive, figurée par le signe
-
L’espèce
NO2+ : l’ion nitronium
-
Schéma de
Lewis :
-
Espèce
C6H6NO2+ : Intermédiaire de Wheland
-
6-nitrocyclohexa-2,4-dien-1-ylium
-
Le cycle
aromatique a perdu son aromaticité ( 5 électrons au lieu de 6).
-
Le cycle
retrouve son aromaticité lors de l’étape (3) :
-
Réaction
(b) :
-
On
retrouve les mêmes intermédiaires.
-
L’espèce
H2SO4 n’est pas un intermédiaire réactionnel.
-
Il est
consommé lors de la première étape et régénéré lors de la troisième
étape.
►
Intermédiaire
réactionnel :
-
Entité produite au cours d’un acte élémentaire puis
totalement consommée dans un autre. 2.
Équation de la
réaction de synthèse (a).
-
Remarque :
3.
Catalyse : a.
L’acide
sulfurique : catalyseur dans le mécanisme (b).
►
Le
catalyseur :
-
Un
catalyseur est une espèce chimique qui accélère une réaction
chimique.
-
Au cours
de la transformation, il est consommé puis régénéré.
-
En
conséquence, sa formule n’apparaît pas dans l’équation de la
réaction.
-
L’espèce
H2SO4 n’est pas un intermédiaire réactionnel.
-
Il est
consommé lors de la première étape et régénéré lors de la troisième
étape.
-
C’est catalyseur lors du mécanisme (b). b.
Changement de la
cinétique de la réaction.
-
Les étapes
(2) et (3) des deux mécanismes sont les mêmes.
-
Ce qui
change, c’est la première étape qui est la plus lente pour le
mécanisme (a).
-
Alors que
l’étape la plus lente est l’étape (3) pour le mécanisme (b).
-
Le
catalyseur remplace une étape lente par une étape plus rapide.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
8)- Exercice 19 page 107 : Un biocarburant :
|
Un biocarburant : Le diméthyléther est qualifié de biocarburant. Au laboratoire, il peut être synthétisé par chauffage du méthanol en présence d’acide sulfurique. Le mécanisme de la réaction est donné
ci-dessous : 1.
Mécanisme réactionnel : a.
Recopier les équations (a) et (b) puis modéliser par des
flèches courbes le mouvement des doublets d’électrons. b.
Rédiger un court texte expliquant comment les liaisons sont
formés ou rompues. 2.
Écrire les formules des produits formés en (c). 3.
Justifier que les ions hydrogène catalysent la réaction. 4.
Écrire l’équation de la réaction sans préciser l’état
physique des espèces. 5.
Justifier le rôle d’une élévation de la température sur la
cinétique de la réaction. -
Données : -
Électronégativités : -
Liaison C – H non polarisée. ; -
χ (H) = 2,2 ; χ (C) =
2,6 ; χ (O) = 3,4. |
Un biocarburant : 1.
Mécanisme réactionnel : a.
Les équations (a) et (b) et mouvement des doublets
d’électrons. -
Étape (a) : -
Molécule de méthanol : -
L’oxygène est plus électronégatif que le carbone et
l’hydrogène. -
La liaison C – O est polarisée. -
De plus l’atome d’oxygène possède deux doublets
d’électrons non liants. -
L’atome de carbone est un site accepteur de doublet
d’électrons et l’atome d’oxygène est un site donneur de doublet d’électrons. -
L’ion hydrogène H+
: -
Il possède une lacune électronique : c’est un site
accepteur de doublet d’électrons. -
Lors de l’étape (a), l’atome d’oxygène donneur
de doublet d’électrons attaque l’ion hydrogène, accepteur de
doublet d’électrons. -
Étape (b) : -
Molécule de méthanol : -
Idem
-
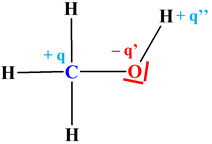
Intermédiaire réactionnel : Ion méthyloxonium -
Dans cet ion, l’atome d’oxygène possède une lacune
électronique. -
En propre, il ne possède que 5 électrons au lieu de 6
(couche électronique externe 2s2
2p4). -
La charge -
Elle indique un défaut électronique de un électron. -
Comme l’atome d’oxygène présente un déficit en
électron et qu’il est plus électronégatif que l’atome de carbone, la liaison C
– O de l’intermédiaire
réactionnel est fortement polarisée. -
C’est l’atome d’oxygène de la molécule de
méthanol qui est le site donneur de doublet
d’électrons. -
Il attaque l’atome de carbone de
l’intermédiaire réactionnel qui est le site accepteur de
doublet d’électrons. -
Simultanément, le doublet de la liaison C
– O, de l’intermédiaire
réactionnel va sur l’atome d’oxygène, de l’intermédiaire réactionnel, et comble
ainsi le déficit en électron de l’atome d’oxygène et entraîne le départ de la molécule
d’eau. 2.
Formules des produits formés en (c). -
Méthoxyméthane : éther méthylique ou diméthyléther :
CH3 – O – CH3 - L’ion hydrogène H+
: 3.
Le catalyseur la réaction. ►
Le catalyseur : -
Un catalyseur est une espèce chimique qui accélère une
réaction chimique. -
Au cours de la transformation, il est consommé puis
régénéré. -
En conséquence, sa formule n’apparaît pas dans
l’équation de la réaction. -
L’espèce
-
Il est consommé lors de l’étape (a) et régénéré lors
de l’étape (c). 4.
Équation de la réaction sans préciser l’état physique des
espèces. 5.
Rôle d’une élévation de la température sur la cinétique de la
réaction. -
La température est un facteur cinétique. -
Plus la température est élevée, plus l’agitation
thermique est grande, plus l’énergie cinétique des espèces chimiques sera importante et plus la
vitesse des espèces chimiques sera grande. -
Il découle de ceci que le nombre de chocs efficaces
entre les espèces chimiques augmente avec la température. -
Une augmentation de la température augmente la vitesse
de réaction.
![]()

 ,
représente une charge formelle.
,
représente une charge formelle. 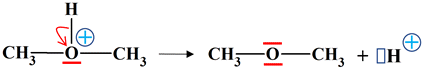
![]()
![]() n’est pas un
intermédiaire réactionnel.
n’est pas un
intermédiaire réactionnel.![]()
|
|