|
|
Modélisation microscopique de l'évolution d'un système |
|
|
|
|
|
I-
L’interprétation microscopique des réactions. |
|
II-
Les mécanismes réactionnels.
|
|
III-
La modélisation des interactions entre entités.
1)- Échelle de Pauling des électronégativités.
a)-
Électronégativité d’un
élément chimique.
2)- Sites donneur et accepteur de doublet d’électrons
a)-
Site donneur de doublet
d’électrons.
3)- Formalisme des flèches courbes.
a)-
Mécanisme d’une réaction
chimique. |
|
QCM r
|
|
Préparation à l’ECE : Catalyse et mécanisme d’une réaction :
1)- Exercice 03 page 104 : Identifier les mélanges
réactionnels.
2)- Exercice 05 page 104: Écrire une équation de
réaction.
3)- Exercice 06 page 104 : Compléter un mécanisme
réactionnel.
4)- Exercice 07 page 104 : Identifier un catalyseur.
5)- Exercice 09 page 105 : Repérer des sites donneurs et
accepteurs.
6)- Exercice 11 page 105 : Modéliser un déplacement de
doublet.
7)- Exercice 13 page 106 : La nitration du benzène.
8)- Exercice 16 page 106 : Synthèse du chloroéthane.
9)- Exercice 19 page 107 : Un biocarburant. 10)- DS 01 : Synthèse d’un explosif : exercice 20 page 108.
|
I-
L’interprétation microscopique des réactions.
1)- Chocs efficaces entre entités chimiques.
-
En 1827, le botaniste
R. BROWN (1773 – 1858) observe des grains de pollen dispersés sur l’eau.
-
Ces grains de pollen
sont soumis à un mouvement continuel et irrégulier, appelé aujourd’hui mouvement
brownien.
-
Il en résulte des
chocs des molécules sur les grains.
-
Une élévation de la
température augmente la vitesse des molécules d’eau et augmente le nombre de
chocs.
-
Le
phénomène est aléatoire.
-
Ce sont les chocs
entre les molécules de fluide et les particules immergées qui provoquent le
mouvement aléatoire.
-
Plus généralement, les
molécules d’un mélange réactionnel ne sont pas au repos.
-
Elles se déplacent
dans tous les sens de façon aléatoire, désordonné.
-
Il découle de ceci des
chocs entre les molécules présentes dans le mélange réactionnel.
-
Les entités d’un
système sont en mouvement incessant, aléatoire et désordonné.
-
Un système contient
les entités
A
et
B.
-
Obligatoirement les
deux entités
A
et
B vont entrer
en collision.
-
Dans la théorie des
collisions, ces chocs peuvent être à l’origine de réactions chimiques.
-
On considère deux
entités A
et
B entrant en collision.
-
Premier
cas : Choc élastique entre les
entités A
et
B entrant en collision :
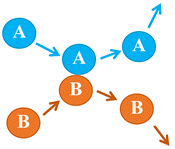
-
Les entités
A
et
B rebondissent l’une sur l’autre.
-
Elles repartent dans
d’autres directions et entrainent d’autres collisions.
-
Il n’y a pas de
réaction chimique.
-
Deuxième cas : Choc efficace entre les entités
A
et
B entrant en collision
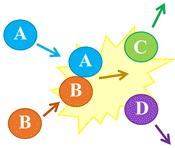
-
Le choc aboutit à la
formation des entités
C
et
D.
-
Dans ce cas, il se
produit une réaction chimique.
-
L’efficacité du choc
est liée à son énergie qui dépend de la vitesse des entités
A
et
B entrant en collision, de leurs tailles,
de leurs orientations, …
►
En conclusion :
-
Pour qu’une réaction
ait lieu :
-
Les entités
constituant les réactifs doivent entrer en collision ;
-
Les chocs doivent être
efficaces et permettrent la formation à l’échelle macroscopique des produits à
partir des réactifs.
-
L’énergie doit être
suffisante lors du choc pour rompre les liaisons existantes et en former de
nouvelles pour passer des réactifs aux produits.
2)- Retour sur les facteurs cinétiques.
►
Concentration des
réactifs :
-
L’évolution d’un
système chimique est d’autant plus rapide que les concentrations des réactifs
sont élevées.
-
Ce résultat peut
s’interpréter à l’échelle microscopique.
-
Plus la concentration
des réactifs est grande, plus la probabilité de rencontre est grande et plus il
y a de chocs efficaces entre les entités chimiques et plus la transformation est
rapide.
►
Température du milieu
réactionnel :
-
Plus la
température est élevée, plus
l’agitation thermique est grande, plus
l’énergie cinétique des espèces chimiques sera importante et plus la vitesse des
espèces chimiques sera grande.
-
Il découle de ceci que
le nombre de chocs et chocs efficaces entre les espèces chimiques augmente avec la
température.
-
Une augmentation de la
température permet à la transformation chimique de se produire plus vite.
II-
Les mécanismes réactionnels.
a)-
Exemple :
Réaction entre le monoxyde d’azote
NO
(g) et le dihydrogène
H2
(g).
-
Équation de la
réaction à l’échelle macroscopique :
2
NO
(g) + 2 H2
(g)
→
N2 (g)
+ 2
H2O
(ℓ)
-
À
l’échelle microscopique, pour que la réaction ait lieu, il faut la rencontre de
deux molécules NO (g) avec deux molécules de
H2
(g).
-
Même avec un grand
nombre de molécules et un grand nombre de chocs efficaces ceci est
statistiquement peu probable.
-
À l’échelle
microscopique, cette réaction peut être décrite par la succession de trois actes
élémentaires :
-
Mécanisme
réactionnel :
|
Étape (1) |
NO +
NO |
= |
N2 O2 |
Très rapide |
|
Étape (2) |
N2O2
+ H2 |
→ |
N2
+ H2O2 |
Lente |
|
Étape (3) |
H2 O2
+ H2 |
→ |
2
H2O |
Rapide |
|
Bilan |
2
NO + 2 H2 |
→ |
N2
+ 2 H2O |
Lente |
-
La dioxohydrazine
N2O2
et le peroxyde d’hydrogène H2O2
sont des intermédiaires réactionnels qui interviennent dans le mécanisme
réactionnel mais qui n’apparaissent pas dans le bilan de la réaction.
|
Dioxohydrazine
N2O2 |
Peroxyde d’hydrogène H2O2 |
|
|
|
-
L’équation d’une
réaction chimique :
-
Ne rend pas compte du
mécanisme réactionnel à l’échelle microscopique ;
-
Modélise la
transformation à l’échelle macroscopique.
►
Acte
élémentaire :
-
Processus qui se
déroule à l’échelle microscopique, en une seule étape : les réactifs sont
directement transformés en produits.
►
Molécularité d'un acte
élémentaire :
-
La
molécularité d'un acte
élémentaire correspond au nombre d'entités participant
en tant que réactifs à cet
acte.
-
On distingue :
-
Les réactions
unimoléculaires :
A
→
C
+ D
-
Les réactions
bimoléculaires :
A +
B
→ C +
D
;
-
Ou 2
A
→ C
+ D (un seul réactif, mais deux
molécules réagissent)
-
Les réactions
élémentaires trimoléculaires sont très rares (la rencontre simultanée de trois
molécules différentes est très peu probable dans des conditions ordinaires) et
une molécularité supérieure n'est pas envisageable.
-
Un acte élémentaire
implique 1,
2 ou 3 entités de réactifs (ion, atome,
molécule, radical), mais jamais davantage.
►
Mécanisme
réactionnel :
-
Ensemble des actes
élémentaires permettant de rendre compte, à l’échelle microscopique, de la
formation à l’échelle macroscopique, des produits à partir des réactifs.
►
Intermédiaire
réactionnel :
-
Entité produite au
cours d’un acte élémentaire puis totalement consommée dans un autre.
►
Exemple :
-
Mécanisme
réactionnel :
|
Étape (1) |
NO +
NO |
= |
N2O2 |
Très rapide |
|
Étape (2) |
N2O2
+ H2 |
→ |
N2
+ H2O2 |
Lente |
|
Étape (3) |
H2O2
+ H2 |
→ |
2
H2O |
Rapide |
|
Bilan |
2
NO + 2 H2 |
→ |
N2
+ 2 H2O |
Lente |
-
Les espèces
N2O2
et H2O2
sont des intermédiaires réactionnel.
-
Les étapes (1), (2) et
(3) sont des actes élémentaires (réactions bimoléculaires).
-
L’ensemble de étapes
(1), (2) et (3) constitue un mécanisme réactionnel.
2)- Interprétation microscopique de l’action d’un
catalyseur.
-
Un catalyseur accélère
une réaction chimique en modifiant le mécanisme réactionnel.
-
Il remplace une étape
lente du mécanisme réactionnel par plusieurs étapes rapides.
-
Il disparaît au cours
du mécanisme réactionnel et est régénéré en fin de réaction.
-
Il n’apparaît pas dans
l’équation de la réaction.
b)-
Exemple :
Réaction entre les ions tartrate
C4H4O62–
(aq) et le peroxyde d’hydrogène
H2O2
(aq).
-
La réaction entre les
ions tartrate
C4H4O62–
(aq) et le peroxyde d’hydrogène
H2O2
(aq) est lente.
-
Pour l’accélérer, on
ajoute un catalyseur :
les ions cobalt II
Co2+
(aq)
-
Le catalyseur modifie
le mécanisme réactionnel.
-
La réaction peut être
modélisée par deux étapes :
|
(1) |
5 H2O2
(aq) |
+ 10
Co2+
(aq) |
|
→ |
10
Co3+
(aq) |
+ 10
HO– (aq) |
|
|
(2) |
C4H4O62–
(aq) |
+ 10
Co3+
(aq) |
+8 HO– (aq) |
→ |
4 CO2
(g) |
+10
Co2+
(aq) |
+ 6 H2O
(ℓ) |
|
Bilan |
5 H2O2
(aq) |
+
C4H4O62–
(aq) |
→ |
4 CO2
(g) |
+ 2
HO– (aq) |
+ 6 H2O
(ℓ) |
|
-
Évolution de la
couleur de la solution :
|
|
Mélange incolore
de :
C4H4O62–
(aq)
+
H2O2
(aq)
Aucun phénomène
visible |
|
|
On ajoute 3 mL
environ
d’une solution
aqueuse
de chlorure de
cobalt II
(solution
rose)
On observe un
léger
dégagement gazeux |
|
|
La solution prend
une teinte brune.
Le dégagement
gazeux
s’intensifie
(mélange de
Co2+
et Co3+) |
|
|
La solution prend
une teinte verte
et le
dégagement gazeux
s’intensifie
encore
(
Co3+prédomine) |
|
|
La solution a
toujours
une teinte verte
mais le
dégagement gazeux
diminue
(
Co3+prédomine) |
|
|
La solution
reprend
une teinte brune.
Le dégagement
gazeux est très
faible
(mélange de
Co2+
et Co3+) |
|
|
La solution
reprend sa teinte rose.
La réaction est
finie.
Les ions cobalt
II (Co2+)
sont régénérés
|
►
Intermédiaire
réactionnel et catalyseur :
-
Il ne faut pas
confondre intermédiaire réactionnel et catalyseur.
-
Un
intermédiaire
réactionnel est
produit
lors d’une des étapes du mécanisme réactionnel, puis totalement
consommé dans une autre étape.
-
Alors
qu’un catalyseur
est consommé
puis totalement
régénéré.
►
Acide tartrique et ion
tartrate :
|
Acide
tartrique |
Ion tartrate |
|
Acide 2,3-
dihydroxybutanedioïque |
Ion 2,3-
dihydroxybutanedioate |
-
L’acide tartrique
(solide blanc) est utilisé dans les cachets contre les indigestions et les maux
de tête.
-
On l’utilise comme
additif alimentaire (E 334) principalement comme antioxydant et régulateur de
pH.
-
On le retrouve dans
les confitures, les gelées, les fruits et légumes en conserve,…
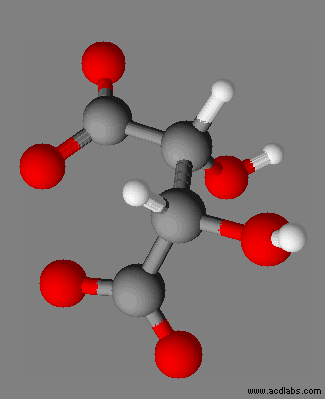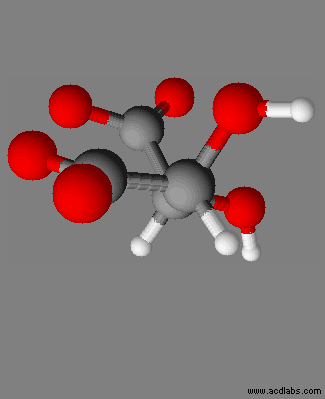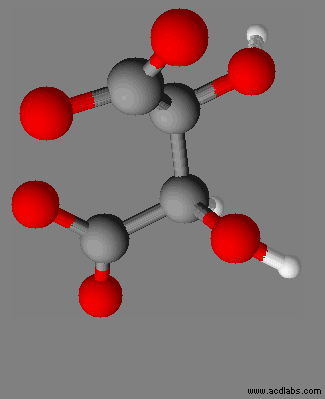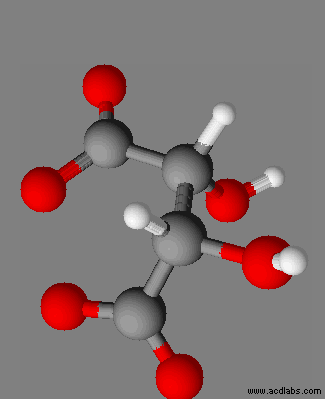
III-
La modélisation des interactions entre entités.
1)- Échelle de Pauling des électronégativités.
a)-
Électronégativité d’un
élément chimique.
-
L’électronégativité
χ
d’un élément traduit la tendance d’un atome A
de cet élément à attirer le doublet d’électrons d’une liaison covalent qu’il
forme avec un autre atome B.
-
Plus un élément est
électronégatif, plus il attire à lui le doublet d’électrons de la liaison
covalent.
-
L’électronégativité
varie selon la place de l’élément dans la classification périodique, ceci à
l’exception des gaz nobles.
-
Cette propriété est
liée à la règle du duet
et de l’octet.
-
Il existe plusieurs
échelles d’électronégativités.
-
On utilise le plus
souvent l’échelle d’électronégativité de
Pauling.
-
Sur une même ligne, l’électronégativité
augmente de gauche à droite.
-
Dans une même colonne,
elle augmente de bas en haut.
-
Remarque :
-
Les alcalins (Li,
Na,
K, …) ont tendance
à perdre des électrons, alors que les halogènes (F,
Cℓ,
Br, …) ont tendance
à gagner des électrons.
-
Ainsi, ils peuvent
acquérir la structure des gaz nobles.
b)-
Polarisation d’un liaison.
|
- L’électronégativité χ d’un atome traduit sa capacité à attirer le doublet d’électrons
d’une liaison covalente dans laquelle il est engagé.
- Une liaison
A – B est
polarisée si
χA –
χB ≥ 0,4
-
Si cette condition est vérifiée :
- Alors, il apparaît une charge partielle
négative
–
q sur
l’atome A et une charge partielle positive
+
q
sur l’atome
B. |
-
Représentation :
|
– q + q |
|
|
►
Exemple : La molécule
de chlorure d’hydrogène HCℓ.
-
Le chlorure
d’hydrogène est constitué de molécules HCℓ
dans lesquelles l’atome d’hydrogène est lié à l’atome de chlore par une liaison
covalente.
|
Représentation
de Lewis |
Caractéristiques
géométriques |
|
|
|
|
dH – Cl ≈
127 pm |
-
Le chlore est beaucoup
plus électronégatif
que l’hydrogène.
-
Il attire vers lui le
doublet de liaison : on dit que la liaison H –
Cℓ est polarisée.
-
Cette polarisation
fait apparaître :
-
Une charge partielle
positive, noté +
q
sur l’atome d’hydrogène.
-
Une charge partielle
négative, noté –
q
sur l’atome de chlore.
-
Représentation :
|
+q
|
|
H
–
Cℓ |
-
L’atome de chlore est
un site riche en électrons : c’est un site donneur de doublet d’électrons.
-
L’atome d’hydrogène
est un site appauvri en électrons : c’est un site accepteur de doublet
d’électrons.
-
Les électronégativités
des atomes de carbone C
(2,5) et d’hydrogène H
(2,2) sont assez voisines.
-
En chimie organique,
on considère que la liaison C – H
est non polarisée.
d)-
Exemple de liaison polarisée.
►
La molécule de
chlorométhane CH3Cℓ :
-
L’atome de carbone et
l’atome de chlore vérifient la règle de l’octet.
-
L’atome de chlore est
plus électronégatif que l’atome de carbone.
-
La liaison
C – Cℓ est
polarisée.
-
L’atome de carbone
porte une charge partielle positive
+ q et l’atome de chlore
porte une charge partielle négative
– q.
-
Les liaisons
C – H sont
considérées comme non polarisées.
-
L’atome de carbone est
appauvri en électrons et constitue un site accepteur de doublet d’électrons,
alors que l’atome de chlore est un site donneur de doublet d’électrons.
2)- Sites donneur et accepteur de doublet d’électrons
a)-
Site donneur de doublet
d’électrons.
►
L’ion hydroxyde :
HO–
|
Représentation de Lewis |
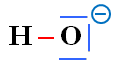 |
-
L’atome d’oxygène
-
Possède
trois doublets non liants
et un doublet liant
(il respecte la règle de l’octet).
-
Il porte une charge
électrique négative.
-
C’est un site riche en
électrons.
►
La molécule d’eau :
H2O.
|
|
|
dH – O ≈
96 pm
α ≈ 105 ° |
-
L’atome d’hydrogène
respecte la règle du DUET (un doublet liant).
-
L’atome d’oxygène
respecte la règle de l’OCTET (deux doublets liants et deux doublets non liants).
-
L’atome d’oxygène est
plus électronégatif que l’atome d’hydrogène.
-
Les deux liaisons
H – O sont
polarisées.
-
Chaque atome
d’hydrogène porte une charge partielle positive
+ q
et l’atome d’oxygène porte une charge partielle négative
– 2 q.
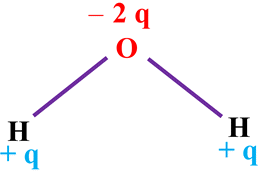
-
Conclusion :
-
L’atome d’oxygène
constitue un site riche en électrons :
c’est un site donneur de doublet
d’électrons.
►
Généralisation :
|
-
Dans un édifice, un
atome porteur de doublet(s) non liant(s) ou porteur d’une charge électrique
négative constitue un site donneur de doublet d’électrons.
-
Une liaison multiple
constitue aussi un site donneur de doublet d’électrons.
-
Un site donneur de
doublet d’électrons peut être un doublet non liant, une liaison polarisée ou une
double liaison.
|
b)-
Site accepteur de doublet
d’électrons :
►
L’ion hydrogène :
H+
-
L’ion hydrogène
provient d’un atome d’hydrogène ayant perdu un électron.
-
L’ion hydrogène
H+
ne possède pas d’électron et porte une charge électrique positive.
-
C’est un site
accepteur de doublet d’électrons.
-
Il possède une lacune
électronique : 
►
La molécule de
chlorométhane : CH3Cℓ.
-
L’atome de carbone et
l’atome de chlore vérifient la règle de l’octet.
-
L’atome de chlore est
plus électronégatif que l’atome de carbone.
-
La liaison
C – Cℓ est
polarisée.
-
L’atome de carbone
porte une charge partielle positive
+ q et l’atome de chlore
porte une charge partielle négative
– q.
-
Les liaisons
C – H sont
considérées comme non polarisées.
-
L’atome de carbone est
appauvri en électrons et constitue un site accepteur de doublet d’électrons,
alors que l’atome de chlore est un site donneur de doublet d’électrons.
►
Généralisation :
|
- Dans un édifice, un atome porteur de charge électrique positive élémentaire
(atome appauvri en
électrons) constitue un site accepteur de doublet d’électrons. - Un site accepteur de doublet d’électrons peut être un atome porteur d’une
charge électrique positive,
partielle ou non et / ou d’une lacune électronique. |
3)- Formalisme des flèches courbes.
a)-
Mécanisme d’une réaction
chimique.
|
-
À l’échelle
microscopique, le passage des réactifs aux produits peut nécessiter plusieurs
réactions ou étapes.
-
Ces étapes constituent
le mécanisme réactionnel.
-
L’étude de
l’interaction entre sites donneur et accepteur de doublet d’électrons permet
d’interpréter les étapes d’un mécanisme réactionnel.
|
b)-
Formalisme des flèches
courbes.
|
- Lors d’un acte élémentaire d’un mécanisme réactionnel, la formation et la rupture de liaisons peut s’expliquer
par les interactions entre les sites donneur et accepteur de
doublet d’électrons des entités qui réagissent. |
►
Sites donneur
D
et accepteur
A
de doublet d’électrons :
|
Site donneur :
Doublet non liant |
La
flèche courbe (rouge),
orientée du doublet non
liant de D
vers A, représente le
mouvement du doublet d’électrons mis en jeu
lors de l’interaction entre le site
donneur de doublet d’électrons et le site
accepteur de doublet d’électrons. Elle permet
d’expliquer la formation de la nouvelle
liaison D – A. |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
|
Site donneur :
Liaison polarisée |
La
flèche courbe (rouge),
orientée De la liaison
polarisée X – D
vers A, représente le
mouvement du doublet d’électrons mis en jeu
lors de l’interaction entre le site
donneur de doublet d’électrons et le site
accepteur de doublet d’électrons. Elle permet
d’expliquer la rupture de la liaison X
– D
et la formation de la
nouvelle liaison D – A. |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
|
Site donneur :
Double liaison
polarisée |
La
flèche courbe (rouge),
orientée de la double
liaison polarisée X =
D
vers A, représente le
mouvement du doublet d’électrons mis en jeu
lors de l’interaction entre le site
donneur de doublet d’électrons et le site
accepteur de doublet d’électrons. Elle permet
d’expliquer la rupture d’une liaison
de la double
liaison X = D
et la
formation
de la
nouvelle
liaison D – A.
On obtient : X
– D – A |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
- Les flèches courbes tracées dans l’équation
d’une étape d’un mécanisme réactionnel :
- modélisent le mouvement d’un doublet d’électrons.
-
Elles
sont orientées du doublet d’électrons du site
donneur
vers le site
accepteur de doublet d’électrons.
►
Exemple 1 : Réaction
entre les ions iodure I–
et le chlorométhane
CH3Cℓ.
-
Cette réaction se fait
en une seule étape.
CH3Cℓ
+ I–
→ CH3I
+ Cℓ–
-
La
rupture de la liaison C
–
Cℓ est simultanée avec la
formation de la liaison
C – I.
-
Mécanisme
réactionnel :
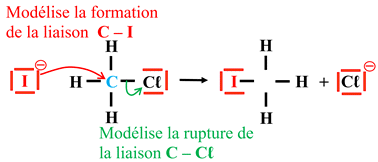 |
►
Exemple 2 :
Saponification de l’éthanoate d’éthyle :
-
Réaction chimique :
|
|
+
HO– |
→ |
|
+
CH3 – CH2
– OH |
|
Éthanoate
d’éthyle |
Ion
hydroxyde |
|
Ion éthanoate |
Éthanol |
-
Mécanisme
réactionnel :
|
(1) |
|
|
(2) |
|
|
(3) |
Acide
éthanoïque ion éthanolate ion éthanoate
éthanol |
|
Réaction acido-basique |
►
Remarques :
-
L’ion hydroxyde
HO–,
porteur de 3 doublets d’électrons non liants,
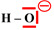 est
un site donneur de doublet d’électrons.
est
un site donneur de doublet d’électrons.
-
L’atome de carbone
C du groupe
ester
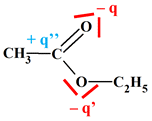 porte charge
partielle positive car il est lié à deux atomes d’oxygène plus électronégatifs
que lui.
porte charge
partielle positive car il est lié à deux atomes d’oxygène plus électronégatifs
que lui.
-
C’est un site
accepteur de doublet d’électrons.
►
Étude de la première
étape :
|
-
La
flèche courbe rouge
orientée d’un des doublets non liants de l’ion
hydroxyde
représente le mouvement du doublet correspondant à la formation
de la liaison C – O. - Comme cet atome de carbone doit respecter la règle de l’OCTET, la formation de la liaison C – O entraîne
le
basculement de l’un des doublets de la liaison
C = O vers l’atome
d’oxygène.
-
Ce mouvement est
représenté par la flèche
courbe bleue.
-
Le carbone
C du groupe ester passe d’une
structure trigonale
à une structure
tétragonale. |
-
Intermédiaire
réactionnel :
|
|
|
1-éthoxy-1-
hydroxyéthan-1-olate |
►
Étude de la deuxième
étape :
|
- La flèche courbe rouge orientée d’un des doublets non liants de l’atome d’oxygène O (qui porte la charge négative)
vers l’atome de carbone
C du groupe ester
représente le mouvement du doublet correspondant à la formation de la double
liaison C = O. - Comme cet atome de carbone C doit respecter la règle de l’OCTET, la formation de la double liaison C = O entraîne le basculement
du doublet de la liaison C – O
vers l’atome d’oxygène (lié au groupe éthyle).
-
Ce mouvement est
représenté par la flèche
courbe bleue.
-
Le carbone
C (du groupe ester) passe d’une
structure tétragonale à une structure
trigonale.
|
►
Étude de la troisième
étape :
|
-
Il s’agit d’un échange
de proton entre la molécule d’acide éthanoïque et l’ion éthanolate (base).
-
On obtient un ion
carboxylate (ion éthanoate) et un alcool (éthanol).
|
|
-
Lors d’une
transformation, l’ensemble des réactions qui se produisent au niveau
microscopique constitue le mécanisme réactionnel.
-
Chacune de ces
réactions est une étape du mécanisme réactionnel et résulte de l’interaction
entre site donneur et site accepteur de doublet d’électrons.
-
Le mouvement de ce
doublet d’électrons peut être représenté par une flèche courbe, reliant le site
donneur au site accepteur de doublet d’électrons.
-
Ces flèches courbes
permettent d’expliquer la formation ou la rupture des liaisons au cours de ces
réactions.
|
►
Réaction chimique :
-
Équation de la
réaction de synthèse de l’aspirine :
|
|
+ |
|
→ |
|
+ |
|
|
Acide salicylique |
|
Anhydride éthanoïque |
|
Aspirine
|
|
Acide éthanoïque |
►
Mécanisme
réactionnel :
-
Dans ce qui suit, on
ne fait apparaître que les sites donneur et accepteur de doublet d’électrons qui
participent à la réaction.
-
Le mécanisme de cette
réaction comporte plusieurs étapes.
-
Première étape :
|
|
|
Acide
salicylique
Anhydride éthanoïque
Amphion intermédiaire |
-
Deuxième étape :
dissociation.
-
Troisième étape :
réaction acido-basique.
|
|
|||
|
Ion éthyl
(2-carboxyphényl)
oxonium |
Ion
éthanoate |
Aspirine
Acide
acétylsalicylique |
Acide
éthanoïque |
|
QCM r
|
|
Exercices : énoncé avec correction
Préparation à l’ECE : Catalyse et mécanisme d’une réaction :
1)- Exercice 03 page 104 : Identifier les mélanges
réactionnels.
2)- Exercice 05 page 104: Écrire une équation de
réaction.
3)- Exercice 06 page 104 : Compléter un mécanisme
réactionnel.
4)- Exercice 07 page 104 : Identifier un catalyseur.
5)- Exercice 09 page 105 : Repérer des sites donneurs et
accepteurs.
6)- Exercice 11 page 105 : Modéliser un déplacement de
doublet.
7)- Exercice 13 page 106 : La nitration du benzène.
8)- Exercice 16 page 106 : Synthèse du chloroéthane.
9)- Exercice 19 page 107 : Un biocarburant. 10)- DS 01 : Synthèse d’un explosif : exercice 20 page 108.
|
|
|