|
Modélisation micrsoscopique de l'évolution d'un système |
|
|
|
|
|
|
QCM N°
05
Modélisation
microscopique de l’évolution d’un système
L’interprétation microscopique des réactions chimiques
Les mécanismes
réactionnels.
La
modélisation des interactions entre entités.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Les chocs
entre entités
réactives : |
Sont
aléatoires |
Sont tous
efficaces
|
peuvent ne
pas conduire
aux produits
de la réaction |
AC |
|
2 |
Pour que les
entités
réactives
conduisent
à un produit,
il faut que : |
Les entités
entrent en
collision |
Les chocs
soient
suffisamment
énergétiques |
Les
orientations
des entités
soient
favorables |
ABC |
|
3 |
Les chocs
efficaces
entre les
entités :
|
Augmente
avec la
température
du mélange
réactionnel |
Augmente
avec la
concentration
des réactifs |
Diminue
avec la
concentration
des réactifs |
AB |
|
4 |
L’équation
d’une
réaction
chimique
modélise : |
Microscopiquement
la
transformation |
Macroscopiquement
la
transformation |
Un acte
élémentaire |
B |
|
5 |
Un acte
élémentaire : |
Est un
processus
décrit au
niveau
microscopique |
Est une étape
d’un mécanisme
réactionnel |
Est
décomposable |
AB |
|
6 |
Un
intermédiaire
réactionnel : |
Figure dans
l’équation de
la réaction |
Est présent
dans le milieu
réactionnel
à l’état final |
Figure dans
le mécanisme
réactionnel |
C |
|
7 |
Un
catalyseur : |
Modifie le
mécanisme
réactionnel |
Remplace une
étape lente
par
une succession
d’étapes plus
rapides |
Diminue en
général le
nombre
d’actes
élémentaires |
AB |
|
8 |
La réaction
entre les
ions iodure
I– (aq) et peroxodisulfate S2O82– (aq) a
pour
équation :
2 I–
(aq) + S2O82– (aq)
→ I2
(aq) + 2 SO42– (aq)
Lorsqu’elle
est catalysée,
elle peut être
décomposée
en deux
étapes : 1
→ I2
(aq) + 2 CuI (s)
2
→ 2 Cu2+
(aq)+ 2 I– (aq)
+ 2 SO42–
(aq)
On peut
affirmer que : |
Les ions cuivre II
Cu2+ (aq)
catalysent la
réaction |
L’iodure
de cuivre II
CuI
(s)
catalyse
la réaction |
Les ions
iodure I–
(aq)
catalysent
la réaction
|
A |
|
9 |
Dans la
molécule
de méthylamine
dont le schéma
de
Lewis et
modélisé
ci-dessous :
Données :
χ
(H) = 2,2 ; χ (C)
= 2,6
χ
(N) = 3,0 ; χ (O)
= 3,4 |
L’atome
d’azote est
un site donneur
de doublet
d’électrons |
L’atome de
carbone est
un site
donneur
de doublet
d’électrons |
L’atome de
carbone est
un site
accepteur
de doublet
d’électrons |
AC |
|
10 |
Les flèches
courbes
tracées dans
l’équation d’une étape d’un
mécanisme réactionnel : |
Modélisent le
mouvement
d’un doublet
d’électrons |
Sont orientées
du doublet
d’électrons
du site
donneur vers
le site accepteur
de doublet
d’électrons. |
Sont orientées
du doublet
d’électrons
du site
accepteur vers
le site donneur
de doublet
d’électrons. |
AB |
|
11 |
L’ion cyanure
CN– réagit
en une seule
étape avec
le méthanal CH2O
pour donner
l’espèce
N
≡ C – CH2 – O–.
Cette étape peut
être
modélisée par : |
|
|
|
C |
QCM
réalisé avec le logiciel Questy
Pour s’auto-évaluer
Notion de choc efficace :
-
Les entités d’un système sont en mouvement
incessant, aléatoire et désordonné.
-
Un système contient les entités
A
et
B.
-
Obligatoirement les deux entités
A
et
B vont entrer en collision.
-
Dans la théorie des collisions, ces chocs peuvent
être à l’origine de réactions chimiques.
-
On considère deux entités
A et
B
entrant en collision.
-
Choc
élastique entre les entités
A et
B
entrant en collision :
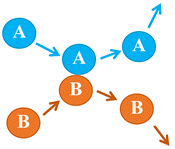
-
Les entités
A
et
B
rebondissent l’une sur l’autre.
-
Elles repartent dans d’autres directions et
entrainent d’autres collisions.
-
Il n’y a pas de réaction chimique.
-
Choc
efficace entre les entités
A et
B
entrant en collision
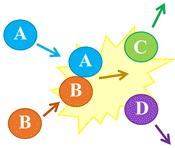
-
Le choc aboutit à la formation des entités
C
et D.
-
Dans ce cas, il se produit une réaction chimique.
-
L’efficacité du choc est liée à son énergie qui
dépend de la vitesse des entités
A et
B
entrant en collision, de leurs tailles, de leurs orientations, …
Concentration des réactifs :
-
C’est un facteur cinétique
-
L’évolution d’un système chimique est d’autant
plus rapide que les concentrations des réactifs sont élevées.
-
Ce résultat peut s’interpréter à l’échelle
microscopique.
-
Plus la concentration des réactifs est grande,
plus la probabilité de rencontre est grande et plus il y a de chocs efficaces
entre les entités chimiques et plus la transformation est rapide.
Température du milieu réactionnel :
-
C’est un facteur cinétique
-
Plus la température est élevée, plus
l’agitation thermique est grande,
plus l’énergie cinétique des espèces chimiques sera importante et plus la
vitesse des espèces chimiques sera grande.
-
Il découle de ceci que le nombre de chocs
efficaces entre les espèces chimiques augmente avec la température.
-
Une augmentation de la température permet à la
transformation chimique de se produire plus vite.
Acte élémentaire :
-
Processus qui se déroule à l’échelle
microscopique, en une seule étape : les réactifs sont directement transformés en
produits.
Molécularité d'un acte élémentaire :
-
La
molécularité d'un acte élémentaire correspond au nombre d'entités
participant en tant que réactifs à cet
acte.
Mécanisme réactionnel :
-
Ensemble des actes élémentaires permettant de
rendre compte, à l’échelle microscopique, de la formation à l’échelle
macroscopique, des produits à partir des réactifs.
Intermédiaire réactionnel :
-
Entité produite au cours d’un acte élémentaire
puis totalement consommée dans un autre.
Action d’un catalyseur :
-
Un catalyseur accélère une réaction chimique en
modifiant le mécanisme réactionnel.
-
Il remplace une étape lente du mécanisme
réactionnel par plusieurs étapes rapides.
-
Il disparaît au cours du mécanisme réactionnel et
est régénéré en fin de réaction.
-
Il n’apparaît pas dans l’équation de la réaction.
Intermédiaire réactionnel et catalyseur :
-
Il ne faut pas confondre intermédiaire
réactionnel et catalyseur.
-
Un
intermédiaire réactionnel est produit
lors d’une des étapes du mécanisme réactionnel, puis totalement
consommé dans une autre étape.
-
Alors qu’un
catalyseur est
consommé puis totalement
régénéré.
Électronégativité d’un élément chimique.
-
L’électronégativité d’un élément traduit
la tendance d’un atome A de cet élément à attirer le doublet d’électrons
d’une liaison covalent qu’il forme avec un autre atome B.
-
Plus un élément est électronégatif, plus il
attire à lui le doublet d’électrons de la liaison covalent.
-
L’électronégativité varie selon la place
de l’élément dans la classification périodique, ceci à l’exception des gaz
nobles.
-
Cette propriété est liée à la règle du duet
et de l’octet.
Site donneur de doublet d’électrons :
-
Dans un édifice, un atome porteur de doublet(s)
non liant(s) ou porteur d’une charge électrique négative constitue un site
donneur de doublet d’électrons.
-
Une liaison multiple constitue aussi un site
donneur de doublet d’électrons.
-
Un site donneur de doublet d’électrons peut être
un doublet non liant, une liaison polarisée ou une double liaison.
-
Exemple : L’ion
hydroxyde : HO–
|
Représentation
de Lewis |
|
|
-
L’atome d’oxygène
-
Possède trois
doublets non liants et un doublet liant
(il respecte la règle de l’octet).
-
Il porte une charge électrique négative.
-
C’est un site riche en électrons :
c’est un site donneur de doublet d’électrons.
Site accepteur de doublet d’électrons :
-
Dans un édifice, un atome porteur de charge
électrique positive élémentaire (atome appauvri en électrons) constitue un site
accepteur de doublet d’électrons.
-
Un site accepteur de doublet d’électrons peut
être un atome porteur d’une charge électrique positive, partielle ou non et / ou
d’une lacune électronique.
-
Exemple : L’ion hydrogène : H+
-
L’ion hydrogène provient d’un atome d’hydrogène
ayant perdu un électron.
-
L’ion hydrogène H+ ne possède
pas d’électron et porte une charge électrique positive.
-
C’est un
site accepteur de doublet d’électrons.
-
Il possède une lacune électronique : ![]()
Mécanisme d’une réaction chimique :
-
À l’échelle microscopique, le passage des
réactifs aux produits peut nécessiter plusieurs réactions ou étapes.
-
Ces étapes constituent le mécanisme réactionnel.
-
L’étude de l’interaction entre sites donneur et
accepteur de doublet d’électrons permet d’interpréter les étapes d’un mécanisme
réactionnel.
Formalisme des flèches courbes :
|
Site donneur :
Doublet non liant |
La
flèche courbe (rouge),
orientée
du doublet non
liant de D
vers A,
représente le
mouvement du doublet d’électrons
mis en jeu lors
de l’interaction entre
le site donneur
de doublet d’électrons et
le site accepteur
de doublet d’électrons.
Elle permet
d’expliquer la formation
de la nouvelle
liaison D – A. |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
|
Site donneur :
Liaison polarisée |
La
flèche courbe (rouge),
orientée
De la liaison
polarisée X – D
vers A,
représente le
mouvement du doublet d’électrons
mis en jeu lors
de l’interaction entre
le site donneur
de doublet d’électrons et
le site accepteur
de doublet d’électrons.
Elle permet
d’expliquer la rupture de la liaison
X
– D
et la formation de la
nouvelle liaison D – A. |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
|
Site donneur :
Double liaison
polarisée
|
La
flèche courbe (rouge),
orientée
de la double
liaison polarisée X =
D
vers A,
représente le
mouvement du doublet d’électrons
mis en jeu lors
de l’interaction entre
le site donneur
de doublet d’électrons et
le site accepteur
de doublet d’électrons.
Elle permet
d’expliquer la rupture d’une liaison
de la double
liaison X = D
et la
formation
de la
nouvelle liaison
D – A.
On obtient : X
– D – A |
|
|
|
|
Site accepteur :
site appauvri
en électrons |
-
Les flèches courbes tracées dans l’équation d’une
étape d’un mécanisme réactionnel :
-
Modélisent le mouvement d’un doublet d’électrons
-
Elles sont orientées du doublet d’électrons du
site donneur vers le site
accepteur de doublet d’électrons.
Mécanisme réactionnel et sites donneur et accepteur de
doublet d’électrons :
-
Lors d’une transformation, l’ensemble des
réactions qui se produisent au niveau microscopique constitue le mécanisme
réactionnel.
-
Chacune de ces réactions est une étape du
mécanisme réactionnel et résulte de l’interaction entre site donneur et site
accepteur de doublet d’électrons.
-
Le mouvement de ce doublet d’électrons peut être
représenté par une flèche courbe, reliant le site donneur au site accepteur de
doublet d’électrons.
-
CCes flèches courbes permettent d’expliquer la
formation ou la rupture des liaisons au cours de ces réactions.
|
|