|
Force des acides et des bases |
|
|
|
|
|
|
QCM N°
07
Force des
acides et des bases
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Soient les
demi-équations HCO3– (aq) + H+
= H2CO3
(aq)
Et HCO3– (aq)
= H+
+ CO32– (aq) Les couples mis
en jeu sont :
|
HCO3–
(aq)
/
H2CO3
(aq)
Et
HCO3–
(aq)
/
CO32–
(aq) |
H2CO3
(aq)
/
HCO3–
(aq)
Et
HCO3–
(aq)
/
CO32–
(aq) |
HCO3–
(aq)
/
H2CO3
(aq)
Et
CO32–
(aq)
/
HCO3–
(aq) |
B |
|
2 |
Soient les
demi-équations HCO3– (aq) + H+
= H2CO3
(aq)
Et HCO3– (aq)
= H+
+ CO32– (aq)
HCO3–
(aq) est : |
L’acide
conjugué
de
H2CO3
(aq) |
Un acide
au sens
de Brönsted |
Une espèce
amphotère |
BC |
|
3 |
On considère
la réaction
suivante : H2CO3 (aq)
+ HO–
(aq)
→ HCO3– (aq)
+ H2O
(ℓ)
Cette réaction
met en
jeu un
transfert d’ion
hydrogène de :
|
HO–
(aq)
Vers
H2CO3
(aq) |
H2CO3
(aq)
Vers
HCO3–
(aq) |
H2CO3
(aq)
Vers
HO–
(aq) |
C |
|
4 |
Une solution d’acide
sulfurique
(2H3O+(aq)
+ SO42–(aq))
de
concentration
C
= 1,0 × 10–2 mol . L–1 : |
Contient des
ions oxonium
à la
concentration
[H3O+]éq
=
2,0 × 10–2
mol . L–1 |
a un pH
égal
à 2,0 |
a un pH
inférieur
à 2,0 |
AC |
|
5 |
Soient une
solution
d’acide
chlorhydrique
(H3O+
(aq) + Cℓ– (aq) )
et une
solution
d’acide
sulfurique
(2H3O+(aq) +
SO42–(aq))
de pH =
2,00 |
Les deux
solutions ont
la même
concentration
en ions
oxonium |
Les deux
solutions ont
la même
concentration
apportée |
La solution
d’acide
sulfurique
contient plus
d'ions oxonium
que la
solution
d’acide
chlorhydrique |
A |
|
6 |
On dilue dix fois une solution d’acide
chlorhydrique
(H3O+
(aq) + Cℓ– (aq) )
de pH =
2,00 |
Le pH de
la solution
diminue
d’une unité |
Le pH de
la solution
est divisé
par 10 |
Le pH de
la solution
augmente
d’une unité |
C |
|
7 |
La mesure du
pH
d’une solution |
N’est pas
sensible à
la température |
Ne nécessite
pas
l’étalonnage
préalable
du pH-mètre |
Doit être
faite avec
une sonde
propre
et sèche. |
C |
|
8 |
On s’intéresse à la
réaction
N2
+ 3 H2 → 2 NH3 La transformation
est totale. |
Son
avancement
maximal est
égal à son
avancement
final |
N2,
H2 et NH3
sont présents
à l’état final |
Le mélange
final ne
contient
que NH3
|
A |
|
9 |
On faite réagir
n1
= 2,0 mol
de méthanoate
d’éthyle C3H6O2 avec
n2
= 2,0 mol
d’eau. On
obtient
n3
= 0,66 mol d’acide
méthanoïque
CH2O2 et
n4
= 0,66 mol
d’éthanol C2H6O.
Cette
transformation : |
Est totale |
a un taux
d’avancement
final égal
à 33 % |
a un taux
d’avancement
final égal
à 66 % |
B |
|
10 |
On fait réagir
n1
= 2,0 mol
de méthanoate
d’éthyle C3H6O2 avec
n2
= 2,0 mol
d’eau. On
obtient
n3
= 0,66 mol d’acide
méthanoïque
CH2O2 et
n4
= 0,66 mol
d’éthanol C2H6O.
Dans l’état
final de cette
transformation : |
Le système
ne contient
que C3H6O2
et H2O. |
Le système
est composé
de C3H6O2,
C2H6O,
CH2O2
et H2O. |
Le système
ne contient
que C3H6O
et CH2O2. |
B |
|
11 |
On considère
la réaction HCOOH (aq)
+ NH3
(aq)
HCOO– (aq)
+ NH4+
(aq) Sa constante d’équilibre
s’écrit :
|
|
|
|
C |
|
12 |
On considère
un
système
chimique
siège d’une
réaction
non totale. Le
quotient de
réaction
est supérieur
à la
constante
d’équilibre. |
Le système
évolue
spontanément
dans le
sens direct |
Le système
évolue
spontanément
dans le
sens indirect |
L’équilibre
est atteint |
B |
|
13 |
À l’équivalence
d’un titrage : |
On a apporté
juste assez
de réactif
titrant pour
consommer
tout le
réactif titré
initialement
présent |
On a apporté
autant de
réactif
titrant
qu’il y avait
initialement
de réactif
titré |
Le réactif
titrant et le
réactif titré
sont présents
dans les
proportions
stœchiométriques |
A |
|
14 |
On verse dans
un
erlenmeyer un
volume VA
d’une
solution
contenant
une espèce
A de
concentration
CA.
On y ajoute
progressivement une
solution
contenant
l’espèce
chimique B
de
concentration CB
connue.
L’équation
de la réaction
support
du titrage
est :
3 A +
B → C + 2 D
De toutes les
espèces
présentes,
seule B est
colorée. Le
volume
équivalent est
VE. La quantité de matière
de B
apporté
à
l’équivalence est : |
CB
. VE |
CA
. VA |
3 CA
. VA |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Chap N° 01 Transformations acido-basiques.
Couples acide / base :
-
Un
acide
est une espèce chimique capable de céder
au moins un ion
hydrogène H+.
-
L’acide
AH
se transforme alors en sa base conjuguée
A–.
-
Écriture formelle :
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
Acide et base selon Bronsted :
-
Un
acide
est une espèce chimique capable de céder
au moins un ion
hydrogène H+.
-
Une
base
est une espèce chimique capable de capter
au moins un hydrogène
H+.
-
La
base
A–
se transforme alors en son acide conjugué
AH.
Écriture formelle :
|
A–
(aq) |
+ |
H+ |
→ |
AH (aq) |
|
Base |
|
ion
hydrogène |
|
Acide |
-
Couple acide / base :
-
Écriture de la demi-équation du couple
acide-base :
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Signification :
-
Le signe
![]() signifie que le
transfert d’ion hydrogène H+
peut se produire dans les deux sens.
signifie que le
transfert d’ion hydrogène H+
peut se produire dans les deux sens.
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou bien |
||||
|
A–
(aq) + H+
|
→ |
AH
(aq) |
|
|
-
Dans le cas présent :
|
H2CO3
(aq) |
→ |
HCO3–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Couple :
H2CO3
(aq) /
HCO3–
(aq) :
|
HCO3–
(aq) |
→ |
CO32–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Couple :
HCO3–)
/ CO32–
(aq)
Espèce amphotère : (point de vue acido-basique)
-
Une espèce amphotère est à la fois l’acide
d’un couple et la base
d’un autre couple.
-
Exemple :
|
Acide |
Base |
|
H2O
(ℓ) |
/
HO–
(aq) |
|
H3O+
(aq) |
/
H2O
(ℓ) |
|
Acide |
Base |
|
H2CO3
(aq) |
/
HCO3–
(aq) |
|
HCO3–
(aq) |
/
CO32–
(aq)) |
Réaction acido-basique :
-
Une réaction acido-basique consiste à
un transfert d'un proton entre l’acide
A1H d’un
couple sur la base A2–
d’un autre couple.
-
Couple acide / base 1 :
A1H
![]() H
+
+ A1–
H
+
+ A1–
-
Couple acide / base 2 :
A2H
![]() H
+
+ A2–
H
+
+ A2–
-
Équation de la réaction :
-
On se place dans le cas où l’acide
A1H
réagit sur la base A2–
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
ou
A1H
+
A2–
→
A1–
+
A2H
-
L’équation s’écrit avec
-
une double flèche
![]() si la réaction est non totale ;
si la réaction est non totale ;
-
une simple flèche → si la réaction est
totale.
-
cette
réaction met en jeu les couples acide / base suivants :
A1H
/ A1–
et A2H /
A2–.
-
Dans le cas présent :
|
HCO3–
(aq) |
|
CO32–
(aq) |
+
H+ |
|
HO–
(aq) +
H+
|
|
H2O
(ℓ) |
|
|
HCO3–
(aq) + HO–
(aq) |
→ |
CO32–
(aq) + |
H2O
(ℓ) |
Solution aqueuse d’acide sulfurique : valeur
du pH et concentration
-
Pour préparer une solution d’acide
sulfurique, on dissout une solution pure de H2SO4
(ℓ) (vitriol) dans l’eau.
-
On verse toujours l’acide dans l’eau
(la réaction est exothermique).
|
|
eau |
|
|
|
|
H2SO4
(ℓ) + 2 H2O (ℓ) |
→ |
2 H3O+
(aq) |
+ |
SO42–
(aq) |
|
n
solvant |
|
0 |
|
0 |
|
0 |
|
2n / V |
|
n / V |
|
|
|
2 C |
|
C |
-
On prélève une quantité de matière
n de
H2SO4
(ℓ)
-
On prépare ainsi une solution de volume
V par
dilution :
-
La concentration de la solution est
C =
n /
V
-
La solution contient des ions
H3O+
(aq) et des ions SO42–
(aq) :
-
Avec [H3O+]
= 2n / V = 2 C et [SO42]
= n / V = C
-
Si C
= 1,0 × 10–2
mol . L–1, alors
[H3O+]
= 2,0 × 10–2 mol . L–1
-
Le pH d’une
solution est un indicateur d’acidité lié à la présence des ions oxonium
H3O+
(aq) en solution.
-
Définition du
pH :
|
Pour une solution diluée, [H3O+]
< 0,050 mol . L–1, Le pH est défini par la
relation suivante :
Cette relation est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] :
concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
Valeur du
pH :
-
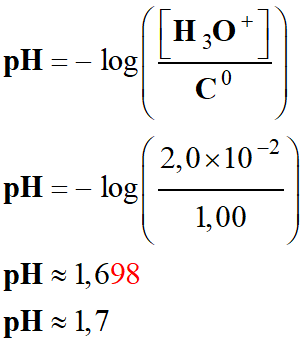
-
Cas d’un acide fort dans l’eau :
-
La transformation modélisée par la
réaction entre l’acide AH
(aq) et l’eau H2O
(ℓ) est totale :
-
En conséquence :
-
Le taux d’avancement de la réaction :
τ = 1
-
L’écriture de la réaction est la
suivante :
|
AH
(aq) + H2O
(ℓ) |
→ |
H3O+
(aq) + A– (aq) |
-
La concentration en ions oxonium :
-
[H3O+]f
= [H3O+]max
= C
-
C
représente la concentration
en acide apporté.
-
pH de
la solution obtenue :
-
pH =
– log [H3O+]f
-
Le pH
d’une solution diluée d’acide fort, de concentration
C en soluté
apporté, est :
|
pH
= – log C |
Valable pour 10–2
mol . L–1 ≤ C ≤ 10–6 mol . L–1 |
-
L’acide sulfurique est un acide fort
dans l’eau :
|
H2SO4
(ℓ) + 2 H2O (ℓ) |
→ |
2 H3O+
(aq) |
+ |
SO42–
(aq) |
Solution d’acide chlorhydrique et solution d’acide
sulfurique :
pH et concentration
-
Le pH
d’une solution diluée d’acide fort, de concentration
C en soluté
apporté, est :
|
pH
= – log C |
Valable pour 10–2
mol . L–1 ≤ C ≤ 10–6 mol . L–1 |
-
L’acide chlorhydrique est un acide fort
dans l’eau :
|
HCℓ
(g) + H2O (ℓ) |
→ |
H3O+
(aq) |
+ |
Cℓ–
(aq) (aq) |
-
Définition du
pH d’une solution aqueuse :
|
Pour une solution diluée, [H3O+]
< 0,050 mol . L–1, Le pH est défini par la
relation suivante :
Cette relation est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] :
concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
La concentration des ions oxonium peut
se déduire de la définition du pH
d’une solution aqueuse diluée :
-
[H3O+
] =
C0
. 10–pH
-
[H3O+
]
= 1,0 × 10–
2,00
-
[H3O+
]
≈ 1,00 × 10–2
mol . L–1
|
|
eau |
|
|
|
|
HCℓ
(g) + H2O (ℓ) |
→ |
H3O+
(aq) |
+ |
Cℓ–
(aq) |
|
n
solvant |
|
0 |
|
0 |
|
0 |
|
n1
/ V |
|
n1
/ V |
|
Concentration C1 |
|
C1 |
|
C1 |
|
H2SO4
(ℓ) + 2 H2O (ℓ) |
→ |
2 H3O+
(aq) |
+ |
SO42–
(aq) |
|
n
solvant |
|
0 |
|
0 |
|
0 |
|
2n / V |
|
n / V |
|
|
|
2 C |
|
C |
-
C1
= 2 C
-
Les deux solutions n’ont pas la même
concentration apportée :
Dilution d’une solution d’acide chlorhydrique :
-
Acide fort dans l’eau :
-
La transformation modélisée par la
réaction entre l’acide AH
(aq) et l’eau H2O
(ℓ) est totale :
-
En conséquence :
-
Le taux d’avancement de la réaction :
τ = 1
-
L’écriture de la réaction est la
suivante :
|
AH
(aq) + H2O
(ℓ) |
→ |
H3O+
(aq) + A– (aq) |
-
La concentration en ions oxonium :
-
[H3O+]f
= [H3O+]max
= C
-
C
représente la concentration
en acide apporté.
-
pH de
la solution obtenue :
-
pH =
– log [H3O+]f
-
Le pH
d’une solution diluée d’acide fort, de concentration
C en soluté
apporté, est :
|
pH
= – log C |
Valable pour 10–2
mol . L–1 ≤ C ≤ 10–6 mol . L–1 |
-
Le pH
augmente d’une unité lorsque la concentration
[H3O+]
est divisée par dix.
-
Ceci, bien sûr, tant que
10–2 mol . L–1
≤ C
≤ 10–6 mol . L–1
Mesure du pH d’une solution :
-
Le pH-mètre :
-
Il est nécessaire d’étalonner le
pH-mètre avant
toute mesure.
-
L’étalonnage du
pH-mètre nécessite
l’utilisation de deux solutions étalons (solutions tampons) de
pH connu.
-
Il faut régler le bouton température
sur celle de la solution dont on mesure le pH
-
La mesure du
pH dépend de la
température
-
Mesure du
pH :
-
Pour effectuer la mesure du
pH d’une solution
aqueuse, la sonde doit être rincée à l’eau distillée, essuyée puis plongée dans
la solution étudiée.
-
Après agitation et stabilisation de la
mesure, la valeur du pH
est relevée.
-
Le
pH-mètre :

-
Montage pour un dosage
pH-métrique :

La mesure du pH et sa précision :
-
Dans les conditions habituelles, au
lycée, on peut mesurer un pH,
au mieux, à 0,05 unité près (le plus souvent à 0,1 unité près).
-
Conséquences :
-
Une mesure de
pH effectuée à 0,05
unité près conduit à une valeur de la concentration [H3O+]
connue à 11,5 % près.
-
Une simple mesure de
pH ne peut donner
une concentration avec précision.
-
Il faut limiter le nombre de chiffres
significatifs pour représenter une concentration déduite de la valeur du
pH.
-
Toute concentration déduite de la
valeur du pH
sera exprimée avec 2 chiffres significatifs au maximum.
Réaction totale, réaction non totale :
-
Lorsqu’une réaction est totale,
l’avancement final est égal à l’avancement maximal :
-
xf
= xmax
-
En présence d’un équilibre chimique
(cas d’une réaction non totale) :
-
xf
< xmax
|
Équation |
N2
(g) + |
3 H2
(g) |
→ |
2 NH3
(g) |
|
|
état |
Avanc. x
(mol) |
n
(N2) (mol) |
n
(H2) (mol) |
|
n
(NH3) (mol) |
|
État initial |
x |
n1 |
n2 |
|
0 |
|
Au cours de la
transformation |
x
|
2
– x |
n2–
3 x |
2 x |
|
|
État final |
xf |
n1
– xf |
n2
– 3 xf |
|
2 xf
|
|
État max |
xmax |
n1
– xmax |
n2
– 3 xmax |
|
2 xmax
|
-
si la réaction est totale, alors :
xf
= xmax
-
la présence ou non des réactifs en fin
de réaction est liée aux quantités initiales des différents réactifs.
►
Remarque :
-
La réaction entre le diazote et le
dihydrogène n’est pas une réaction totale.
-
Elle donne lieu à un équilibre
chimique :
-
Tableau d’avancement de la réaction :
|
Équation |
N2
(g) + |
3 H2
(g) |
|
2 NH3
(g) |
|
|
état |
Avanc. x
(mol) |
n
(N2) (mol) |
n
(H2) (mol) |
|
n
(NH3) (mol) |
|
État initial |
x |
2 |
3 |
|
0 |
|
Au cours de la
transformation |
x
|
n1
– x |
n2–
3 x |
2 x |
|
|
État final |
xf |
n1
– xf |
n2
– 3 xf |
|
2
xf |
|
État max |
xmax |
n1
– xmax |
n2
– 3 xmax |
|
2
xmax |
Écriture de l’équation bilan :
|
Équation |
N2
(g) + |
3 H2
(g) |
|
2 NH3
(g) |
-
Mais dans l’énoncé de la question, on
considère que cette réaction est totale.
-
Dans le cas présent, il faut utiliser
le fait que la réaction est totale.
-
xf
= xmax
Réaction d’hydrolyse d’un ester : taux d’avancement
-
Estérification et hydrolyse :
-
Équation de la réaction : On est en
présence d’un équilibre chimique.
|
|
Estérification → |
|
||
|
HCO2H
(ℓ) |
+ C2H5OH
(ℓ) |
|
HCO2
C2H5
(ℓ) |
+ H2O
(ℓ) |
|
Acide carboxylique |
Alcool |
|
Ester |
eau |
|
|
← Hydrolyse |
|
||
|
Équation |
C3H6O2
(ℓ) + |
H2O
(ℓ) |
|
CH2O2
(ℓ) |
+ C2H6O
(ℓ) |
|
|
état |
Avanc. x
(mol) |
n
(C3H6O2) (mol) |
n
(H2O) (mol) |
|
n
(CH2O2) (mol) |
n
(C2H6O) (mol) |
|
État initial |
x |
n1 = 2,0 |
n2 = 2,0 |
|
0 |
0 |
|
Au cours de la
transformation |
x
|
2,0
– x |
2,0–
x |
x |
|
|
|
État final |
xf |
n1
– xf |
n2
– xf |
|
xf =
0,66 |
xf =
0,66 |
|
État max |
xmax |
n1
– xmax |
n2
– xmax |
|
xmax
|
xmax |
-
On en déduit la valeur de l’avancement
final : xf
= 0,66 mol
-
Dans le cas présent : n1
= n2 = 2,0 mol
-
D’autre part, on peut calculer
l’avancement maximal :
-
xmax
= n1 = n2
= 2,0 mol
-
Taux d’avancement d’une réaction :
-
Le taux d’avancement final d’une
réaction, noté τ
(tau), est le quotient de l’avancement final par l’avancement maximal :
|
|
|
|
τ
(tau) |
Taux d’avancement
final (sans unité) |
|
xf |
Avancement final (mol) |
|
xmax |
Avancement maximal
(mol) |
-
Si τ
= 0, la réaction n’a pas lieu.
-
Pour une réaction totale :
τ = 1 car
xf
= xmax
-
Pour une réaction non totale : 0
< τ < 1 car
xf
< xmax
-
On peut exprimer cette grandeur en
pourcentage.
-
Dans le cas présent :
-
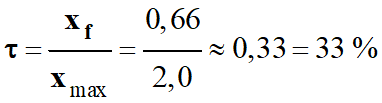
Réaction d’hydrolyse d’un ester : état final
|
Équation |
C3H6O2
(ℓ) + |
H2O
(ℓ) |
→ |
CH2O2
(ℓ) |
+ C2H6O
(ℓ) |
|
|
état |
Avanc. x
(mol) |
n
(C3H6O2) (mol) |
n
(H2O) (mol) |
|
n
(CH2O2) (mol) |
n
(C2H6O) (mol) |
|
État initial |
x |
n1 = 2,0 |
n2 = 2,0 |
|
0 |
0 |
|
Au cours de la
transformation |
x
|
2,0
– x |
2,0–
x |
x |
|
|
|
État final |
xf |
1,32 |
1.32 |
|
0,66 |
0,66 |
|
État max |
xmax |
n1
– xmax |
n2
– xmax |
|
xmax
|
xmax |
Transformation non totale.
Équilibre chimique
Chap N° 07 Sens d’évolution
spontanée d’un système chimique
-
Comparer l’avancement final
xf
et l’avancement maximal xmax
permet de distinguer les transformations totales et non totales.
-
Pour une transformation non totale, il
faut connaître la valeur de l’avancement final
xf
pour effectuer le bilan de matière à l’état final.
-
Dans le cas d’une transformation non
totale :
-
À l’état final :
-
Les quantités des espèces ne varient
plus ;
-
Tous les réactifs et les produits
coexistent.
-
On est en présence d’un
équilibre chimique.
-
Lors d’une réaction non totale :
-
Les
réactifs réagissent entre eux pour
donner les produits ;
-
Simultanément :
-
Les
produits réagissent pour donner les
réactifs.
-
Une réaction non totale est modélisée
par deux réactions opposées l’une de l’autre.
-
L’équation de la réaction s’écrit alors
avec une double flèche qui traduit le fait que deux réactions, inverses l’une
de l’autre, peuvent se produire simultanément dans le système.
-
L’équation s’écrit alors :
a
A + b
B
![]() c C + d
D
c C + d
D
Quotient de réaction :
Chap N° 07 Sens d’évolution spontané
d’un système chimique
-
Quotient de réaction et sens d’écriture
de la réaction :
-
Considérons la réaction chimique non
totale suivante :
a
. A
(aq) +
b
.
B
(aq)
![]() c
. C
(aq) +
d
.
D
(aq)
c
. C
(aq) +
d
.
D
(aq)
-
Pour simplifier l’expression, on omet
de mettre la concentration standard C0.
-
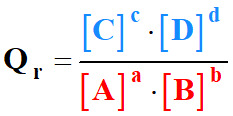
-
Mais, il ne faut pas oublier que le
quotient de réaction
est une grandeur sans unité
qui caractérise un système chimique dans un état donné :
-
Exemple : réaction entre l’acide
éthanoïque et l’eau :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O
+ (aq) |
-
Dans cette réaction, l’eau est le
solvant.
-
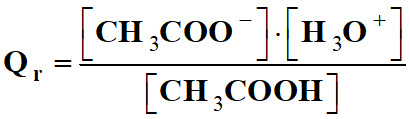
-
Constante d’équilibre d’une réaction
chimique :
-
Dans l’état d’équilibre d’un système,
le quotient de réaction Qr,éq
prend une valeur qui ne dépend pas de l’état initial.
-
La valeur de
Qr,éq
est indépendante de la composition initiale.
-
Cette valeur ne dépend que de la
température.
-
Elle est appelée constante d’équilibre
et on la note K.
-
K = Qr,éq
-
La valeur de la constante d’équilibre
nous renseigne sur la nature de la réaction chimique.
-
Si K
≥ 104 la transformation
chimique est quasi-totale (on dit aussi totale).
-
Si K
≈ 1 la transformation chimique est équilibrée.
-
Si K
≤ 10–4 la transformation
chimique est très limitée.
-
Exemple : Réaction entre l’acide
éthanoïque et l’eau :
|
CH3COOH
(aq) |
+ |
H2O
(ℓ) |
|
CH3COO
– (aq) |
+ |
H3O
+ (aq) |
-
À l’équilibre chimique, on peut
écrire :
-
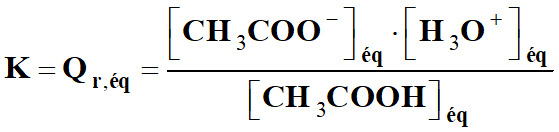
-
Dans le cas de la réaction suivante :
|
HCOOH
(aq) |
+ |
NH3
(aq) |
|
HCOO –
(aq) |
+ |
NH4+
(aq) |
-
Expression de la
constante d’équilibre K :
-
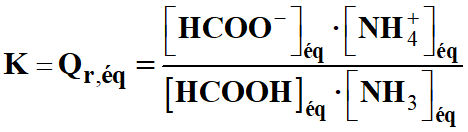
Quotient de réaction et constante d’équilibre :
Chap N° 07 Sens d’évolution
spontané d’un système chimique
-
Considérons la réaction suivante avec
la terminologie associée :
|
|
|
|
Sens direct
|
|
|
|
|
a A
(aq) |
+ |
b B
(aq) |
|
c C
(aq) |
+ |
d D
(aq) |
|
|
|
|
Sens inverse
|
|
|
|
►
Premier cas :
-
Si le quotient de réaction initial
Qr,i
est égal à la constante d’équilibre K,
-
soit
Qr,i
= K,
le système est déjà à l’équilibre.
-
Il n’évolue pas.
►
Deuxième cas :
-
Si le quotient de réaction initial
Qr,i
est inférieur à la constante d’équilibre
K,
-
soit
Qr,i
< K,
-
Le système chimique évolue spontanément
vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
►
Troisième cas :
-
Si le quotient de réaction initial
Qr,i
est supérieur à la constante d’équilibre
K,
-
soit
Qr,i
> K,
le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.
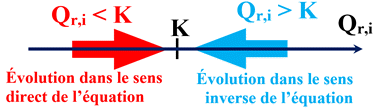
►
Remarque :
-
Ce critère d’évolution permet de
prévoir le sens d’évolution spontanée du système connaissant sa composition
initiale.
-
Ce critère ne tient pas compte de
l’aspect cinétique de la réaction.
Équivalence d’un titrage :
|
Équivalence d’un titrage : À l’équivalence, les réactifs sont
dans les proportions stœchiométriques
définies par les coefficients de la réaction.
À l’équivalence, il n’y a pas de
réactif limitant. |
-
L’équivalence du titrage :
|
L’équivalence d’un titrage est
atteinte lorsqu’on a réalisé un mélange stœchiométrique des
réactifs titré et titrant. |
|
La relation à l’équivalence permet de
déterminer la quantité de réactif titré. |
-
Relation à l’équivalence :
|
Équation de titrage :
|
a A |
+
b B |
→ |
c C |
+ d D |
|
Quantités de
matière à l’équivalence |
n0
(A)
|
nE
(B)
|
|
|
|
|
Coefficient stœchiométriques
|
a
|
b |
|
|
|
|
Relation à l’équivalence |
|
|
|
|
|
-
On étudie le système
avant l’équivalence,
à l’équivalence et
après l’équivalence.
|
Avant
l’équivalence |
|
Le
réactif titrant
est totalement consommé, c’est le
réactif limitant Il reste encore du
réactif titré :
il est en excès. |
|
À l’équivalence : |
|
Le
réactif titrant
et le
réactif titré
sont totalement consommés. Ils sont tous les deux limitants
(mélange stœchiométrique). |
|
Après l’équivalence |
|
Le
réactif titré
est totalement consommé : c’est le
réactif limitant. Maintenant, c’est le
réactif titrant
qui est en
excès. |
|
En conclusion |
|
À l’équivalence du titrage, il y a changement de réactif
limitant |
Quantité de matière et équivalence : Relation à
l’équivalence
|
Équation |
3 A
|
+ B |
→ |
C |
+ 2 D |
|
|
état |
Avanc. x
(mol) |
n
(A) (mol) |
n
(B) (mol) |
|
n
(C) (mol) |
n
(D) (mol) |
|
État initial |
x |
n1
|
n2
|
|
0 |
0 |
|
Au cours de la
transformation |
x
|
nA
– 3 x |
nB
– x |
x |
2 x |
|
|
État final |
xf = xmax |
nA
– 3 xf |
nB
– xf |
|
xf |
2 xf |
|
Réaction totale |
|
|
|
|
|
|
-
|
|
Équation de la
réaction de titrage |
||||
|
Équation |
3 A |
+
B |
→ |
C
+ 2 D |
|
|
État du système |
Avanc. |
n
(A) |
n
(B) |
|
|
|
État initial (mol) |
x =
0 |
n0
(A)
= CA . VA |
n
(B)
= CB . VB |
|
|
|
Au cours de la transformation |
x |
CA
. VA
– 3
. x |
CB
. VB – x |
|
|
|
État pour VB
< VE |
|
|
0 Réactif limitant
|
|
|
|
Équivalence VB
= VE |
|
0 |
0 |
|
|
|
Mélange
stœchiométrique |
|||||
|
État pour VB
> VE |
|
0 Réactif limitant |
|
||
-
À l’équivalence :
-
nB
=
CB
. VE
-
Pour retrouver la relation à
l’équivalence:
|
3 A |
B |
|
n
(A) = CA . VA |
n
(B) = CB . VE |
|
3 |
1 |
-
CA
. VA
= 3 CB
. VE
|
|