|
|
Forcer l'évolution d'un système chimique |
|
|
|
|
|
II- Le
fonctionnement d’un électrolyseur : étude quantitative.
1)- Quantité d’électricité mise en jeu lors d’un
électrolyse. |
|
III-
Conversion et stockage de l’énergie. |
|
1)-électrolyse d’une solution aqueuse de nitrate de plomb II.
QCM r
Forcer l’évolution d’un
système chimique La transformation forcée Le fonctionnement d’un
électrolyseur La conversion et le stockage de l’énergie |
|
Préparation à l’ECE : Cuve à électrodéposition 1)- Exercice 05
page 182 :Identifier la réaction électrochimique. 2)- Exercice 07
page 183 : Déterminer une quantité de matière. 3)- Exercice 09
page 183 : Déterminer un type de conversion. 4)- Exercice 12
page 184 : Des couverts en métal argenté. 5)- Exercice 15 page 185 : Nickelage d’une
pièce métallique. 6)- DS N° 01 (15 min): Obtention de lithium et de dichlore par électrolyse : Exercice 17 page 186. 7)- DS N° 02 (30 min) : Obtention du cuivre par électrolyse : Exercice 18 page 187.
|
|
QCM r
Forcer l’évolution d’un système
chimique La transformation forcée Le fonctionnement d’un
électrolyseur |
1)- Évolution spontanée d’un système.
a)-
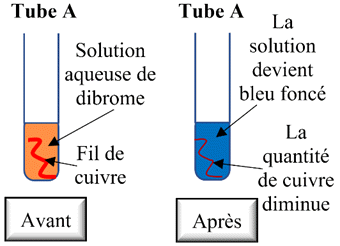
Expérience 1 : Réaction entre
une solution aqueuse de dibrome et du cuivre métal.
![]() Sous la hotte, on
verse dans deux tubes à essais A
et B,
environ 4 mL d’une solution aqueuse de dibrome.
Sous la hotte, on
verse dans deux tubes à essais A
et B,
environ 4 mL d’une solution aqueuse de dibrome.
-
Dans le tube
A,
on ajoute de la tournure de cuivre métallique et on laisse réagir.
-
Puis on ajoute 3 mL de
cyclohexane et on agite.
-
Dans le tube
B,
on ajoute 3 mL de cyclohexane et on agite.
![]() Observations :
Observations :
-
Tube
A :
-
Il se produit une
réaction entre le dibrome et le cuivre.
-
La solution
initialement orange s’éclaircit, puis devient de couleur bleu foncé et la
quantité de cuivre métallique diminue.
-
On remarque que la
concentration en dibrome diminue au cours de la réaction et qu’il se forme des
ions cuivre
II.
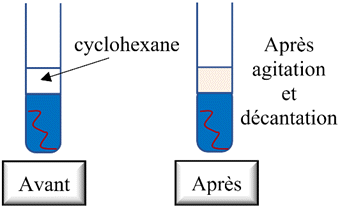
-
La solution de
cyclohexane se colore faiblement. Le dibrome pratiquement disparu en fin de
réaction.
-
Tube
B :
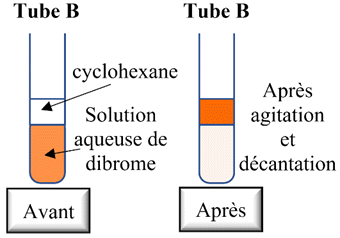
-
Le dibrome est plus
soluble dans le cyclohexane que dans l’eau.
- L’expérience réalisée dans le tube B permet de mettre en évidence le fait que le dibrome est soluble dans le cyclohexane.
- Elle montre aussi que la concentration en dibrome a diminuée lors de la réaction entre le dibrome et le cuivre métal.
-
On donne la réaction
d’oxydoréduction suivante :
|
Cu
(s) + Br2 (aq) |
|
Cu2+
(aq) + 2 Br– (aq) |
(1)
|
|
avec K =
1,2 × 1025 |
|||
-
On peut calculer le
quotient de la réaction initial du système précédent.
-
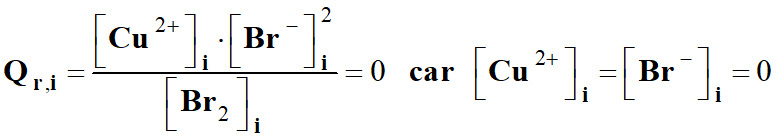
-
Le système évolue
spontanément dans le sens direct de l’équation de la réaction (1) car
Q
r, i
< K.
-
Lorsque le système a
fini d’évoluer :
-
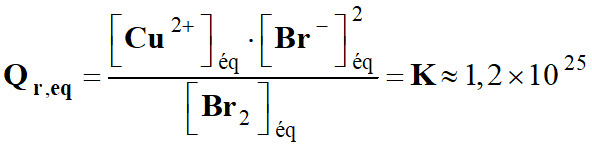
-
La
valeur très grande de K >> 10
4
permet
de dire que la réaction est quasiment totale et que le taux d’avancement final
de la réaction est pratiquement égal à 1.
-
τ
≈ 1
|
Cu
(s) + Br2 (aq) |
|
Cu2+
(aq) + 2 Br– (aq) |
(1)
|
|
avec K =
1,2 × 1025 |
|||
c)-
Expérience 2 : Réaction entre
une solution aqueuse de bromure de potassium et de sulfate de cuivre
I.
![]() Dans un tube à essais,
Dans un tube à essais,
-
On verse :
-
2 mL d’une solution de
bromure de potassium et
-
2 mL d’une solution de
sulfate de cuivre II
-
de même concentration
C
= 1,0 mol / L
-
On laisse réagir, puis
on ajoute 2 mL de cyclohexane et on agite.
![]() Observations :
Observations :
-
On ne remarque aucune
évolution.
►
Questions :
-
Quelle est l’équation
de la réaction susceptible de se produire ?
-
Quelle est la valeur
de sa constante d’équilibre
K’ ?
-
Quelle
est la valeur du quotient de réaction initial ?
►
Réponses :
-
Équation de la
réaction :
|
Cu2+
(aq) + 2 Br– (aq) |
|
Cu
(s) + Br2 (aq) |
(1’)
|
-
expression
de la constante d’équilibre
K’.
-
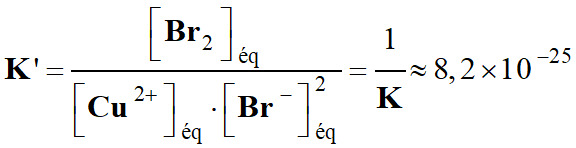
-
Valeur quotient de
réaction initial Qr,i ?
-
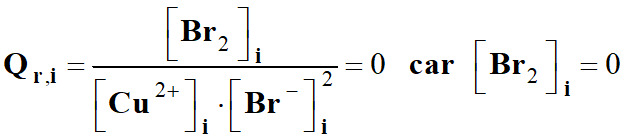
-
Le système évolue
spontanément dans le sens direct de l’équation de la réaction (1’)
-
car
Q
r, i
< K.
-
Mais Q r, i
≈ K
≈
0.
-
On peut considérer que
le système n’évolue pratiquement pas.
-
On n’observe aucune
évolution du système.
-
Les quantités de
matière mises en jeu sont très faibles.
-
Le taux d’avancement
de la réaction est très petit et
K
<< 1.
-
Le but est de fournir
de l’énergie à ce système pour voir si on peut le faire évoluer spontanément.
a)-
Expérience : Électrolyse
d’une solution aqueuse de bromure de cuivre
II.
![]() Montage :
Montage :
|
|
Le tube en
U
est rempli d’une solution aqueuse de bromure de
cuivre II de concentration C = 1,0
mol / L.
valeur de la tension
UAC. le phénomène
d’électrolyse commence.
U AC ≈ 1,5 V
environ. générateur se
recouvre d’un dépôt rougeâtre de
cuivre. générateur ;
apparition d’une coloration orange. En fin de
réaction, on peut ajouter délicatement du cyclohexane
et mélanger avec un agitateur et remarquer
que le cyclohexane prend une teinte orange
caractéristique de la présence de dibrome
Br2 (aq). |
-
L’électrode reliée à
la
borne positive :

-
l’électrode
reliée à la
borne négative :

-
Le générateur impose
le sens du courant dans le circuit.
-
Le courant sort de la
borne positive du générateur.
-
Dans les fils conducteurs, les porteurs de charge sont les électrons qui se déplacent
dans le sens inverse du courant.
- Dans la solution aqueuse de bromure de cuivre II,
- les ions cuivre II, Cu 2+(aq) se déplacent dans le sens du courant et
- les ions bromure,
Br
– (aq) se déplacent dans le sens inverse
du sens du courant (sens de déplacement des électrons.
-
Le dépôt rougeâtre qui
apparaît à l’électrode reliée à la borne négative du générateur est constitué de
cuivre métal.
-
il
se produit la réduction suivante :
-
Cu2+
(aq) +
2 e–
→
Cu
(s)
-
La réduction
se produit à la
cathode (Électrode négative).
-
Le jaunissement de la
solution au niveau de l’électrode reliée à la borne positive est provoqué par la
formation de dibrome.
-
Il se produit
l’oxydation suivante :
-
2
Br–
(aq)
→ 2
e–
+ Br2
(aq)
-
L’oxydation
se produit à l’anode
(Électrode positive).
-
L’équation de la
réaction qui se produit lors de l’électrolyse est la suivante :
|
Cu2+
(aq) + 2 e–
|
→ |
Cu
(s) |
|
|
2 Br–
(aq) |
→ |
2 e–
+ Br2 (aq) |
|
|
Cu2+
(aq) + 2 Br–
(aq) |
→ |
Cu
(s) + Br2 (aq) |
(1’) |
-
On a vu précédemment
que ce système constitué d’ions cuivre
II
en présence d’ions bromure n’évolue pas.
-
Le générateur fournit
l’énergie nécessaire pour faire évoluer le système.
-
C’est lui qui impose
le sens de circulation du courant dans le circuit.
-
Il peut le forcer à
évoluer.
-
Au cours de la
première expérience, on observe l’évolution spontanée d’équation :
|
Cu
(s) + Br2 (aq) |
→ |
Cu2+
(aq) + 2 Br– (aq) |
(1)
|
-
Lors de l’électrolyse,
il se produit la réaction suivante :
|
Cu2+
(aq) + 2 Br–
(aq) |
→ |
Cu
(s) + Br2 (aq) |
(1’) |
-
Le sens de cette
réaction est le sens inverse du sens d’évolution spontanée :
-
C’est une réaction
forcée.
-
Elle a lieu grâce à
l’énergie électrique fournie par le générateur.
-
Cette réaction forcée,
appelée électrolyse, n’a lieu que si le générateur apporte de l’énergie
électrique sinon, elle cesse.
-
Pour réaliser cette
opération, il faut un électrolyseur.
►
L’électrolyseur :
-
Un électrolyseur est
un récepteur électrique constitué de deux électrodes (tiges conductrices) qui
plongent dans une solution appelée électrolyte.
-
Le générateur impose
le transfert d’électrons et force une transformation limitée à poursuivre son
évolution.
-
L’électrolyse est une
réaction endoénergétique (elle consomme de l’énergie).
-
L’électrode à laquelle
se produit l’oxydation est appelée anode (reliée à la borne positive du
générateur)
-
L’électrode à laquelle
se produit la réduction est appelée cathode (reliée à la borne négative du
générateur).
-
Schéma simplifié :
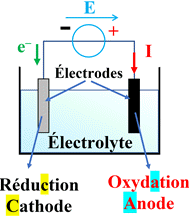
►
Remarque :
-
Les termes anode et
cathode pour noter les électrodes s’emploient aussi pour les piles.
-
L’anode
désigne toujours l’électrode où se produit l’oxydation.
-
À l’anode des électrons sont cédés par
la demi-équation électronique produite
-
La
cathode
désigne toujours l’électrode où se produit la
réduction.
-
À la cathode, les électrons sont
consommés par la demi-équation électronique produite.
►
Exemples
d’électrolyseurs :
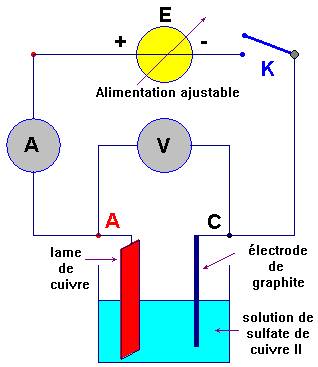
-
Électrolyse d’une
solution de sulfate de cuivre II :
-
Électrolyse d’une
solution aqueuse d’acide sulfurique :
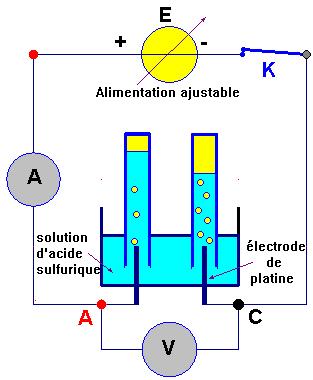
-
Représentation
schématique :
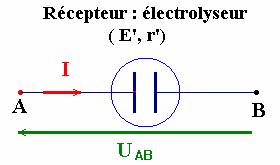
II-
Le
fonctionnement d’un électrolyseur : étude quantitative.
1)- Quantité d’électricité mise en jeu lors d’une
électrolyse.
-
L’intensité I du
courant qui circule dans l’électrolyseur pendant la durée Δt
est
donnée par la relation suivante :
|
|
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
La quantité
d’électricité Q
mise en jeu au cours de l’électrolyse pendant la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday :
La valeur absolue de la charge d’une mole d’électrons définit le faraday de
symbole F.
-
1
F = |NA
. n (e–)|
-
Q
quantité d’électricité mise en jeu : grandeur
positive : Unité :
coulomb (C).
►
Remarque :
-
Quantité de matière d’électrons
échangés :
-
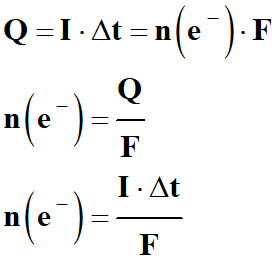
III-
Conversion et stockage de l’énergie.
-
Convertisseurs d’énergie :
-
Un convertisseur
d’énergie assure la conversion d’une forme d’énergie en une ou plusieurs formes
d’énergie.
-
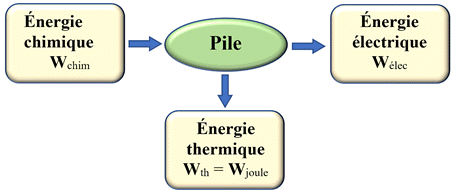
Une pile :
-
Une pile est un
convertisseur d’énergie
qui convertit de l’énergie chimique en énergie
électrique.
-
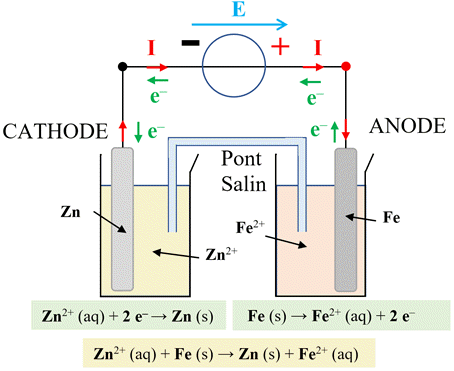
Un électrolyseur :
-
Un électrolyseur
est un convertisseur d’énergie
qui convertit de l’énergie électrique en
énergie chimique.
-
Un accumulateur électrique
:
-
Un
accumulateur électrique est un convertisseur d’énergie pouvant se comporter
comme une pile ou comme un électrolyseur.
-
La réaction, qui se
produit dans une pile, est la réaction opposée à celle qui se produit dans un
électrolyseur.
-
Dans les
accumulateurs, l’énergie électrique est stockée sous forme d’énergie chimique.
2)- Exemple : l'accumulateur Fer-Zinc :
- La pile Fer-Zinc :
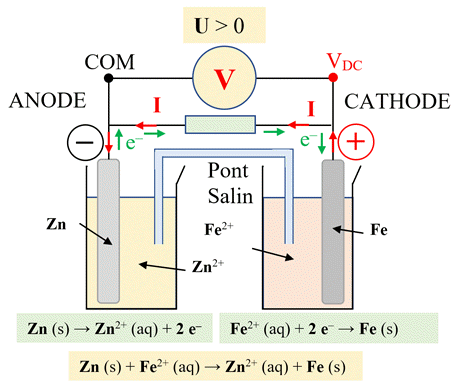
-
Bilan énergétique de
la pile :
-
Électrolyseur
Fer-Zinc :
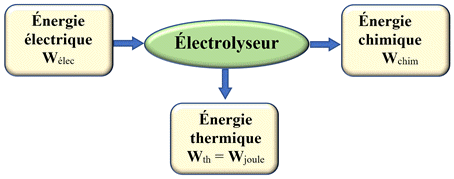
-
Bilan énergétique d’un
électrolyseur.
-
Dans une pile ou un
électrolyseur, une partie de l’énergie est dissipée sous forme de transfert
thermique (effet joule).
-
Ce phénomène diminue
le rendement de ces convertisseurs.
-
Cas de la cellule
photovoltaïque :

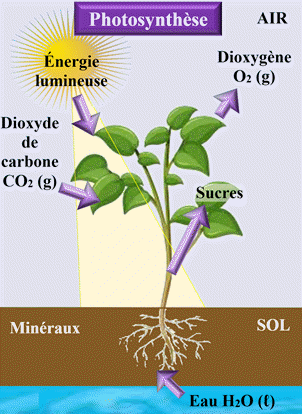
3)- Les organismes
chlorophylliens :
-
Le
système chimique des organismes chlorophylliens constitué de glucose, de
dioxygène, de dioxyde de carbone et d’eau évolue spontanément,
la nuit, dans le
sens direct :
|
Sens direct → |
||
|
C6H12O6
(aq) + 6 O2
(g) |
|
6 CO2
(g) + 6 H2O
(ℓ) |
|
← Sens inverse
|
||
-
L’énergie apportée par la
lumière du jour force le
système chimique à évoluer dans le sens opposé de l’équation : c’est la
photosynthèse.
1)-
électrolyse d’une solution aqueuse
de nitrate de plomb II.
|
Un chimiste effectue l’électrolyse d’une solution aqueuse de
nitrate de plomb
II :
-
(Pb2+ (aq) + 2
NO3– (aq) ). Les électrodes utilisées sont inattaquables et les ions nitrate
ne réagissent pas.
1.
Il se forme un dépôt de plomb sur une
électrode. Laquelle ? 2.
Écrire l’équation de la réaction
correspondant à ce dépôt. 3.
Sur l’autre électrode, se dégage un gaz qui
ravive une allumette incandescente.
-
De quel gaz s’agit-il ? sur quelle
électrode se forme-t-il ? 4.
Écrire l’équation de la réaction
correspondante à ce dégagement. 5.
En déduire l’équation globale ayant lieu
lors de cette électrolyse. 6.
L’électrolyse dure 25 min et l’intensité du
courant est maintenue égale à 0,85 A. a.
Quelle est la quantité de matière (en mol)
de plomb déposé sur l’une des électrodes ? b.
En déduire la masse de plomb déposé. c.
Déterminer le volume de gaz qui s’est formé
sur l’autre électrode.
-
Données :
-
Volume molaire des gaz dans les
conditions de l’expérience :
-
Vm =
25 L / mol.
-
Masse molaire atomique :
-
M(Pb)
= 207 g / mol. |
|
Solution. 1.
Électrode :
-
Électrode 1 :
-
Le dépôt de plomb se forme sur
l’électrode reliée à la borne négative du générateur :
-
La cathode. 2.
Équation de la réaction correspondant à ce
dépôt.
-
Il s’agit d’une réduction : la
réduction des ions plomb
II.
3.
Dégagement gazeux
qui ravive une allumette incandescente.
-
Électrode 2 :
-
Le gaz qui ravive l’incandescence
d’une allumette est le dioxygène
O 2.
-
Il se forme à l’anode, électrode
reliée à la borne positive du générateur. 4.
Équation de la réaction correspondante à ce
dégagement.
-
Il s’agit d’une oxydation :
-
L’oxydation de l’eau.
-
Elle se produit à l’anode 5.
Équation globale ayant lieu lors de cette
électrolyse.
6.
Étude
quantitative de l’électrolyse :
-
L’électrolyse dure Δt =
25 min et l’intensité du courant I = 0,85 A a.
Quantité de matière (en mol) de plomb déposé
sur l’une des électrodes :
-
Quantité de matière d’électrons
échangés :
-
- Pour connaître la quantité de matière de plomb déposé, il faut utiliser la demi-équation électronique
faisant intervenir les électrons :
-
Relation :
-
-
On tire :
-
-
Application numérique :
-
b.
Masse de plomb déposé.
-
m (Pb) = n (Pb)
. M (Pb)
-
m (Pb) ≈ 6,6 × 10–3
× 207
-
m (Pb) ≈ 1,36
g
-
m (Pb) ≈ 1,4 g c.
Volume de gaz qui s’est formé sur l’autre
électrode.
-
Équation de la réaction :
-
Volume de dioxygène obtenu :
-
|
|
QCM r
Forcer l’évolution
d’un système chimique La transformation
forcée Le fonctionnement
d’un électrolyseur La conversion et le stockage de l’énergie |
|
Préparation à l’ECE : Cuve à électrodéposition 1)- Exercice 05
page 182 :Identifier la réaction électrochimique. 2)- Exercice 07
page 183 : Déterminer une quantité de matière. 3)- Exercice 09
page 183 : Déterminer un type de conversion. 4)- Exercice 12
page 184 : Des couverts en métal argenté. 5)- Exercice 15 page 185 : Nickelage d’une
pièce métallique. 6)- DS N° 01 (15 min): Obtention de lithium et de dichlore par électrolyse : Exercice 17 page 186. 7)- DS N° 02 (30 min) : Obtention du cuivre par électrolyse : Exercice 18 page 187.
|
|
|