|
Forcer
l’évolution d’un système chimique. |
|
|
|
|
|
|
QCM N°
09
Forcer
l’évolution d’un système chimique.
La
transformation forcée
Le
fonctionnement d’un électrolyseur
La conversion
et le stockage de l’énergie
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Dans une
transformation forcée, le transfert d’électrons est
imposé
par : |
Le
générateur |
L’électrode |
L’électrolyte |
A |
|
2 |
Lors d’une électrolyse, la circulation du
courant est assurée :
|
Uniquement
par les
électrons |
Uniquement
par les ions |
Par les électrons
et les ions |
C |
|
3 |
Une transformation
est limitée si :
|
La constante
d’équilibre
K est
grande |
La constante
d’équilibre
K est
petite |
Le quotient
de réaction
Qr,i est
proche de la
constante
d’équilibre
K. |
B |
|
4 |
Cu (s) + Fe2+ (aq)
Cu2+
(aq) + Fe (s) La constante d’équilibre K associée à cette réaction à 25 ° C est
égale à 4,1 × 10–27.
On peut dire
que : |
La quantité
de fer
formée
est faible |
La quantité
de fer
formée
peut être
importante |
Le passage d’un courant peut forcer
le
système chimique à
aller jusqu’à
l’épuisement
du réactif
limitant |
AC |
|
5 |
Le dispositif
qui permet de produire de l’électricité à partir d’une
réaction chimique est :
|
Une pile |
Un
électrolyseur |
Un panneau
solaire |
A |
|
6 |
Le schéma de
fonctionnement
d’un
électrolyseur
est : |
|
|
|
B |
|
7 |
On observe
pour
l’électrolyse
suivante :
|
Une
diminution
de la masse
de l’électrode
d’étain Sn
(s) |
Une
augmentation
de la masse
de l’électrode
d’étain Sn
(s) |
Un dépôt
d’étain Sn
(s)
sur
l’électrode
de fer |
AC |
|
8 |
La quantité
d’électrons
échangés au
cours de la
transformation
est : |
|
|
|
A |
|
9 |
La quantité d’électricité Q mise en jeu au cours de l’électrolyse de 10 min dont l’intensité I du courant est de
100 mA est
égale à : |
Q
= 60 C |
Q
= 1,0 C |
Q
= 600 C |
A |
|
10 |
L’électrolyse : |
Permet de
convertir de
l’énergie
électrique en énergie
chimique. |
Permet de
convertir de
l’énergie
chimique en énergie
électrique. |
Nécessite
un
apport
d’énergie. |
AC |
|
11 |
Un
accumulateur : |
Permet de
convertir de
l’énergie
électrique en énergie
chimique. |
Permet de
convertir de
l’énergie
chimique en énergie
électrique. |
Permet de
stocker de
l’énergie
chimique |
ABC |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Le générateur :
-
Schéma d’une pile :
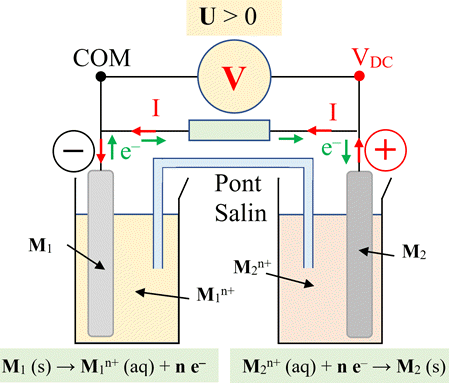
-
À l’extérieur de la pile (circuit électrique), le
courant électrique est dû à un déplacement d’ensemble des électrons qui
circulent de la borne négative (anode) vers la borne positive (cathode).
-
À l’intérieur de la pile :
-
Dans les solutions, la conduction électrique est
dû à la double migration des ions positifs et négatifs, présents dans les
différentes solutions, se déplaçant en sens inverses.
►
Remarque :
- Les électrons n’existent pas en solution aqueuse et ils ne peuvent pas s’accumuler sur la plaque.
- Ils se déplacent vers
l’électrode de cuivre grâce au circuit électrique.
-
Le sens conventionnel du courant est inverse de
celui des électrons.
L’électrolyse :
-
L’électrolyse est une transformation forcée.
►
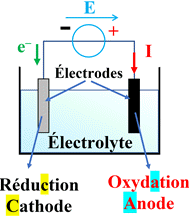
L’électrolyseur :
-
Un électrolyseur est un récepteur électrique
constitué de deux électrodes (tiges conductrices) qui plongent dans une solution
appelée électrolyte.
-
Le générateur impose le transfert d’électrons
dans les fils conducteurs et force une transformation limitée à poursuivre son
évolution.
-
L’électrolyse est une réaction endoénergétique
(elle consomme de l’énergie).
-
L’électrode à laquelle se produit l’oxydation est
appelée anode (reliée à la borne positive du générateur)
-
L’électrode à laquelle se produit la réduction
est appelée cathode (reliée à la borne négative du générateur).
-
Dans l’électrolyte, la conduction électrique est
dû à la double migration des ions positifs et négatifs, présents dans la
solution, se déplaçant en sens inverses.
-
Schéma simplifié :
Les transformations chimiques et la constante d’équilibre
K.
-
Dans l’état d’équilibre d’un système, le quotient
de réaction Qr,éq prend
une valeur qui ne dépend pas de l’état initial.
-
La valeur de
Qr,éq est indépendante de la composition initiale.
-
Cette valeur ne dépend que de la température.
-
Elle est appelée constante d’équilibre et on la
note K.
K = Qr,éq
-
La valeur de la constante d’équilibre nous
renseigne sur la nature de la réaction chimique.
-
Si
K ≥
104 la transformation
chimique est quasi-totale (on dit aussi totale).
-
Si
K ≈
1 la transformation chimique est équilibrée.
-
Si
K ≤
10–4 la transformation
chimique est très limitée.
-
Si la disparition d’un réactif intervient alors
que la valeur du quotient de réaction
Qr,
n’a pas atteint la valeur de
K, la
réaction est totale.
Quantité d’électricité mise en jeu lors d’une électrolyse.
-
L’intensité
I du courant qui circule dans
l’électrolyseur pendant la durée Δt
est donnée par la relation suivante :
|
|
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
La quantité d’électricité
Q mise en jeu au
cours de l’électrolyse pendant la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday : La valeur absolue de la
charge d’une mole d’électrons définit le faraday de symbole
F.
-
1
F = |NA .
n (e–)|
-
Q quantité d’électricité mise en jeu : grandeur positive :
Unité : coulomb (C).
►
Remarque :
-
Quantité de matière d’électrons échangés :
-
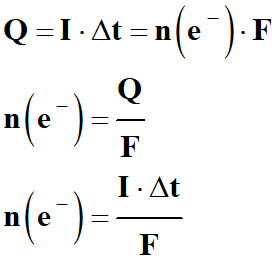
Convertisseurs d’énergie :
-
Un convertisseur d’énergie assure la conversion
d’une forme d’énergie en une ou plusieurs formes d’énergie.
-
Une pile :
-
Une pile est un convertisseur d’énergie
qui convertit de l’énergie chimique en énergie électrique.
-
Un
électrolyseur :
-
Un électrolyseur est un convertisseur
d’énergie qui convertit de l’énergie
électrique en énergie chimique.
-
Un
accumulateur électrique :
-
Un accumulateur électrique est un convertisseur
d’énergie pouvant se comporter comme une pile ou comme un électrolyseur.
-
La réaction, qui se produit dans une pile est la
réaction opposée à celle qui se produit dans un électrolyseur.
-
Dans les accumulateurs, l’énergie électrique est
stockée sous forme d’énergie chimique.
Bilan énergétique de la pile :
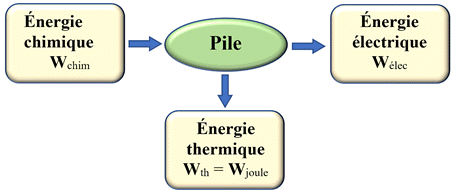
Bilan énergétique d’un électrolyseur.
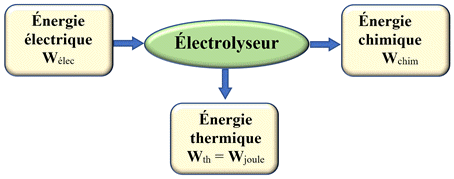
-
Dans une pile ou un électrolyseur, une partie de
l’énergie est dissipée sous forme de transfert thermique (effet joule).
-
Ce phénomène diminue le rendement de ces
convertisseurs.
Bilan de puissance de la cellule photovoltaïque :

|
|