|
Forcer l’évolution d’un système chimique. |
|
|
|
|
|
|
QCM N° 09
Forcer
l’évolution d’un système chimique.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Une
transformation chimique
forcée : |
N’a pas lieu
naturellement |
a lieu
naturellement |
nécessite un
apport d'énergie
de l'extérieur |
AC |
|
2 |
On considère une
transformation
chimique
telle que Qr,i
> K (T) et
qui évolue dans
le sens direct.
On peut en
déduire que
C’est une
transformation : |
spontanée |
forcée |
À l’équilibre
chimique |
B |
|
3 |
La transformation
chimique
modélisée par la
réaction
d'équation :
2 H2O
(ℓ) → 2 H2 (g) + O2 (g)
est une : |
Transformation
spontanée |
Transformation
forcée |
Nécessite un
apport d’énergie
de l’extérieur |
BC |
|
4 |
Lors d'une
électrolyse : |
Une oxydation
a lieu à
la cathode |
Une oxydation
a lieu à
la l’anode |
Une réduction
a lieu à
la cathode |
BC |
|
5 |
Un électrolyseur
est constitué : |
D’une électrode
et
d’une solution
contenant
des ions |
De 2 électrodes
et de
2 solutions
contenant
des ions |
De 2 électrodes
et
d’une solution
contenant
des ions |
C |
|
6 |
Dans un
électrolyseur,
la transformation
est modélisée
par une
réaction : |
D’oxydoréduction |
Acide - base |
De combustion |
A |
|
7 |
À l’électrode
d’un électrolyseur
reliée au pôle
positif du
générateur
extérieur a lieu une
réaction
correspondant à : |
Une perte
d’un ou
plusieurs
électrons |
Un gain
d’un ou
plusieurs
électrons |
Un gain
d’un ou
plusieurs
protons |
A |
|
8 |
Les quantités de
matière des
produits formés
pendant
l’électrolyse
dépendent : |
De l’intensité
I
du courant
délivré par
le générateur |
De la durée
Δt
de l’électrolyse |
De la charge e
transportée
par l’électron |
ABC |
|
9 |
La quantité de
matière d’électrons
transférés lors
d’une électrolyse
d’intensité
constante I pendant
la durée Δt
est donnée par
la relation :
|
|
|
|
B |
|
10 |
Lors de la charge
d’un
accumulateur, la
transformation
chimique qui
assure la conversion
de l’énergie
électrique en énergie
chimique est
une : |
Transformation
forcée |
Transformation
à l’équilibre
chimique |
Transformation
spontanée |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Transformation chimique forcée :
-
Une transformation chimique forcée est une réaction qui évolue dans le sens
opposé à son sens d’évolution spontanée.
-
Généralement, cela nécessite un apport d'énergie de l’extérieur tel qu'un
courant électrique imposé par un générateur (lors d’une électrolyse).
Constante d’équilibre et évolution spontanée :
Sens d’évolution d’une transformation chimique :
-
Système chimique hors d’équilibre :
-
Tout système chimique, hors d’équilibre, évolue spontanément vers un état
d’équilibre.
-
À une température donnée, la comparaison du quotient de réaction dans l’état
initial, Qr,i
à la constante d’équilibre K
permet de prévoir le sens d’évolution spontanée du système chimique.
-
Considérons la réaction suivante avec la terminologie associée :
|
Sens direct : K |
||||||
|
a
A
(aq) |
+ |
b
B
(aq) |
|
c
C (aq) |
+ |
d
D
(aq) |
|
Sens inverse :
K’ = 1 / K |
||||||
-
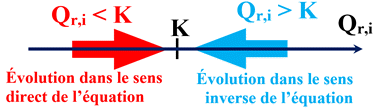
Premier cas :
-
Si le quotient de réaction initial Qr,i
est égal à la constante d’équilibre K,
-
soit Qr,i =
K, le système est déjà à l’équilibre.
-
Il n’évolue pas.
-
Deuxième cas :
-
Si le quotient de réaction initial
Qr,i est inférieur à la
constante d’équilibre K,
-
soit Qr,i
< K,
-
Le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
-
Troisième cas :
-
Si le quotient de réaction initial Qr,i
est supérieur à la constante d’équilibre
K,
-
soit Qr,i
>
K, le système chimique évolue
spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.
Électrolyse de l’eau :
Électrolyse :
-
Procédé de séparation d’espèces chimiques par le passage d'un courant électrique
à travers la solution qui les contient, entraînant leur décomposition chimique.
-
Elle permet notamment de décomposer des espèces chimiques, de les séparer, ou de
déposer des métaux sur des surfaces.
-
Pour réaliser une électrolyse, on utilise un électrolyseur.
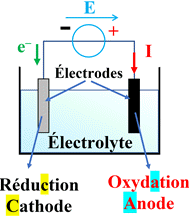
Électrolyseur :
-
Un électrolyseur est un récepteur électrique constitué de deux électrodes (tiges
conductrices) qui plongent dans une solution appelée électrolyte.
-
Un électrolyseur est un convertisseur d’énergie qui convertit de l’énergie
électrique en énergie chimique
-
Le générateur impose le transfert d’électrons et force une transformation
limitée à poursuivre son évolution.
-
L’électrolyse est une réaction endoénergétique (elle consomme de l’énergie).
Électrolyseur et réaction chimique :
-
Dans un électrolyseur, la transformation est modélisée par une
réaction d’oxydoréduction.
-
L’électrode à laquelle se produit l’oxydation est appelée anode (reliée à la
borne positive du générateur)
-
L’électrode à laquelle se produit la réduction est appelée cathode (reliée à la
borne négative du générateur).
-
Schéma simplifié :
►
Remarque :
-
Les termes anode et cathode pour noter les électrodes s’emploient aussi pour les
piles.
-
L’anode désigne toujours l’électrode où se
produit l’oxydation.
-
La
cathode désigne toujours l’électrode où se produit la
réduction.
Réactions aux électrodes de l’électrolyseur :
-
L’électrode à laquelle se produit l’oxydation est appelée anode (reliée à la
borne positive du générateur)
-
Cette réaction cède un ou plusieurs électrons.
-
Exemple : 2 Br– (aq)
→ 2 e– + Br2 (aq)
-
L’électrode à laquelle se produit la réduction est appelée cathode (reliée à la
borne négative du générateur).
-
Cette réaction consomme un ou plusieurs électrons.
-
Exemple : Cu2+ (aq) + 2 e– → Cu (s)
Électrolyse et quantités de matière :
-
L’intensité I du courant qui circule
dans l’électrolyseur pendant la durée Δt
est donnée par la relation
suivante :
|
|
|
|
I |
Intensité du
courant (A) |
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
Δt |
Durée de
fonctionnement de l’électrolyseur (s) |
-
La quantité d’électricité Q mise en jeu au cours de l’électrolyse pendant
la durée Δt :
|
Q
= n (e–) . F |
|
|
Q |
Quantité
d’électricité mise en jeu (C) |
|
n
(e–) |
Quantité de
matière d’électrons échangés (mol) |
|
F |
Constante de
Faraday : F = 96500 C . mol–1 |
-
Constante de Faraday : La valeur absolue de la charge d’une mole d’électrons
définit le faraday de symbole F.
-
1 F = |NA . n (e–)|
-
Q quantité
d’électricité mise en jeu : grandeur positive :
Unité : coulomb (C).
►
Remarque :
-
Quantité de matière d’électrons échangés :
-
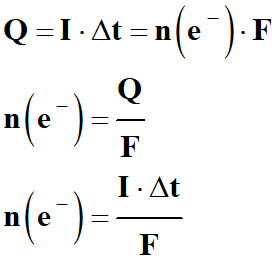
Charge d’un accumulateur :
-
Un accumulateur électrique :
-
Un accumulateur électrique est un convertisseur d’énergie pouvant se comporter
comme une pile ou comme un électrolyseur.
-
La réaction, qui se produit dans une pile est la réaction opposée à celle qui se
produit dans un électrolyseur.
-
Dans les accumulateurs, l’énergie électrique est stockée sous forme d’énergie
chimique.
-
Bilan énergétique de la pile :
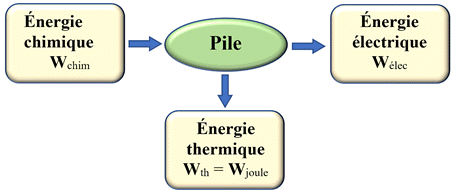
-
Bilan énergétique d’un électrolyseur.
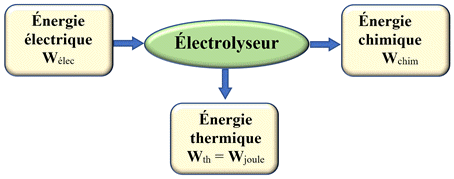
-
Pour la pile, la réaction chimique globale est spontanée.
-
Pour l’électrolyseur, la réaction chimique globale est forcée.
|
|