|
TP Chimie N° 09
|
Étude expérimentale
de
l'électrolyse :
correction.
Enoncé.
|
|
|
Matériel :
8 Béchers de 250 mL
– 8 lames de cuivre –
8 électrodes de graphite - 8 fils de cuivre avec borne
–
solutions de sulfate de cuivre
II,
C
≈ 1,0 mol / L
–
fils de connexion – (pinces crocodiles rouges et noires)– toile émeri
–
générateur de courant continu –
2 multimètres.
Prof :
cuve à électrolyse
avec électrodes de platine
– solution d’acide sulfurique
C ≈ 1,0 mol / L
- 2 éprouvettes graduées de 10 mL
– bâtons de bois et allumettes – chronomètre.
|
I-
Électrolyse d’une solution de sulfate de cuivre II. Étude
qualitative.
1)-
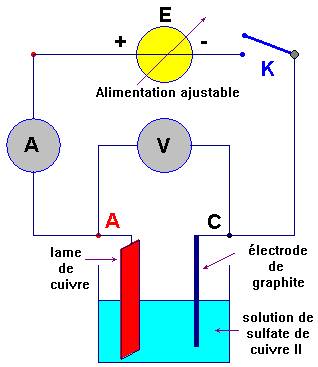
Dispositif expérimental 1.
a)- Montage :
 Réaliser le montage suivant :
Réaliser le montage suivant :
|
|
Attention :
Les électrodes ne doivent pas être
en contact.
Augmenter progressivement
la valeur de la tension
aux bornes de
l’électrolyseur grâce au potentiomètre
de
l’alimentation ajustable.
On note la valeur de
U0 pour laquelle
l’électrolyse commence (Alors
I
≠ 0).
On
règle ensuite la valeur de la tension :
UAC
≈ 1,0 V.
Laisser passer le courant pendant 2 minutes.
|
b)- Observations : Qu’observe-t-on au niveau des électrodes ?
- U0
≈ 1,0 V et
I
≈ 200 mA.
- Il faut attendre 2 min environ pour pouvoir faire les observations.
- Au
cours de l’électrolyse, il apparaît un dépôt rougeâtre sur l’électrode
reliée à la borne négative du générateur.
- À l’électrode reliée à la
borne positive du générateur aucun phénomène n’est visible.
2)-
Dispositif expérimental 2.
a)- Montage :
 Le dispositif est le même mais on remplace la lame de cuivre par
un fil de cuivre très fil.
Le dispositif est le même mais on remplace la lame de cuivre par
un fil de cuivre très fil.
- Il faut nettoyer et décaper
l’électrode de graphite.
b)- Observations : Qu’observe-t-on au niveau des électrodes ?
- À l’électrode reliée à la borne négative du générateur, il se
forme un dépôt rougeâtre.
- À l’électrode reliée à la borne positive du générateur, le fil
de cuivre est rongé.
- Si l’électrolyse se poursuit, le fil de cuivre disparaît
totalement.
3)-
Interprétation.
 À partir des observations, déduire les demi-équations électroniques
qui se produisent à l’anode et à la cathode.
À partir des observations, déduire les demi-équations électroniques
qui se produisent à l’anode et à la cathode.
- Électrode reliée à la borne négative du générateur :
- Le dépôt de couleur rougeâtre est constitué de cuivre à l’état
métallique :
- Demi-équation électronique :
Cu2+(aq)
+
2 e
–
= Cu
(s)
- la
réduction
se produit à la cathode.
-
C’est l’électrode reliée à la borne négative du générateur.
- Électrode reliée à la borne positive du générateur :
- À cette électrode, le cuivre disparaît.
- Il se produit la réaction
suivante :
- Demi-équation électronique :
Cu
(s)
= Cu2
+(aq)
+
2 e
–
- l’oxydation
se produit à l’anode.
-
C’est l’électrode reliée à la borne positive du générateur
- Écrire l’équation de la réaction d’électrolyse.
|
Cu2+(aq)
+
Cu
(s)
=
Cu2+(aq)
+
Cu
(s)
|
- Pourquoi cette électrolyse est-elle appelée : électrolyse à
anode soluble ?
- Au cours de l’électrolyse, tout se passe comme si le cuivre métal
avait été transporté de l’anode vers la cathode :
- On parle d’électrolyse
à anode soluble.
- Remarque :
- Si on place un objet métallique à la cathode, on peut
le recouvrir de cuivre métal et ainsi le protéger de la corrosion :
- C’est la galvanostégie.
- La galvanostégie est l’opération qui consiste à former une mince couche
métallique sur un objet conducteur pour le protéger de la corrosion
- (chromage,
nickelage, dorure argenture, …)
- Conclusion.
- Le générateur impose le sens du courant dans le circuit. Il se
produit des réactions chimiques au niveau des électrodes.
-
À la cathode, il se produit une réaction qui consomme des électrons,
c’est une réduction.
- À l’anode, il se produit une réaction qui cède des électrons :
une oxydation.
- Le courant électrique dans les parties métalliques est dû à un
transfert d’électrons.
- Le courant électrique dans la solution aqueuse ionique est dû à une
double migration des ions positifs et négatifs se déplaçant en sens
inverse.
- Les cations se dirigent vers la cathode et les anions vers l’anode.
- Si on enlève le générateur, il ne se produit aucune réaction
chimique. Le générateur apporte l’énergie nécessaire à la réaction
chimique.
II-
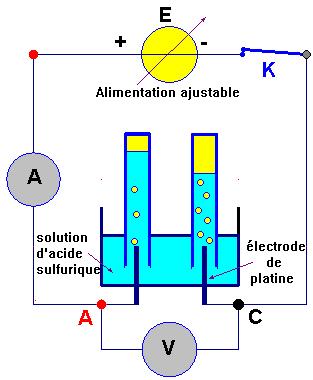
Électrolyse d’une solution aqueuse d’acide sulfurique (prof).
1)-
Dispositif expérimental.
|
|
À l’aide du potentiomètre, de l’alimentation
ajustable,
on augmente progressivement la valeur de la tension
aux
bornes de l’électrolyseur.
On note la valeur de
U0 pour laquelle l’électrolyse
commence (Alors
I ≠
0 et apparition
d’un dégagement
gazeux au niveau des électrodes).
On règle ensuite rapidement la valeur de la tension
:
UAC
≈ 1,0 V.
On déclenche le chronomètre.
Laisser
passer le courant.
Lorsque le volume gazeux dans
l’éprouvette graduée
surmontant la cathode est assez important (9 mL
environ) :
Mesurer la durée de l’électrolyse :
Δt.
Le volume de gaz obtenu à la cathode : VC.
|
2)- Expériences :
|
 Test 1 :
on
présente rapidement une allumette enflammée à l’ouverture de l’éprouvette
surmontant la cathode.
|
|
 Test
2 :
On continue l’électrolyse et lorsque le
dégagement gazeux est assez important (9 mL environ),
dans
l’éprouvette graduée qui surmonte l’anode,
on présente à son ouverture
un bâton de bois incandescent.
|
3)-
Observations.
- Comparer régulièrement au cours de l’électrolyse les volumes de
gaz VC et
VA formés à la cathode et à l’anode.
- D’après les tests réalisés précédemment que peut-on dire de la
nature du gaz dégagé à cathode ?
à
l’anode ?
- La valeur de
U0
pour laquelle l’électrolyse commence est voisine de 2,6 V.
- VC
≈ 2 VA
- Le gaz qui ravive la combustion d’une bûchette incandescente est le
dioxygène O
2.
- Le gaz qui provoque une légère détonation en présence d’une
flamme est de dihydrogène
H
2.
- En conséquence :
V
(H2)
≈ 2 V
(O2)
4)-
Interprétation.
 À partir des observations, déduire les demi-équations électroniques
des réactions se produisant à l’anode et à la cathode.
À partir des observations, déduire les demi-équations électroniques
des réactions se produisant à l’anode et à la cathode.
-
À l’anode, il se produit un dégagement de dioxygène :
- Il
se produit l’oxydation de molécules d’eau.
|
2
H2O
(ℓ)
= O2
(g)
+ 4 H
+(aq)
+ 4 e
–
|
- À la cathode, il se produit un dégagement de dihydrogène :
- Il
se produit la réduction des ions hydrogène (Pour simplifier, on les note
H
+)
|
2
H
+(aq)
+ 2 e
– =
H2
(g)
|
- Faire le schéma du dispositif en indiquant le sens du courant et le
sens de déplacement des différents porteurs de charge.
- Schéma du dispositif :

- Écrire l’équation de la réaction d’électrolyse.
|
2
H2O
(ℓ)
= O2
(g)
+ 2 H2
(g)
|
- Cette équation est-elle en accord avec les volumes gazeux mesurés.
Justifier.
- Au cours de la réaction, on remarque que :
|
V
(H2)
= 2 V
(O2)
|
|
Ce qui est en accord avec l’expérience.
|
|
Au cours de l’expérience :
|
|
n
(H2)
= 2 n
(O2)
|
|
Or |
|
V
(H2)
= n
(H2)
. Vm
et
V
(O2)
= n
(O2)
. Vm
|
|
Conclusion :
V
(H2)
= 2 V
(O2)
|
- Quel est le rôle de l’acide sulfurique ?
- L’acide sulfurique permet de travailler avec une solution ionique.
- Elle contient des ions oxonium et des ions sulfate ce qui facilite l’électrolyse
et permet la circulation d’un courant de grande intensité.
- À partir de la mesure de
VC, déterminer la quantité de matière d’électrons échangés
pendant la durée
Δt.
- Valeur de
Δt
≈ 10 min.
- Calculer la quantité d’électricité
Q
ayant traversé l’électrolyseur pendant son fonctionnement.
-
En déduire la
valeur de l’intensité moyenne
I
du courant qui a traversé l’électrolyseur.
- Étude préliminaire : on peut dresser le tableau d’avancement de la réaction :
- Tableau d’avancement :
|
Équation
|
2 H2O
(ℓ)
|
=
|
2
H2
(g)
|
+
O2
(g)
|
|
état
|
Avancement
x (mol)
|
|
|
|
|
|
État
initial (mol)
|
0
|
n
|
|
0
|
0
|
|
Au
cours de la
transformation
|
x
|
n – 2 x
|
2 x = n (H2)
|
x
|
- On peut tirer la relation entre
n
(H2)
et n
(O2) :
n
(H2)
= 2 n
(O2)
- On peut calculer la quantité de matière du dihydrogène formé connaissant
le volume formé et le volume molaire.
- On peut calculer la quantité d’électricité à partir des relations
suivantes :
- Q =
n
(e
-) .
F
(1)
et
Q =
I .
Δt
(2)
- Pour déterminer
I, il faut connaître
Δt
et Q.
- Quantité d’électricité
Q ayant traversé l’électrolyseur
pendant son fonctionnement :
- Pour calculer
Q,
il faut utiliser la relation
(1).
Il faut connaître la quantité de matière d’électrons échangés.
- Pour connaître la relation entre
n
(H2)
et n(e
–),
il faut travailler avec la demi-équation électronique :
|
Équation
|
2
H
+(aq)
|
|
+ 2
e
–
|
=
|
H2
(g)
|
|
état
|
Avancement
x (mol)
|
|
|
|
|
|
État
initial (mol)
|
0
|
n
|
|
nG
|
0
|
|
Au
cours de la
transformation
|
x’
|
n
– 2
x’
|
n
G – 2 x’
|
x’
|
- Le générateur fournit les
électrons au fur et à mesure de l’électrolyse.
- On peut tirer la relation entre
n
(H2)
et n
(e
–) :
2 n
(H2)
= n
(e
–).
- Quantité de matière de dihydrogène formé :
- 
- Quantité de matière
n
(e
–)
d’électrons échangés :
- n
(e
–)
= 2
n
(H2)
- n
(e
–)
= 2
×
3,8
×
10 – 4
- n
(e
–)
≈ 7,6
×
10 - 4 mol
- Quantité d’électricité
Q ayant traversé l’électrolyseur
pendant son fonctionnement :
- Q =
n
(e
–) .
F
- Q =
7,6
×
10 - 4
×
96500
- Q
≈ 73 C
-
Valeur moyenne de l’intensité du courant
I dans le circuit :
- 
- En déduire les quantités de matière
nC et
nA de gaz obtenu respectivement à la cathode et à l’anode.
- À l’anode, il se produit un dégagement de dioxygène :
- À la cathode, il se produit un dégagement de dihydrogène :
- Au cours de l’expérience :
n
(H2)
= 2 n
(O2)
- Quantité de matière
nC :
- nC =
n
(H2)
≈ 3,8
×
10 – 4 mol
- Quantité de matière
nA :
- 
- Calculer la quantité de matière
nR de réactif ayant disparu.
- Volume molaire dans les conditions de l’expérience :
Vm
=
24 L / mol.
- Quantité de matière
n
R
de réactif ayant disparu.
H2O
- nR
= n (H2
O)
= n (H2) =
x'
≈ 3,8
×
10 – 4 mol
- L’acide sulfurique permet de travailler avec une solution ionique.
- Elle contient des ions oxonium et des ions sulfate ce qui facilite l’électrolyse
et permet la circulation d’un courant de grande intensité.
- On réalise ici l’électrolyse de l’eau.
- On décompose l’eau.






