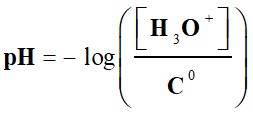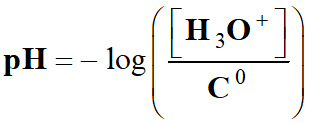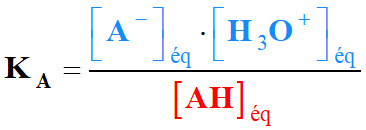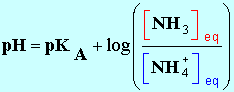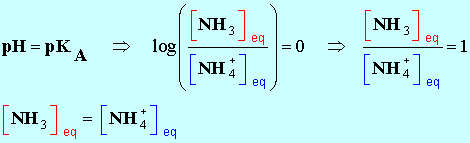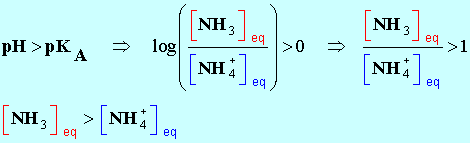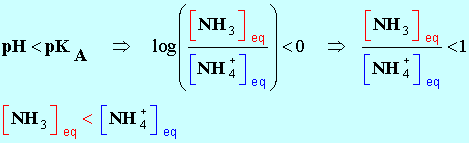|
Force des acides et des bases |
|
|
|
|
|
|
QCM N° 08
Force des acides
et des bases
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Selon
Bronsted, un acide est une espèce chimique
capable : |
De céder
au moins
un électron e– |
De céder
au moins
un ion
hydrogène H+ |
De céder
au moins
un ion
hydroxyde OH– |
B |
|
2 |
Le pH
d’une solution aqueuse est
défini par la
relation : |
|
|
|
A |
|
3 |
La constante
d’acidité d’un couple
AH
/ A– est associée à la réaction :
|
AH
(aq) +
H2O (ℓ)
H3O+
(aq) +
A–
(aq) |
H3O+
(aq) +
A–
(aq)
AH
(aq) +
H2O (ℓ) |
2H2O
(ℓ)
H3O+
(aq) + OH – (aq) |
A |
|
4 |
Si x =
log 10–3, alors : |
x
= 3 |
x
= - 3 |
x
= 0,001 |
B |
|
5 |
La dissolution
de acide nitrique
HNO3 (acide fort),
mène à une solution
contenant
principalement : |
Les ions nitrate
NO3–
(aq)
et les ions
oxonium
H3O+
(aq) |
L’acide nitrique
HNO3 |
L’acide nitrique,
les ions nitrate
les ions oxonium |
A |
|
6 |
Le taux
d’avancement final de la
transformation
entre un acide faible
et l’eau est : |
Supérieur
à 1 |
Inférieur
à 1 |
Égal
à 1 |
B |
|
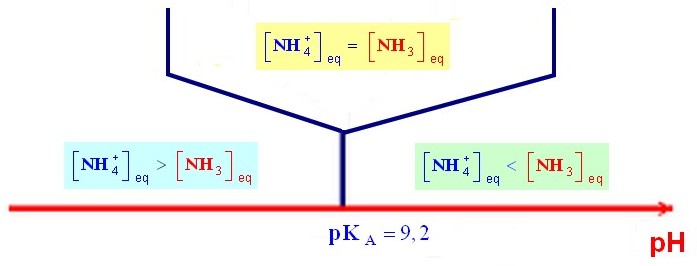
7 |
L’espèce
prédominante du couple
NH4+ / NH3 (pKA
= 9,2) dans une solution de
pH = 10,6 est : |
NH4+ |
NH3 |
Impossible à
déterminer |
B |
|
8 |
Plus le pKA
d’un acide / base
est petit :
|
Plus l’acide
du couple
est faible |
Plus la base
du couple
est forte |
Plus l’acide
du couple
est fort |
C |
|
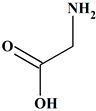
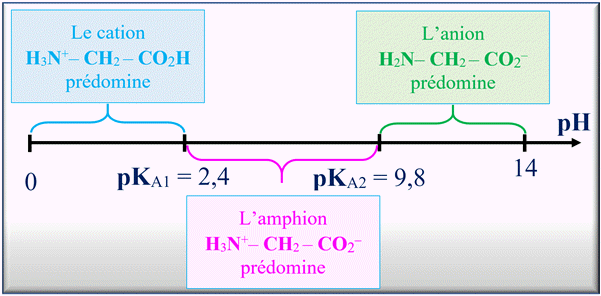
9 |
La formule
semi-développée de la base
dont l’acide est la glycine +H3N-CH2-COO- (un acide α-aminé) est : |
+H3N-CH2-COOH |
H2N-CH2-COOH |
H2N-CH2-COO- |
C |
|
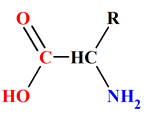
10 |
Un acide
α-aminé comporte : |
Un groupe
carbonyle |
Une fonction
acide
carboxylique et
une fonction
amine
portées sur
deux atomes
de carbone
différents |
Une fonction
acide
carboxylique et une fonction
amine portées sur
le même atome
de carbone |
C |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
AIDE
-
Un
acide
est une espèce chimique capable de céder au moins un
ion hydrogène H+.
-
L’acide
AH se transforme alors en sa base
conjuguée A–.
-
Écriture formelle :
|
AH
(aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
-
Une base est une espèce chimique
capable de capter au moins un ion hydrogène H+.
-
La base
A–
se transforme alors en son acide conjugué AH.
-
Écriture formelle :
|
A–
(aq) |
+ |
H+ |
→ |
AH
(aq) |
|
Base |
|
ion hydrogène |
|
Acide |
pH d’une solution :
-
Elle peut se déduire de la définition du pH d’une solution aqueuse
diluée :
-
Le pH d’une solution est un indicateur d’acidité lié à la présence des
ions oxonium H3O+ (aq) en solution.
|
Pour
une solution diluée, [H3O+]
< 0,050 mol . L–1, Le pH
est défini par la relation suivante :
Cette relation
est équivalente à :
|
|
pH :
grandeur sans unité |
|
[H3O+] : concentration en ions oxonium en mol . L–1 |
|
C0 :
concentration standard : C0 = 1,0 mol . L–1 |
-
La concentration des ions oxonium peut se déduire de la définition du
pH d’une solution aqueuse diluée :
-
Si pH = 7,0
-
[H3O+ ]éq
= C0 . 10–pH
-
[H3O+ ]éq
= 1,0 × 10– 7,0
-
[H3O+ ]éq
≈ 1,0 × 10–7 mol . L–1
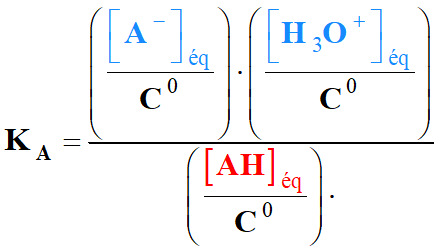
Constante d’acidité :
-
La constante d’acidité du couple acide / base AH (aq) / A–
(aq) est la constante d’équilibre associée à l’équation :
AH (aq) +
H2O (ℓ)
![]()