|
Stratégie en synthèse organique |
|
|
|
|
|
|
QCM N° 09
Stratégie en
synthèse organique.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
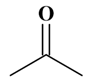
A |
B |
C |
R |
|
1 |
L’acétone est
un solvant
organique de
formule
C3H6O.
Sa formule
semi-développée est : |
|
|
|
C |
|
2 |
La formule
semi-développée
de l’acide
propanoïque est : |
|
|
|
AB |
|
3 |
La molécule
suivante
possède |
Un groupe
carboxyle |
Un groupe
hydroxyle |
Un groupe
carbonyle |
BC |
|
4 |
Un aldéhyde
possède : |
Un groupe
carbonyle sur
un carbone
en bout
de chaîne |
Un groupe
carboxyle sur
un carbone
en bout
de chaîne |
Un groupe
hydroxyle sur
un carbone
en bout
de chaîne |
A |
|
5 |
Le chauffage à
reflux est
utilisé lors de
l’étape de : |
transformation |
séparation |
purification |
A |
|
6 |
À quoi sert
l’étape
d’identification ? |
À faire
une CCM |
À vérifier
la nature
et la pureté
du produit |
À éliminer
les impuretés |
B |
|
7 |
Pour calculer le
rendement
expérimental
d’une
synthèse, il
faut : |
Que le
produit
obtenu
soit pur |
Faire un
bilan de
matière |
Que le
produit
soit solide |
AB |
|
8 |
On a synthétisé
40 mmol de
produit alors que
l’on attentait
théoriquement 50
mmol. |
Le
rendement
vaut 80. |
Le
rendement
vaut 0,80. |
Le
rendement
vaut 80 % |
BC |
|
9 |
Parmi les
réactions suivantes,
laquelle ou
lesquelles sont
des réactions
acide-base : |
HCO3–
(aq) +
CH2O2
(aq) →
H2CO3
(aq) +
CHO2–
(aq) |
2 C6H8O6
(aq) +
2 H2O (ℓ) →
2 C6H6O6
(aq) +
8 H+ (aq) +
O2 (g) |
Cu2+
(aq) +
Fe (s) →
Cu
(s) +
Fe2+ (aq) |
A |
|
10 |
Pour accélérer
l’évolution
d’une réaction
chimique,
on peut : |
Augmenter la
concentration
des réactifs |
Diminuer
la
température |
Diluer le
mélange
réactionnel |
A |
|
11 |
Un catalyseur :
|
Diminue la
durée d’une
réaction
chimique |
N’apparaît
pas dans
l’équation
de la
réaction |
Modifie
l’état final
du système
chimique |
AB |
|
12 |
On introduit dans
un bécher,
une lame de
d’argent, une
lame de plomb,
une solution
contenant des
ions argent
Ag+
et une solution
contenant des
ions Pb2+.
La réaction
susceptible de
Se produire est
un équilibre
chimique
d’équation : 2
Ag+ (aq) +
Pb
(s)
2
Ag (s) +
Pb2+
(aq)
Du plomb solide
Pb
(s)
est formé si :
|
Le quotient
de réaction
Qr
est
égal
à la
constante
d’équilibre
K
(T) |
Le quotient
de réaction
Qr
est
inférieur
à la
constante
d’équilibre
K
(T) |
Le quotient
de réaction
Qr
est
supérieur
à la
constante
d’équilibre
K
(T) |
C |
|
13 |
On introduit dans
un bécher,
une lame de
d’argent, une
lame de plomb,
une solution
contenant des
ions argent
Ag+
et une solution
contenant des
ions Pb2+.
La réaction
susceptible de
Se produire est
un équilibre
chimique
d’équation : 2
Ag+ (aq) +
Pb
(s)
2
Ag (s) +
Pb2+
(aq)
Pour augmenter la
valeur
du quotient de
réaction,
on peut : |
Augmenter
la masse
de la lame
d’argent |
Augmenter
la
concentration
en ion Pb2+
de la
solution |
Diluer la
solution
contenant
des ions
Pb2+ |
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Les différentes représentations d’une molécule
-
La formule brute :
-
Elle indique la nature et le nombre des atomes
constituant la molécule.
-
Elle ne donne aucune indication sur la
structure de la molécule : chaîne carbonée, groupe fonctionnel,…
-
Exemple :
-
C3H6O.
-
La formule développée plane.
-
Elle indique l’enchaînement des atomes et la
nature des liaisons qui les unissent.
-
Les liaisons sont représentées par des tirets
entre les symboles des atomes.
-
Exemple :
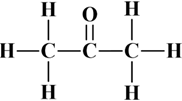
-
Formule semi-développée :
-
Elle dérive de la formule développée.
-
Les liaisons sont représentées par des tirets
entre les symboles des atomes excepté celles engagées par les atomes
d’hydrogène.
-
Elle fait apparaître la chaîne carbonée.
-
Elle ne fait pas apparaître les liaisons entre
un atome d’hydrogène et un autre atome.
-
Exemple :
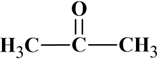 ou
ou 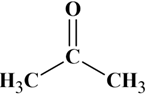
-
Formule topologique :
-
L’écriture topologique est une représentation
simple et rapide des molécules organiques.
-
Les atomes de
carbone et les atomes d’hydrogène
liés à ces atomes ne sont pas indiqués.
-
Les atomes d’hydrogène non
liés à des atomes de carbone sont indiqués.
-
Un
sommet correspond à un atome de carbone et aux atomes
d’hydrogène qui sont liés à l’atome de carbone.
-
Un
segment correspond à un doublet liant.
-
La
chaîne carbonée est
représentée en ligne brisée
-
Exemple :
-
Représentation 3D :
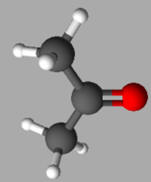
-
Cas de la question :
-
L’acétone ou propanone (ou propan-2-one) est
une cétone
|
Famille de composés |
aldéhyde |
cétone |
|
Suffixe |
al |
one |
|
Formule générale |
|
|
Composés carbonylés
-
Remarque : la molécule
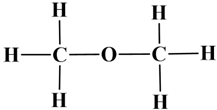
-
Formule brute :
C2H6O
-
Nom : méthoxyméthane
-
C’est un éther
-
Différentes familles :
|
Famille de composés |
alcool |
aldéhyde |
cétone |
acide carboxylique |
|
Suffixe |
ol |
al |
one |
oïque |
|
Formule générale |
R – OH |
|
|
|
Acide carboxylique :
|
Famille de
composés |
acide
carboxylique |
|
Suffixe |
oïque |
|
Formule générale |
|
-
Acide propanoïque :
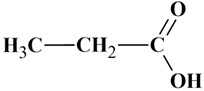
Ou
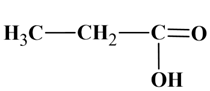
Ou
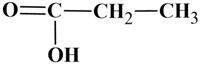
-
Autre formulation des acides
carboxyliques : RCOOH
-
Un acide
AH est une
substance capable de fournir des protons H+
en solution aqueuse
-
RCOOH =
RCOO– + H+
-
La fonction acide est
toujours en bout de chaîne.
-
Remarque la molécule
suivante :
![]()
-
Nom : 1-hydroxypropan-2-one
Groupes caractéristiques :
|
Groupe
caractéristique |
Famille
de composés |
Formule générale |
|
–OH Hydroxyle |
Alcool |
R – OH |
|
Carbonyle |
aldéhyde |
|
|
Cétone |
|
|
|
|
Acide
carboxylique |
|
-
Remarque :
-
La molécule :
![]()
-
Elle possède un groupe
hydroxyle – OH
et un groupe carbonyle
 .
.
-
Nom : 1-hydroxypropan-2-one
Fonction aldéhyde
-
La fonction aldéhyde est
toujours en bout de chaîne.
|
aldéhyde |
|
-
Autre écriture :
R – CHO.
-
La fonction cétone n’est
jamais en bout de chaîne.
Chauffage à reflux :
-
Le chauffage à reflux permet
de chauffer tout en évitant les pertes par évaporation.
-
Ce montage permet de
maintenir le milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant.
-
Les vapeurs sont condensées
dans le réfrigérant et retournent à l'état liquide dans le ballon.
-
Les réactifs et les produits
restent dans le milieu réactionnel.
-
Il permet d’accélérer la
réaction sans perte de matière.
-
Exemple de montage lors de la
synthèse de
l’acide benzoïque :
Identification d’un produit :
-
Elle permet l’identification
de l’espèce chimique obtenue et le contrôle de sa pureté.
-
Les étapes d’analyses
permettent de contrôler la pureté du produit synthétisé et de l’identifier à
partir de ses caractéristiques physiques.
-
Technique et matériel
utilisé :
-
Mesure de la température de
fusion pour les solides : Banc Kofler

-
Mesure de l’indice de
réfraction pour les liquides : Réfractomètre
-
Mesure de la température
d’ébullition : Thermomètre et colonne à distiller
-
Spectroscopie
IR
et RMN.
-
Chromatographie :
C.C.M.
Stratégie d'une synthèse et sélectivité
en chimie organique.
Le rendement d’une synthèse :
-
On appelle
rendement, noté η, de la synthèse, le quotient
de la quantité de produit
P effectivement obtenue
nP
par la quantité maximale attendue
nmax :
-
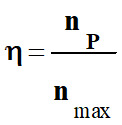
-
Le rendement est une grandeur
sans unité.
-
Il faut
exprimer nP
et nmax dans
la même unité (mol)
-
Le rendement peut s’exprimer
en pourcentage (%)
-
Si la synthèse du produit
demande plusieurs étapes, le rendement de la synthèse est égal au produit des
rendements de chaque étape.
-
Les raisons d’un rendement
faible :
-
La totalité du réactif
limitant n’a pas été consommée.
-
Le refroidissement n’a pas
permis à tout le solide de précipiter ;
-
Des pertes de produits ont eu
lieu lors des différentes manipulations ;
-
La réaction chimique n’est
pas totale,
-
Remarque :
-
Le rendement d’une réaction
est calculé par rapport au réactif limitant.
-
Dans le cas de la réaction
d’estérification, le fait de mettre l’un des réactifs en excès augmente le
rendement de la réaction.
-
Calcul du rendement :
-
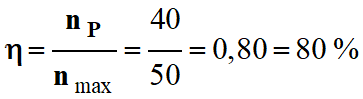
-
Le rendement est un nombre
qui n’a pas d’unité.
-
Il faut exprimer
np
et max dans la même unité.
-
On exprime souvent le
rendement sous forme de pourcentage.
Réaction acide-base :
-
Au cours d’une
réaction acide-base, l’acide d’un couple réagit avec la base d’un autre couple.
-
Une réaction
acido-basique consiste à un transfert d'un proton entre l’acide
A1H d’un
couple sur la base A2–
d’un autre couple.
-
Couple acide / base 1
: A1H ![]() H
+ +
A1–
H
+ +
A1–
-
Couple acide / base 2
: A2H ![]() H
+ +
A2–
H
+ +
A2–
-
Équation de la
réaction :
-
On se place dans le
cas où l’acide A1H
réagit sur la base A2–
A1H
+
A2–
![]() A1–
+
A2H
A1–
+
A2H
Autre cas
A1H
+
A2–
→
A1–
+
A2H
-
L’équation s’écrit
avec
-
une double flèche
![]() si
la réaction est non totale ;
si
la réaction est non totale ;
-
une
simple flèche →
si la réaction est totale.
-
La réaction
A est une réaction
acido-basique
-
Couples mis en jeu :
H2CO3
(aq) /
HCO3
–
(aq) et
CH2O2
(aq) /
CHO2–
(aq)
|
HCO3–
(aq) |
+ |
H+ |
|
H2CO3
(aq) |
+ |
|
(1) |
|
CH2O2
(aq) |
+ |
|
|
CHO2–
(aq)
|
+ |
H+ |
(2) |
|
HCO3–
(aq) |
+ |
CH2O2
(aq) |
→ |
H2CO3
(aq) |
+ |
CHO2–
(aq) |
(1) + (2) |
-
Acide formique (acide
méthanoïque )
CH2O2 :
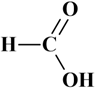
-
Ion formiate ( ion
méthanoate)
CHO2–
:
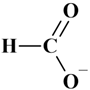
-
Acide carbonique
H2CO3 :
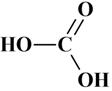 ou
(CO2,
H2O)
ou
(CO2,
H2O)
-
L’ion hydrogénocarbonate :
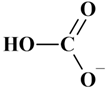
-
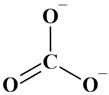
L’ion carbonate CO32–
: 
-
La réaction
B :
-
Problème :
il faut un oxydant d’un couple et un réducteur
d’un autre couple.
|
C6H8O6
(aq)
|
|
2
H2O
(ℓ)
|
|
? |
-
Couple
Ox /
Red :
C6H6O6
(aq) / C6H8O6
(aq) et O2
(g) /
H2O
(ℓ)
-
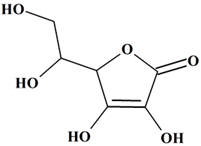
L’acide
ascorbique : (vitamine
C) ; Formule brute :
C6H8O6
-
5-(1,2-dihydroxyéthyl)-3,4-dihydroxyfuran-2(5H)-one
-
Acide déshydroascorbique :
-
Formule
brute : C6H6O6
-
5-(1,2-dihydroxyéthyl)oxolane-2,3,4-trione
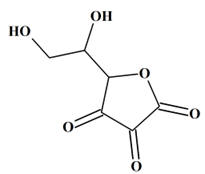
-
Demi-équation électronique :
-
Exemple de réaction :
|
C6H8O6
(aq)
|
|
I2
(aq)
+ 2
e–
|
|
C6H8O6
(aq) +
I2
(aq) →
C6H6O6 (aq) +
2 I–
(aq) + 2
H+
(aq) |
-
Couple
Ox /
Red :
C6H6O6
(aq) / C6H8O6
(aq) et I2
(aq) /
I–
(aq)
-
La réaction C est une
réaction d’oxydoréduction.
-
Couples
Ox /
Red :
Cu2+
(aq) / Cu
(s) et Fe2+
(aq) / Fe
(s)
|
Cu2+
(aq) + 2
e – |
|
Fe
(s)
|
|
Cu2+
(aq) + Fe (s) → Cu (s) +
Fe2+ (aq) |
Cinétique chimique :
-
L’étude de l’évolution
temporelle de systèmes chimiques constitue la cinétique chimique.
-
Certains paramètres agissent
sur la rapidité d’évolution d’un système chimique.
-
Ces paramètres sont appelés :
les facteurs cinétiques de la réaction.
-
De façon générale,
-
L’évolution d’un système
chimique est d’autant plus rapide que les concentrations des réactifs sont
élevées.
-
La température d’un mélange
réactionnel est un facteur cinétique.
-
De façon générale,
-
L’évolution d’un système
chimique est d’autant plus rapide que la température du mélange réactionnel est
élevée.
-
Ce résultat peut
s’interpréter à l’échelle microscopique.
-
Plus la température est
élevée, plus l’énergie cinétique des espèces chimiques sera importante.
-
Il découle de ceci que le
nombre de choc efficace entre les espèces chimiques augmente avec la
température.
-
Une augmentation de la
température permet à la transformation chimique de se produire plus vite
Les catalyseurs :
-
Dans certaines réactions, la
présence en faible quantité, d’une substance chimique spécifique, différente des
réactifs, peut accélérer l’évolution du système chimique.
-
De telles substances sont
appelées catalyseurs
-
Un catalyseur est une espèce
chimique qui accélère une réaction chimique.
-
La formule du catalyseur
n’apparaît pas dans l’équation de la réaction.
-
Un catalyseur modifie la
nature des étapes permettant de passer des réactifs aux produits.
-
La réaction globale lente est
remplacée par plusieurs réactions rapides.
-
Un catalyseur est spécifique
à une réaction chimique.
-
Un catalyseur permet d’éviter
certaines réactions parasites.
-
Il permet de travailler dans
des conditions de température et de pressions plus faibles.
-
Il peut permettre de diminuer
les coûts de production
Système chimique hors d’équilibre :
-
Tout système chimique, hors
d’équilibre, évolue spontanément vers un état d’équilibre.
-
À une
température donnée, la comparaison du quotient de réaction dans l’état initial,
Qr,i
à la constante d’équilibre
K
permet de prévoir le sens d’évolution spontanée du système chimique.
-
Considérons la réaction
suivante avec la terminologie associée :
|
|
|
|
Sens direct |
|
|
|
|
a A
(aq) |
+ |
b B
(aq) |
|
c C
(aq) |
+ |
d D
(aq) |
|
|
|
|
Sens inverse |
|
|
|
-
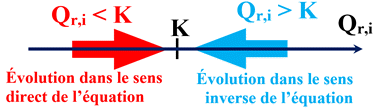
Premier cas :
-
Si le quotient
de réaction initial Qr,i
est égal à la constante d’équilibre
K,
-
soit
Qr,i
= K,
le système est déjà à l’équilibre.
-
Il n’évolue pas.
-
Deuxième cas :
-
Si le quotient
de réaction initial Qr,i
est inférieur à la constante d’équilibre
K,
-
soit
Qr,i
< K,
-
Le système chimique évolue
spontanément vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
-
Troisième cas :
-
Si le quotient
de réaction initial Qr,i
est supérieur à la constante d’équilibre
K,
-
soit
Qr,i
> K,
le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.
-
Remarque :
-
Ce critère d’évolution
permet de prévoir le sens d’évolution spontanée du système connaissant sa
composition initiale.
-
Ce critère ne tient
pas compte de l’aspect cinétique de la réaction.
-
Dans le cas présent :
|
|
|
|
Sens
direct |
|
|
|
|
2 Ag+
(aq) |
+ |
Pb
(s) |
|
2 Ag (s) |
+ |
Pb2+
(aq) |
|
|
|
|
Sens
inverse |
|
|
|
-
Comme il se forme du
Pb
(s) , le système évolue dans le sens
inverse.
-
Qr,i
> K,
le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.
Quotient de réaction :
-
Considérons la
réaction chimique non totale suivante :
a
. A
(aq)
+
b
. B
(aq)
![]() c
. C
(aq)
+ d
.
D
(aq)
c
. C
(aq)
+ d
.
D
(aq)
-
Par
définition, le quotient de réaction
Qr
de cette réaction s’écrit :
|
|
|
|
Qr |
Quotient de
réaction (sans unité) |
|
[C]
et
[D] |
Concentration des
produits (mol . L–1) |
|
[A]
et
[B] |
Concentration des
réactifs (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
-
Remarque :
-
Pour
simplifier l’expression, on omet de mettre la concentration standard
C0.
-
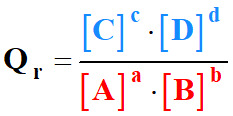
-
Mais,
il ne faut pas oublier que le
quotient de réaction est une grandeur
sans unité
qui caractérise un système chimique dans un état donné :
|
|
|
|
Sens direct |
|
|
|
|
2 Ag+
(aq) |
+ |
Pb
(s) |
|
2 Ag
(s) |
+ |
Pb2+
(aq) |
|
|
|
|
Sens inverse |
|
|
|
-
Les espèces chimiques
solides n’apparaissent pas dans l’expression du quotient de réaction :
-
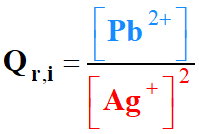
-
Si [Pb+2]
augmente, alors Qr,i
augmente
|
|