|
|
Struture des entités organiques Exercices |
|
|
|
|
1)- Exercice 04 page 130 : Déterminer la formule brute d’une molécule :
|
Déterminer la formule brute d’une molécule : Une molécule d’acide linoléique contient 18 atomes de carbone, 32 atomes d’hydrogène et
2 atomes
d’oxygène. -
Écrire la formule brute de cette molécule. |
|
Déterminer la formule brute d’une molécule : -
Nom : acide linoléique. -
Nombre d’ atomes de carbone : 18, -
Nombre d’ atomes d’hydrogène : 32 -
Nombre d’ atomes d’oxygène :2. -
Formule brute de cette molécule : -
C18H32O2 -
À partir du nom de la molécule, on peut affirmer : -
Que la molécule est linéaire (pas de ramification) -
Que l’on est en présence d’un acide carboxylique. -
Autre formulation : -
C17H31
–
COOH -
CH3
– (CH2)4 – CH = CH –
CH2
– CH = CH – (CH2)7 –
COOH -
Quelques acides gras : - Un acide gras est un acide carboxylique à chaîne linéaire, saturée ou non, possédant en général un nombre pair d'atomes de carbone, entre 4
et 22.
-
L’huile de lin est constituée en
majeure partie d’un mélange de triglycérides issus des acides gras
suivants : -
L’acide a-linolénique
(45 à 70 %) ; -
L’acide linoléique (12 à 24 %) ; -
L’acide oléique (10 à 21 %) ; -
On peut donner la formule semi-développée de l'acide
linoléique de cette molécule :
-
La formule topologique (E9-E12) :
-
La formule topologique (Z9-Z12) :
-
Molécule 3D :
|
2)- Exercice 06 page 130 : Écrire une formule semi-développée :
|
Écrire une formule semi-développée : La méthionine est un acide α–aminé essentiel, non synthétisé par
l’être humain, qui doit donc être fourni par l’alimentation. Un schéma de Lewis de la molécule de méthionine est représenté
ci-dessous.
-
Écrire la formule semi-développée de
la molécule de méthionine. |
|
Écrire une formule semi-développée :
-
Un schéma de Lewis de la molécule de
méthionine est représenté ci-dessous.
-
Formule semi-développée de la
molécule de méthionine :
-
Nom : acide
2-amino-4-(methylsulfanyl)butanoïque
-
Formule brute :
C5H11NO2S
-
Formule topologique :
-
Représentation 3D :
|
3)- Exercice 07 page 130 : Identifier des groupes caractéristiques :
|
Identifier des groupes caractéristiques : Parmi les molécules, dont les formules semi-développées sont représentées ci-dessous, identifier celles qui possède un groupe hydroxyle et celles qui possèdent un groupe carboxyle. Reporter les résultats dans un tableau. a.
Acide oxalique : b.
Acide 3–hydroxypropanoïque : c.
Sérine : d.
Glycérol : |
Identifier des groupes caractéristiques : a.
Acide oxalique : b.
Acide 3–hydroxypropanoïque :
c.
Sérine :
-
Acide 2-amino-3-hydroxypropanoïque. d.
Glycérol :
-
Propan-1,2,3- triol
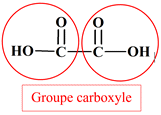
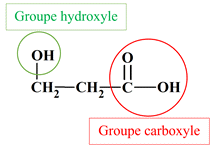
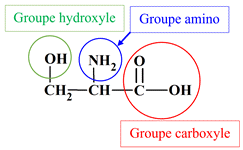
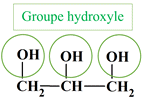
![]()
4)- Exercice 08 page 130 : Nommer des groupes caractéristiques :
|
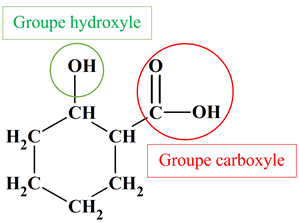
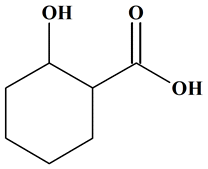
Nommer des groupes caractéristiques : Recopier la formule semi-développée de la molécule ci-dessous, puis entourer et nommer les groupes caractéristiques de cette
molécule.
|
Nommer des groupes caractéristiques :
-
Molécule d’acide
2-hydroxycyclohexane-1- carboxylique :
-
Cette molécule possède un groupe
hydroxyle – OH (fonction alcool)
-
Et un groupe carboxylique (fonction
acide carboxylique).
-
Formule brute : C7H12O3
-
Formule topologique :
-
Représentation 3D :
![]()
5)- Exercice 09 page 131: Identifier des familles de composés :
|
Identifier des familles de composés : Identifier la famille à laquelle appartiennent les molécules dont
les formules semi-développées sont représentées ci-dessous : a.
b.
H2C = O. c.
d.
|
|
Identifier des familles de composés : a.
Acide méthanoïque : acide formique
-
Famille des acides carboxyliques :
-
Groupe carboxyle :
-
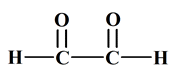
Formule brute : HCOOH
-
Formule topologique :
-
L'acide formique est présent dans la
composition de la majorité
des venins de fourmis (formica : un genre
de fourmis). b.
Méthanal : Formaldéhyde :
-
Groupe carbonyle :
-
Famille des aldéhydes :
-
Formule brute : H2CO. c.
Éthanol : alcool éthylique :
-
Famille des alcools :
R – OH
-
Groupe hydroxyle
-
Formule brute : CH3CH2OH
-
Formule semi-développée :
-
Formule topologique :
d.
Propanone : acétone.
-
Famille des cétones :
-
Groupe carbonyle :
-
Formule brute : C3H6O
-
Formule semi-développée :
-
Formule topologique :
- Représentation 3D :
ou
|
6)- Exercice 11 page 131 : Corriger des noms de molécules :
|
Corriger des noms de
molécules : Les formules semi-développées ci-dessous ont été associés à des
noms.
-
Corriger
si nécessaire ces noms en justifiant la réponse. a.
Butan-3-ol : b.
2-méthylpentan-2-ol : c.
Acide 3-propylpropanoïque : d.
3-méthylbutanal : e.
3-méthylpentan-2-one : f.
3-méthylpentan-4-one :
|
|
Corriger des noms de molécules : a.
Ce n’est pas le butan-3-ol.
-
On est en présence du butan-2-ol.
-
La chaîne carbonée est numérotée de
telle sorte que le numéro de l’atome fonctionnel soit le plus petit
possible.
-
Racine :
butan– :
4 atomes
de carbone
-
Suffixe : ol
(groupe
hydroxyle – OH
sur le carbone N° 2)
-
Préfixe : aucun :
pas de ramification
-
Nom : butan-2-ol. b.
Ce n’est pas le 2-méthylpentan-2-ol :
-
On est en présence du 4-méthylpentan-2-ol :
-
Racine :
pentan– : 5
atomes de carbone
-
Suffixe : ol
(groupe
hydroxyle sur le carbone N° 2)
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 4.
-
Nom : 4-méthylpentan-2-ol. c.
Ce n’est pas l’acide 3-propylpropanoïque :
-
Acide 2-méthylpentanoïque
-
Racine :
pentan– : 5
atomes de carbone (chaîne la plus longue)
-
Suffixe : oïque
(groupe
carboxyle :
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 2.
-
Nom : Acide 2-méthylpentanoïque. d.
C’est bien le 3-méthylbutanal.
-
Racine :
butan– :
4 atomes
de carbone
-
Suffixe : al
(groupe
carbonyle
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 3.
-
Nom : 3-méthylbutanal. e.
C’est bien la 3-méthylpentan-2-one :
-
Racine :
pentan– : 5
atomes de carbone (chaîne la plus longue)
-
Suffixe : one
(groupe
carbonyle
type cétone :
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 3.
-
Nom : 3-méthylpentan-2-one. f.
Ce n’est pas la
3-méthylpentan-4-one :
-
Racine :
pentan– : 5
atomes de carbone.
-
Suffixe : one
(groupe
carbonyle
type cétone :
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 3.
-
Nom : 3-méthylpentan-2-one. |
7)- Exercice 17 page 132 : Valider un procédé de synthèse :
|
Valider un procédé de synthèse : Le 2-méthylpropan-1-ol est une espèce chimique présente dans la composition des peintures. Il améliore la glisse du rouleau lors de
l’application de la peinture.
Une entreprise cherche à développer un procédé d’obtention du
2-méthylpropan-1-ol à partir de l’acide 2-méthylpropanoïque. À la fin de la transformation, un technicien réalise une analyse par spectroscopie infrarouge sur le produit obtenu. Le spectre infrarouge est donné
ci-dessous. 1.
À partir de leur formule semi-développée,
justifier le nom des deux espèces chimiques. 2.
L’entreprise peut-elle utiliser ce procédé
pour synthétiser le 2-méthylpropan-1-ol ?
-
Données :
-
Formules semi-développées :
-
2-méthylpropan-1-ol :
-
Acide 2-méthylpropanoïque :
-
Tableau :
-
Quelques spectres :
Groupe hydroxyle :
Groupe carbonyle :
Groupe carboxyle :
|
|
Valider un procédé de synthèse : 1.
Nom des deux espèces chimiques.
-
Le 2-méthylpropan-1-ol :
-
Racine :
propan– : 3
atomes de carbone.
-
Suffixe : ol
(groupe
hydroxyle – OH sur le carbone N° 1)
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 2.
-
L’acide 2-méthylpropanoïque :
-
Racine :
propan– : 3
atomes de carbone.
-
Suffixe : oïque
(groupe
carboxyle)
-
Préfixe : méthyl :
groupe méthyl– sur le carbone N° 2. 2.
Le procédé pour synthétiser le
2-méthylpropan-1-ol :
-
Exploitation du spectre
IR :
-
La bande d’absorption relative aux
liaisons – O – H se situe
autour du nombre d’onde σ ≈ 3000 cm–1.
-
Cette bande est caractéristique d’un
acide carboxylique.
-
La double liaison
C = O donne une bande fine et forte vers 1700 cm–1.
-
Cette bande n’apparaît pas pour les
alcools comme le 2-méthylpropan-1-ol.
-
Le spectre du produit obtenu n’est
pas celui d’un alcool, mais celui d’un acide carboxylique.
-
Le procédé utilisé ne permet pas
d’obtenir le 2-méthylpropan-1-ol.
-
Le spectre IR de l’acide
2-méthylpropanoïque.
-
Spectre
IR du
2-méthylpropan-1-ol :
-
La liaison O – H se manifeste
par une bande d’absorption forte et large de 3100 cm–1 à
3300 cm–1.
-
Les liaisons
Ctét – H
donnent une bande d’absorption forte de 2900 cm–1 à 3000
cm–1. |
8)- Exercice 18 page 133 : Réaliser un contrôle de qualité :
|
Réaliser un contrôle de qualité : L’acide glycolique est un solide utilisé en cosmétologie. Il peut
être extrait du « vesou » (liquide obtenu par broyage de la canne à
sucre et qui contient 0,10 % en masse d’acide glycolique) ou
synthétisé à partir du glyoxal.
-
Données :
-
Masse volumique de l’acide
glycolique : ρ = 1,49 g .
mL–1. - Bandes de vibrations infrarouges :
-
Tableau :
Groupe hydroxyle :
Groupe carbonyle :
Groupe carboxyle :
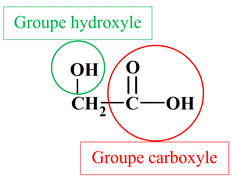
1.
Recopier la formule semi-développée de
l’acide glycolique puis entourer et nommer les groupes
caractéristiques présents. 2.
Vérifier la présence d’acide glycolique dans
le « vesou » (doc. A). 3.
Justifier le nom de chacune des espèces
chimiques présentes dans l’éluant (doc. A). 4.
Déterminer la masse de « vesou » nécessaire
pour obtenir 100 mL d’acide glycolique pur. 5.
Proposer un argument qui explique que les
industriels préfèrent la synthèse de l’acide glycolique à son
extraction. 6.
Un spectre infrarouge du produit synthétisé
est donné (doc. B). Justifier qu’il peut correspondre à l’acide
glycolique. A.
Chromatographie sur couche mince du
« vesou ».
-
Nature des dépôts :
-
Dépôt 1 : « vesou » ;
-
Dépôt 2 acide glycolique pur.
-
Éluant : acide éthanoïque (30 %) :
-
butan-1-ol (70 %) :
CH3 – CH2
– CH2
– CH2
– OH
-
CCM :
B.
Synthèse
de l’acide glycolique.
-
L’acide glycolique (a.) est
synthétisé à partir du glyoxal (b.) a.
Acide glycolique :
b.
Glyoxal :
-
Spectre infrarouge du produit
synthétisé : |
Réaliser un contrôle de qualité :
-
Bandes de vibrations infrarouges : 1.
Les groupes caractéristiques présents.
-
Acide glycolique :
-
Autre nom : acide hydroxyéthanoïque :
-
Glyoxal :
-
Autres noms : oxaldéhyde ;
éthanedial.
-
Formule topologique :
2.
Présence d’acide glycolique dans le
« vesou » (doc. A).
-
Étude de la C.C.M :
-
Nature des dépôts :
-
Dépôt 1 : « vesou » ;
-
Dépôt 2 : acide glycolique pur.
-
Le « vesou » est un mélange de
plusieurs espèces chimiques (3 taches distinctes).
-
On note la présence d’acide
glycolique :
-
Deux taches à la
même hauteur pour les dépôts
d’acide glycolique pur et de « vesou ») 3.
Nom de chacune des espèces chimiques
présentes dans l’éluant (doc. A).
-
Acide éthanoïque :
-
Racine :
éthan– : 2
atomes de carbone.
-
Suffixe : oïque
(groupe
carboxyle : )
-
Préfixe : aucun :
la molécule n’est pas ramifiée.
-
Butan-1-ol :
-
Racine :
butan– : 4
atomes de carbone.
-
Suffixe : ol
(groupe
hydroxyle : – OH sur l’atome de carbone N° 1 )
-
Préfixe : aucun :
la molécule n’est pas ramifiée. 4.
Masse de « vesou » nécessaire pour obtenir
100 mL d’acide glycolique pur.
-
« vesou » : liquide obtenu par
broyage de la canne à sucre et qui contient 0,10 % en masse d’acide glycolique.
-
Masse volumique de l’acide
glycolique : ρ = 1,49 g .
mL–1.
-
Masse
m de 100 mL d’acide
glycolique :
-
m =
ρ .
V
-
Or la masse
m représente 0,10 % de la
masse de vesou : m (vesou)
-
Relation :
-
-
Il faut traiter environ 150 kg de « vesou » pour
obtenir 100 mL d’acide glycolique pur. 5.
Argument qui explique que les industriels
préfèrent la synthèse de l’acide glycolique à son extraction.
-
Coût de fabrication.
-
Rendement insuffisant.
-
Déchets très importants, impact sur
l’environnement 6.
Étude du spectre infrarouge du produit
synthétisé.
-
Exploitation du spectre
IR :
-
La bande d’absorption relative aux
liaisons – O – H se situe
autour du nombre d’onde σ ≈ 3300 cm–1.
-
Cette bande est relative au groupe
hydroxyle – OH d’un alcool.
-
Cette bande est forte et large.
-
Cette bande se superpose à la bande
relative aux liaisons – O – H
qui se situe autour du nombre d’onde σ ≈ 3000 cm–1.
-
Cette bande est relative au groupe
hydroxyle – OH d’un acide
carboxylique)
-
La double liaison
C = O donne une bande fine et forte vers 1750 cm–1.
-
Ce spectre est en accord avec la
molécule d’acide glycolique qui comprend :
-
Un groupe hydroxyle et un groupe
carboxyle.
-
L’acide glycolique peut aussi être
obtenu à partir d’extrait de betterave et de raisin.
-
Grâce à son excellente capacité à
pénétrer la peau, l’acide glycolique est très utilisé dans les produits de
soins pour la peau,
le plus souvent dans les peelings (technique destinée à régénérer la peau
du visage).
-
L’acide glycolique permet d’améliorer
la texture et l’apparence de la peau.
-
Il peut rédui
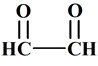 ou
ou
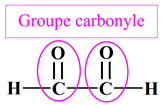

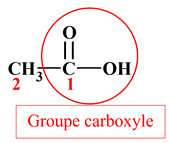
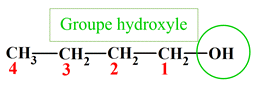

![]()
|
|