|
Chimie N° 02 |
Suivi temporel d'une réaction chimique. Cours. |
|
|
|
|
Programme 2012 : Temps et évolution chimique : Cinétique et catalyse. Programme 2012 : Physique et Chimie Programme 2020 : Physique et chimie |
|
QCM N° 01 et N° 02 |
Pour aller plus loin :
|
Mots clés : méthode chimique d'analyse ; dosage ; temps de demi-réaction ; absorbance d'une solution ; loi de Beer-Lambert ; ... |
I-
Méthode chimique d’analyse.![]()
- L’analyse est réalisée sur des échantillons prélevés au milieu réactionnel en évolution.
- On effectue des prélèvements (10 mL) dont le volume est faible devant celui du milieu réactionnel (200 mL).
- L’échantillon prélevé est plongé dans de l’eau glacée à la date t.
- On réalise la trempe de l’échantillon. Ceci permet de bloquer la réaction afin d’éviter l’évolution du système.
- On réalise un dosage afin de déterminer la concentration d’une espèce chimique (réactif ou produit).
- Le choix de la réaction de dosage est très important.
- Elle doit être rapide, unique et elle doit pouvoir facilement mettre en évidence l’équivalence du dosage.
2)- Dosage du diiode par iodométrie. (TP chimie N° 01). Réaction (2).
a)- Réalisation du dosage.
- Le diiode est un produit dans les réactions lentes :
- Entre l’eau oxygénée et l’ion iodure en milieu acide :
|
H2O2
(aq)
+
2
H
+(aq)
+ 2
I
–
(aq)
→
2
H2O |
|
Réaction lente |
- On réalise le dosage de I2 (aq) à l’instant t grâce à une solution titrée de thiosulfate de sodium.
- Réaction de dosage : elle fait intervenir les deux couples Ox / Red suivants :
- S4O6 2 – (aq) / S2O3 2 – (aq) et I2 (aq) / I – (aq)
|
2 S2O3
2
–
(aq)
= S4O6 2
– (aq) + 2
e –
|
|
I2
(aq) + 2
e –
= 2 I
–
(aq) |
|
2 S2O3 2
– (aq)
+ I2
(aq) →
S4O6 2
– (aq) + 2 I
– (aq) |
- La solution brune prend une teinte jaune-clair au fur et à mesure que l’on ajoute la solution de thiosulfate de sodium.
- Pour repérer l’équivalence, on utilise l’empois d’amidon qui donne à la solution une teinte bleue caractéristique.
- Repérage de l’équivalence :
- À l’équivalence, la solution devient incolore.
b)- Interprétation.
- On utilise une solution titrée de thiosulfate de sodium de concentration C2 = 4,0 × 10 – 2 mol / L.
- À l’équivalence, le volume de solution de thiosulfate de sodium est V2.
- Tableau d’avancement de la réaction.
|
Équation |
2 S2O32
–
(aq) |
+
I2
(aq)
|
→ |
2 I
–
(aq) + |
S4O62
–
(aq) |
|
|
état
|
Avancement
x
(mol) |
|
|
|
|
|
|
État initial
(mol) |
0 |
n (S2O32
–)
|
n (I2)
|
|
0 |
0 |
|
Au cours de la
transformation
|
x |
n (S2O32
–) –
2 x |
n (I2)
– x |
2 x |
x |
|
|
Avancement
max
Équivalence
|
xmax
|
n (S2O32
–) –
2 xmax
|
n (I2)
– xmax
|
2
xmax
|
xmax
|
|
|
|
0 |
0 |
|
2
xmax
|
xmax
|
|
- Relation à l’équivalence :
n
( S2O32
–) –
2 x
max
= 0 et
n
(I2) –
x
max = 0
- Cette relation permet de déterminer la quantité de matière de diiode présente dans le volume V0 à partir de la quantité de matière d’ions thiosulfate versé.
- On peut écrire :
- n versé ( S2O32 –) = 2 n (I2)
3)- étude cinétique de la réaction entre l’eau oxygénée et l’ion iodure. Réaction (1).
- A l’instant t = 0, 0 s, on verse un volume V3 = 100 mL d’une solution d’iodure de potassium de concentration C3 = 0,20 mol / L
- et un volume V1 = 100 mL d’une solution d’eau oxygénée de concentration C1 = 5,6 × 10 – 2 mol / L dans un erlenmeyer de 250 mL.
- Ne
pas oublier l’acide sulfurique
en excès (1 à 2 mL)
- Grâce à une burette graduée ou à une pipette jaugée, on prélève un volume V0 = 10 mL du mélange réactionnel.
- On verse le contenu de la pipette dans un erlenmeyer de 250 mL.
- On prépare un bécher contenant 50 mL d’eau glacée environ et quelques gouttes d’empois d’amidon.
- Au temps ti =…, on verse le contenu du bécher dans l’erlenmeyer pour arrêter la réaction.
- On dose ensuite le diiode formé à la date ti.
- Pour ce faire, on verse progressivement la solution de thiosulfate de sodium (Contenue dans la burette graduée) dans l’erlenmeyer.
- Une coloration bleu noir doit apparaître.
- On ajoute goutte à goutte le thiosulfate de sodium jusqu’à décoloration de la solution.
- On note le volume de solution de thiosulfate de sodium versé : V2 =
- En conséquence, la réaction de dosage permet de connaître la quantité de matière de diiode formé à la date ti dans l’échantillon prélevé.
- En utilisant les notations lors de la séance de TP Chimie N° 01 :
-

- On connaît le volume de l’échantillon (V0 = 10 mL).
- On peut en déduire la concentration de diiode présente dans le mélange réactionnel à la date ti.
- 
4)- Détermination de l’avancement x (t) de la réaction.
- Tableau d’avancement de la réaction :
|
Équation |
H2O2
(aq) |
+ 2 I–
(aq)
|
+ 2
H +(aq) |
→ |
I2
(aq) |
+ 2
H2O
(ℓ) |
|
|
état
|
Avanc.
x
(mol) |
|
|
|
|
nt
(I2) |
|
|
État initial (mmol) |
0 |
C1
. V1 5,6 |
C3
. V3
20 |
excès
|
|
0
|
|
|
Au cours de la
transformation
|
x
(t) |
5,6 – x
(t) |
20 – 2 x (t) |
|
x
(t) |
|
|
|
Avancement final (mmol) |
xf |
5,6 – xf
|
20 – 2 xf
|
|
xf
|
|
|
|
Avancement
max (mmol) |
xmax |
5,6 – xmax
|
20 – 2 xmax
|
|
|
xmax
|
|
|
0 mmol |
8,8 mmol |
|
|
5,6
mmol |
|
||
- À chaque instant t, dans le mélange réactionnel, la quantité de matière de diiode formé s’identifie avec l’avancement temporel de la réaction :
- nt (I2) =
x (t)
- Chaque échantillon est dosé par une solution titrée de thiosulfate de sodium.
- On peut calculer la quantité de matière de diiode présent dans l’échantillon et sa concentration :
-  et
et

- Connaissant le volume du mélange réactionnel, on peut en déduire la relation donnant l’avancement temporel x (t) de la réaction :
-

- ces expressions se rapportent à la réaction (1).
5)- Graphe de l’avancement temporel de la réaction (1) : x (t) = f (t).
- Tableau de valeurs :
|
Temps t min |
V2
en mL |
[I2] mol / L |
[H2O2]
mol / L |
x (t) |
|
0 |
0,00 |
0,0000 |
0,0280 |
0,0000 |
|
1 |
2,40 |
0,0048 |
0,0232 |
0,0010 |
|
2 |
4,40 |
0,0088 |
0,0192 |
0,0018 |
|
4 |
7,40 |
0,0148 |
0,0132 |
0,0030 |
|
6 |
8,90 |
0,0178 |
0,0102 |
0,0036 |
|
8 |
9,70 |
0,0194 |
0,0086 |
0,0039 |
|
10 |
10,30 |
0,0206 |
0,0074 |
0,0041 |
|
12 |
10,90 |
0,0218 |
0,0062 |
0,0044 |
|
14 |
11,20 |
0,0224 |
0,0056 |
0,0045 |
|
16 |
11,40 |
0,0228 |
0,0052 |
0,0046 |
|
18 |
11,60 |
0,0232 |
0,0048 |
0,0046 |
|
20 |
11,80 |
0,0236 |
0,0044 |
0,0047 |
|
24 |
11,90 |
0,0238 |
0,0042 |
0,0048 |
|
28 |
11,90 |
0,0238 |
0,0042 |
0,0048 |
|
32 |
12,00 |
0,0240 |
0,0040 |
0,0048 |
|
36 |
12,10 |
0,0242 |
0,0038 |
0,0048 |
|
40 |
12,20 |
0,0244 |
0,0036 |
0,0049 |
- Graphe 1 : x = f (t)
Cliquer sur l'image pour l'agrandir
- Graphe 2 : [ I2 ] = f (t)
Cliquer sur l'image pour l'agrandir
- Graphe 3 : [ H2O2 ] = f (t)
Cliquer sur l'image pour l'agrandir
|
Le temps de demi-réaction, noté t1/2, est la durée au bout de laquelle l’avancement de la réaction est égal à la moitié de sa valeur finale. |
- Le temps de demi-réaction fournit une échelle des temps caractéristique du système étudié.
|
- L’expérience montre qu’un système siège d’une réaction caractérisée par le temps de réaction t1/2 cesse pratiquement d’évoluer au bout d’une durée de l’ordre de quelques t1/2 (4 à 7 suivant la précision recherchée). - Le temps de demi-réaction permet d’évaluer la durée nécessaire à l’achèvement de la transformation chimique étudiée. |
1)- Mesure de l’absorbance d’une solution par spectrophotométrie. (TP Chimie N° 02).
a)- Principe.
- On utilise le fait que toute solution colorée absorbe la lumière visible (400 nm < λ < 800 nm).
- Lorsqu’un faisceau de lumière monochromatique traverse un milieu absorbant, l’intensité lumineuse I du faisceau transmis est inférieure à l’intensité lumineuse I0 du faisceau incident.
- Pour évaluer cette diminution, on utilise :
- La transmittance
T :
![]()
- L’absorbance
A :
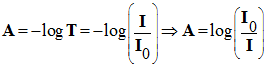
- La transmittance s’exprime en pourcentage.
- À une transmittance T de 100 % (T = 1) correspond une absorbance nulle, A = 0.
- à une transmittance de 1 % (T = 0,01) correspond une absorbance :
- A = log 100 = 2.
- Exemple de réaction : on peut utiliser cette méthode lorsqu’une espèce colorée se forme ou disparaît au cours de la réaction.
- (Réaction entre l’eau oxygénée et les ions iodure : il se forme du diiode qui est une espèce chimique colorée)
b)- Loi de Beer-Lambert.
|
Définition. - L’absorbance d’une solution diluée contenant une espèce colorée est proportionnelle à la concentration (effective) C de cette espèce et à l’épaisseur ℓ (cm) de la solution traversée par le faisceau lumineux. A (λ) = ε (λ) . ℓ . C |
- ε (λ) est appelé coefficient d’extinction molaire ou coefficient d’absorption molaire.
- Il dépend de la nature de l’espèce dissoute et de la longueur d’onde de la radiation utilisée.
- Il dépend également du solvant et de la température
- Unité : (mol –1.L.cm –1)
c)- Courbe d’étalonnage d’un spectrophotomètre.
- La courbe A = f (C) constitue la courbe d’étalonnage de la substance étudiée.
- Elle permet de déterminer la concentration d’une solution de la substance étudiée.
- Afin d’augmenter la sensibilité de la méthode, on utilise la longueur d’onde qui correspond au maximum d’absorption de la substance étudiée.
- Cette méthode est alors beaucoup plus précise que la méthode colorimétrique utilisant une échelle des teintes.
d)- Mode opératoire.
- On réalise le mélange réactionnel et on déclenche simultanément le chronomètre.
- On introduit le mélange dans la cuve du spectromètre et on démarre l’acquisition des données.
- On relève la valeur A de l’absorbance et celle du temps t correspondant.
- L’acquisition peut être assistée par ordinateur.
2)- Utilisation de la conductimétrie.
a)- Principe.
On mesure la conductance du milieu réactionnel en fonction du temps.
b)- Exemple :
- Hydrolyse du 2-chloro-2-méthylpropane : (CH3)3CCl ou
|
|
|
CH3 |
|
|
|
|
|
| |
|
|
|
CH3 |
− |
C |
− |
Cl |
|
|
|
| |
|
|
|
|
|
CH3 |
|
|
- On utilise la formule simple RCl pour le 2-chloro-2-méthylpropane.
- Équation de la réaction :
|
RCl (ℓ) +
H
2O
(ℓ) →
ROH
(aq)
+
H +(aq)
+
Cl
–
(aq) |
- La réaction produit des ions H+ (aq) et Cl – (aq) qui augmentent la conductivité du milieu réactionnel.
- L’évolution du système peut être suivie par conductimétrie.
III- Vitesse volumique de réaction.![]()
|
La vitesse volumique de réaction v (t) à la date t, est la dérivée par rapport au temps, - Du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel. - - Lorsque l’on travaille à volume constant, on obtient la relation suivante : - Relation :
- Avancement de la réaction : x : mol - volume du milieu réactionnel : V : L - Vitesse volumique de réaction : v (t) : mol / L / s |
- Remarque : examinons le cas de la réaction entre l’eau oxygénée et les ions iodure.
- La définition donne :
-
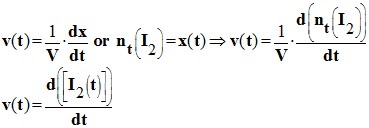
- La vitesse volumique de la réaction correspond à la dérivée par rapport au temps de la concentration en diiode par rapport au temps.
2)- Détermination graphique de la vitesse volumique.
- On travaille sur la réaction entre l’eau oxygénée et les ions iodure.
- Sachant que :
-
 ,
,
- on utilise le graphe [I2]t = f (t)
- (Exemple : TP Chimie N° 02)
- La vitesse volumique de la réaction à la date t1 est égale au coefficient directeur de la tangente à la courbe C au point M1 d’abscisse t1.
- Déterminer la vitesse volumique de réaction à t = 0 et à t = t1/2.
|
Détermination graphique de la vitesse volumique d'une réaction à un instant donné :
On trace les tangentes
à la courbe aux points considérés et on calcule la valeur du coefficient
directeur de chaque droite tracée. |
- Vitesse volumique de la réaction à
t
= 0 :
- Groupe 1 :
![graphe [I2]t = f (t)](images02/img8B.jpg)
Cliquer sur l'image pour
l'agrandir
|
Δ [I2] |
0,65 |
|||||
|
v (0) = |
|
≈ |
|
|
|
|
|
Δt |
5,5 |
|||||
|
v (0) ≈ 0,12 mmol / L / min |
||||||
- Vitesse volumique de la réaction à
t =
t1/2 :
- Groupe 1 :
Cliquer sur l'image pour l'agrandir
|
Δ [I2] |
0,70 |
|||||
|
v (t 1/2) = |
|
≈ |
|
|
|
|
|
Δt |
12 |
|||||
|
v (t 1/2) ≈ 5,8 × 10 – 2 mmol / L / min |
||||||
3)- Évolution de la vitesse en fonction du temps.
- La vitesse d’une transformation chimique est maximale à l’instant initial.
- Elle décroît ensuite et s’annule lorsque la réaction est terminée.
- Les réactifs sont consommés au fur et à mesure que la réaction se poursuit.
- Comme la concentration des réactifs est un facteur cinétique, la diminution de la concentration des réactifs entraîne la diminution de la vitesse.
- Elle s’annule si le réactif limitant à totalement disparue.