|
Cinétique chimique |
|
|
|
QCM N° 01 et 02 : Cinétique chimique.
AIDE |
|||||
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
La vitesse d’une réaction chimique : |
Augmente avec la concentration des réactifs |
Augmente avec la concentration des produits |
Est indépendante de la concentration des réactifs |
A |
|
2 |
Quelle affirmation est correcte ? |
La vitesse d’une réaction augmente généralement avec la température |
La vitesse d’une réaction diminue quand la température augmente |
La vitesse d’une réaction est indépendante de la concentration des réactifs |
A |
|
3 |
La trempe |
Consiste à rajouter de l’eau au milieu réactionnel |
Consiste à vaporiser le milieu réactionnel |
Désigne le refroidissement brutal du milieu réactionnel |
C |
|
4 |
Le temps de demi-réaction, noté t ½ est la durée au bout de laquelle : |
L’avancement de la réaction est égal à la moitié de l’avancement maximal |
L’avancement de la réaction est égal à la moitié de l’avancement final |
L’avancement de la réaction est égal à l’avancement final |
B |
|
5 |
Le suivi temporel d’une transformation à partir de dosages d’oxydoréduction est : |
Une méthode chimique |
Une méthode physique |
Une méthode biologique |
A |
|
6 |
Le suivi d’une transformation chimique par titrage est : |
Une méthode non destructrice |
Une méthode destructrice |
Adapté pour des échantillons de petite taille |
B |
|
7 |
Pour réaliser un dosage, on utilise : |
Une éprouvette graduée |
Une burette graduée |
Une fiole jaugée |
B |
|
8 |
Un spectrophotomètre mesure : |
L’absorption d’une solution |
La longueur d’onde d’une solution |
L’absorbance d’une solution |
C |
|
9 |
Le suivi temporel d’une transformation à l’aide d’un spectrophotomètre est : |
Une méthode chimique |
Une méthode physique |
Une méthode biologique |
B |
|
10 |
L’absorbance A d’une solution colorée de concentration C : |
Est proportionnelle à la concentration de la solution si celle-ci est suffisamment diluée |
Est donnée par la relation :
|
Dépend uniquement de la couleur de la solution |
A |
|
|
|
||||
|
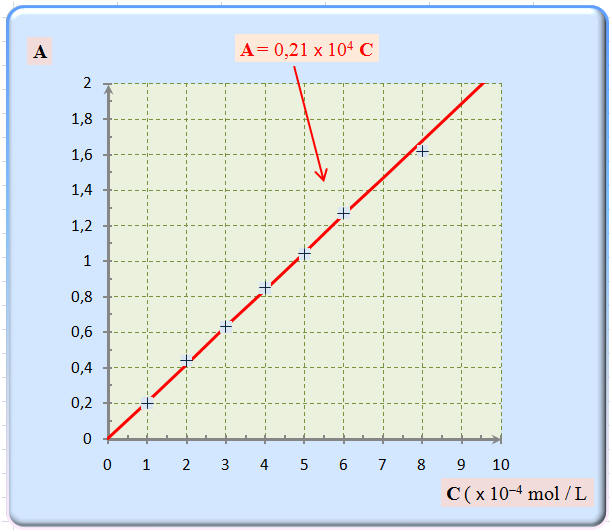
11 |
On étudie l’influence de la concentration C de la solution sur la valeur de l’absorbance A. Pour cela, on mesure l’absorbance A pour différentes solutions de permanganate de potassium à la longueur d’onde fixée (λ = 550 nm). On obtient le graphique ci-dessus. La Loi de Beer-Lambert est –elle vérifiée ? |
Pour toute concentration C ≤ 8,0 × 10 – 4 mol /L |
Pour toute concentration C ≤ 6,0 × 10 – 4 mol /L |
Pour toute concentration C ≥ 6,0 × 10 – 4 mol /L |
B |
|
12 |
Avec le spectrophotomètre, à la même longueur d’onde (λ = 550 nm), on mesure l’absorbance A d’une solution de permanganate de potassium de concentration C inconnue : A = 0 ,30. À l’aide du graphique précédent, on trouve que, la concentration : |
C ≈ 1,5 × 104 mol /L |
C ≈ 1,5 × 10– 4 mol /L |
C ≈ 1,5 × 10– 3 mol /L |
B |
|
|
|
||||
|
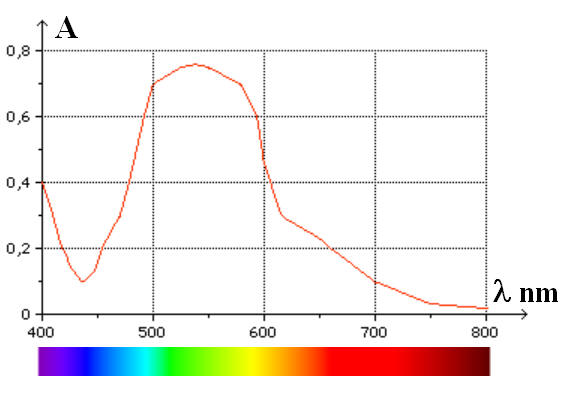
13 |
Avec un spectrophotomètre, on trace le spectre d’absorption d’une solution de permanganate de potassium. On obtient la courbe ci-dessus. La solution absorbe dans : |
Le bleu |
Le vert |
Le rouge |
B |
|
14 |
la solution précédente est : |
De couleur magenta |
Incolore |
De teinte cyan |
A |
|
15 |
Le spectre de la lumière blanche après le passage dans la solution précédente est : |
|
|
|
C |
|
16 |
La vitesse volumique de la réaction v (t) à la date t, |
Est la dérivée par rapport au temps de l’avancement x de la réaction. |
Est la dérivée par rapport au temps du rapport entre l’avancement x de la réaction et le volume V du milieu réactionnel |
Est égale au coefficient directeur de la tangente à la courbe x = f (t) à l’instant considéré |
B |
|
|
|
||||
|
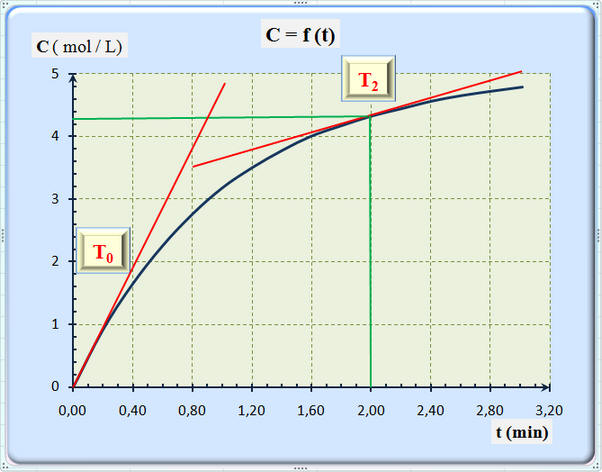
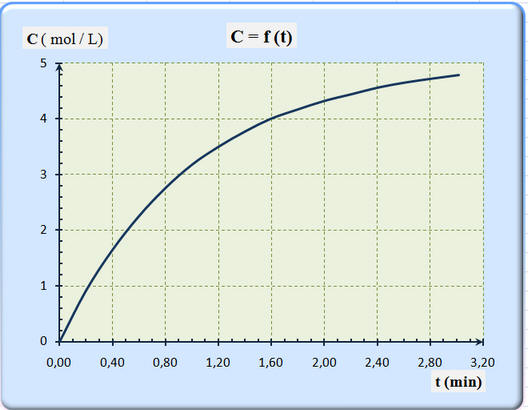
17 |
On donne ci-dessus la courbe représentant l’évolution de la concentration C d’un produit de la réaction en fonction du temps. La vitesse de la réaction étudiée à la date t peut s’écrire :
D’après la courbe, on peut dire que la vitesse initiale de la réaction : |
Est inférieure à la vitesse de la réaction à la date t = 2,0 min |
Est supérieure à la vitesse de la réaction à la date t = 2,0 min |
Est égale à la vitesse de la réaction à la date t = 2,0 min |
B |
|
|
|
||||
|
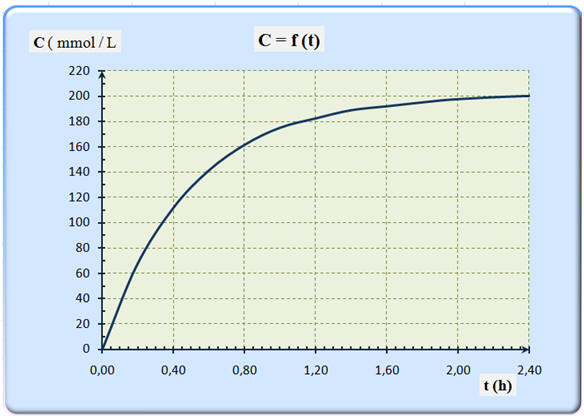
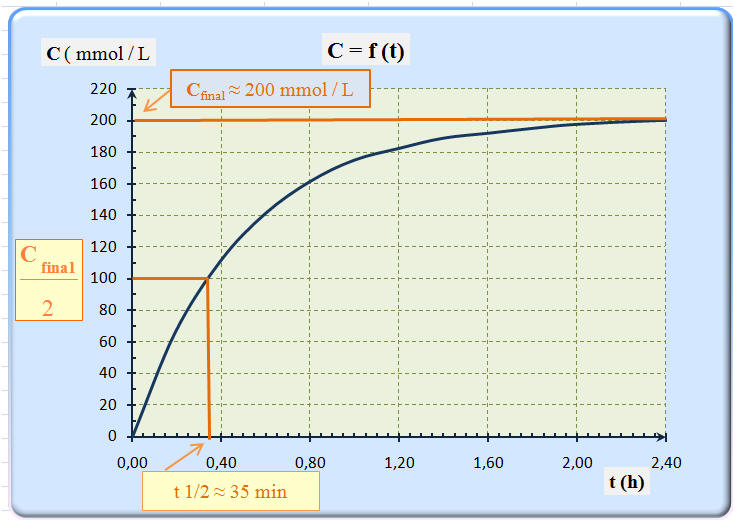
18 |
On donne ci-dessus la courbe d’évolution de la concentration C d’un produit de réaction en fonction du temps t. D’après la courbe, on peut dire que le temps de demi réaction t ½ : |
Est égal à 1 h 12 min |
Est égal à 35 min |
Est égal à 20 min |
|
-
On dit que la concentration des réactifs est un
facteur cinétique.
-
L’avancement temporel d’une réaction augmente
généralement avec la concentration des réactifs.
-
La température d’un mélange réactionnel est un
facteur cinétique.
-
L’avancement temporel d’une réaction augmente
généralement avec la température.
-
Elle désigne le refroidissement brutal d’un milieu
réactionnel pour le rendre cinétiquement inerte.
-
On utilise ce procédé lors de dosages en séances
de travaux pratiques pour arrêter la réaction à un instant donné
t.
-
Le temps de demi-réaction, noté t1/2,
est la durée au bout de laquelle l’avancement de la réaction est
égal à la moitié de sa valeur finale.
- Le temps de demi-réaction fournit une échelle des temps caractéristique du système étudié.
- L’expérience montre
qu’un système siège d’une réaction caractérisée par le temps de
réaction t1/2 cesse pratiquement d’évoluer au
bout d’une durée de l’ordre de quelques t1/2
(4 à 7 suivant la précision recherchée).
-
Le temps de demi-réaction permet d’évaluer la
durée nécessaire à l’achèvement de la transformation chimique
étudiée.
Suivi temporel par des Méthodes physiques.
-
Mesure de l’absorbance d’une solution par
spectrophotométrie.
-
On utilise le fait que toute solution colorée
absorbe la lumière visible (400 nm < λ < 800 nm).
-
Lorsqu’un faisceau de lumière monochromatique
traverse un milieu absorbant, l’intensité lumineuse I du
faisceau transmis est inférieure à l’intensité lumineuse I0
du faisceau incident.
-
Pour évaluer cette diminution, on utilise :
-
La transmittance T :
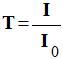
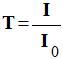
-
L’absorbance A :


Utilisation de la conductimétrie.
-
On mesure la conductance du milieu réactionnel en
fonction du temps.
-
Il faut que la conductivité du mélange réactionnel
varie au cours de la une réaction .
-
Exemple : hydrolyse du 2-chloro-2-méthylpropane :
(CH3)3–CCl ou
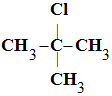
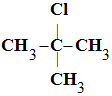
-
Équation de la réaction :
-
(CH3)3–CCl
(aq) + H2O (ℓ) → (CH3)3–COH
+ H+ (aq) + Cl–
(aq)
-
La réaction produit des ions H+
(aq) et Cl– (aq) qui augmentent la
conductivité du milieu réactionnel.
-
L’évolution du système peut être suivie par
conductimétrie.
Suivi temporel par une méthode chimique.
-
L’analyse est réalisée sur des échantillons
prélevés au milieu réactionnel en évolution.
-
On effectue des prélèvements (10 mL) dont le
volume est faible devant celui du milieu réactionnel (200 mL).
-
L’échantillon prélevé est plongé dans de l’eau
glacée à la date t.
-
On réalise la trempe de l’échantillon.
-
Ceci permet de bloquer la réaction afin d’éviter
l’évolution du système.
-
On réalise un dosage afin de déterminer la
concentration d’une espèce chimique (réactif ou produit).
-
Le choix de la réaction de dosage est très
important.
-
Elle doit être rapide, unique et elle doit pouvoir
facilement mettre en évidence l’équivalence du dosage.
-
Schéma du montage : dosage acido-basique ou dosage
d’oxydoréduction.
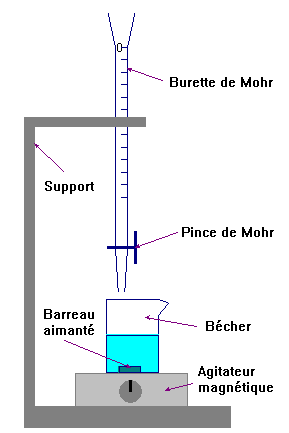

-
Le spectrophotomètre mesure de l’absorbance d’une
solution par spectrophotométrie.
-
Un système dispersif (prisme ou réseau) permet de
sélectionner une radiation lumineuse de longueur d’onde donnée.
-
Cette radiation est dirigée vers l’échantillon à
analyser.
-
Le flux lumineux transmis est mesuré et converti
en valeur d’absorbance.

-
Définition.
-
L’absorbance d’une solution diluée
contenant une espèce colorée est proportionnelle à la
concentration (effective) C de cette espèce et à
l’épaisseur ℓ (cm) de la solution traversée par le faisceau
lumineux.
-
A (λ) = ε (λ).ℓ.C
-
Cette relation n’est valable que pour les
solutions suffisamment diluées.
-
ε (λ) est appelé coefficient
d’extinction molaire ou coefficient d’absorption molaire. Il
dépend de la nature de l’espèce dissoute et de la longueur
d’onde de la radiation utilisée. Il dépend également du solvant
et de la température. (mol – 1.L.cm – 1).
-
Courbe d’étalonnage d’un spectrophotomètre.
-
La courbe A = f (C) constitue
la courbe d’étalonnage de la substance étudiée.
-
Elle permet de déterminer la concentration d’une
solution de la substance étudiée.
-
Afin d’augmenter la sensibilité de la méthode, on
utilise la longueur d’onde qui correspond au maximum
d’absorption de la substance étudiée.
-
Cette méthode est alors beaucoup plus précise que
la méthode colorimétrique utilisant une échelle des teintes.
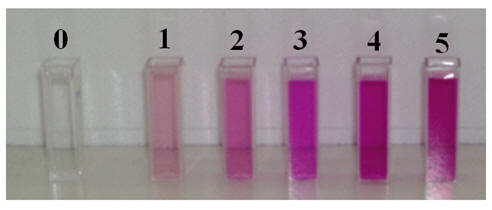
- Échelle des teintes : Cas d’une solution de permanganate de potassium
|
|
|||||
|
Solution N° 0 Eau distillée |
Solution N° 1 C1
= 1,0
× 10– 4 mol /L |
Solution N° 2 C2
= 2,0
× 10– 4 mol /L |
Solution N° 3 C3
= 3,0
× 10– 4 mol /L |
Solution N° 4 C4
= 4,0
× 10– 4 mol /L |
Solution N° 5 C5
= 5,0
× 10– 4 mol /L |
Exploitation du graphique de la loi de Beer-Lambert
- À l’aide de la courbe A = f (C), on peut déterminer la valeur de la concentration C d’une solution diluée grâce à la mesure de son absorbance.
- Synthèse additive :
- Couleur magenta :
Rouge + bleu → magenta

Vitesse volumique de réaction.
-
Définition.
-
La vitesse volumique de réaction v(t) à la
date t, est la dérivée par rapport au temps,
-
Du rapport entre l’avancement x de la
réaction et le volume V du milieu réactionnel.
-
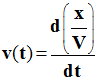
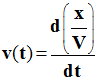
-
Lorsque l’on travaille à volume constant,
on obtient la relation suivante :
-
Relation :
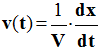
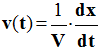
-
Détermination graphique de la vitesse volumique.
-
La vitesse volumique de la réaction à la date t
est proportionnelle à la valeur du coefficient directeur de la
tangente à la courbe x = f (t) au point
M d’abscisse t.
-
On trace la tangente à la courbe au point
considéré et on calcule la valeur du coefficient directeur de la
droite tracée.
-
À partir de la connaissance du volume réactionnel,
on en déduit la valeur de la vitesse.
Évolution de la vitesse en fonction du temps.
-
La vitesse d’une transformation chimique est
maximale à l’instant initial.
-
Elle décroît ensuite et s’annule lorsque la
réaction est terminée.
-
Les réactifs sont consommés au fur et à mesure que
la réaction se poursuit.
-
Comme la concentration des réactifs est un facteur
cinétique, la diminution de la concentration des réactifs
entraîne la diminution de la vitesse.
-
Elle s’annule si le réactif limitant à totalement
disparue.
-
Dans le cas étudié, la vitesse de la réaction, à
la date t, est égale à la valeur du coefficient directeur
de la tangente à la courbe C = f (t) à
cette date.
-
On trace les tangentes correspondantes à la courbe
C = f (t).
-
La valeur du coefficient directeur de la tangente
à la courbe C = f (t) est plus grande à
l’origine qu’à la date t = 2,0 min.
-
La vitesse initiale de la réaction est plus grande
à l’instant initial qu’à la date t = 2,0 min.
|
|
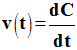 .
.