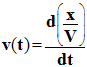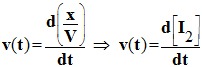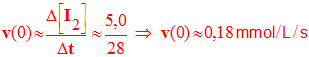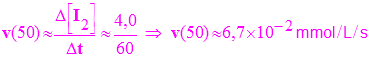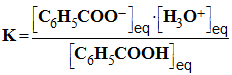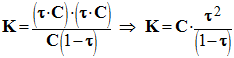|
Exercice III |
Correction |
I- Oxydation des ions iodure et pH d’une solution. (6 pts)
|
1)- Oxydation des ions iodure par les ions peroxodisulfate (2,5 pts).
La réaction entre les ions iodure
I – (aq) et les
ions peroxodisulfate S2O82 – (aq)
est une réaction lente dont
l’équation s’écrit :
S2O82
–
(aq) +
2 I – (aq)
→
I2 (aq)
+ 2 SO42 – (aq)
Les ions sont incolores et I2 (aq) a une
teinte jaune – orangé en milieu aqueux. a)- Proposer une méthode chimique et une méthode physique permettant de suivre l’évolution de cette réaction au cours du temps. - méthode chimique et une méthode physique - Méthode chimique : on dose le diiode formé par une solution de thiosulfate de sodium. - Pour arrêter la réaction à une date donnée, on réalise la trempe. - Méthode physique : - On utilise un spectrophotomètre pour suivre l’évolution de la réaction. - On mesure l’absorbance du mélange réactionnel en fonction du temps. - La loi de Beer-Lambert permet de connaître les variations de la concentration en diiode au cours du temps. Lors d’une étude cinétique, on a déterminé, à différents instants, la concentration en diiode [ I2 ] du mélange réactionnel.
Les résultats sont rassemblés dans
le tableau suivant.
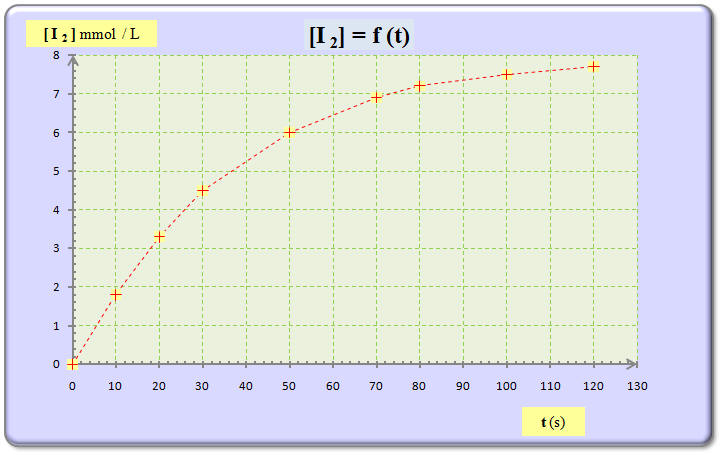
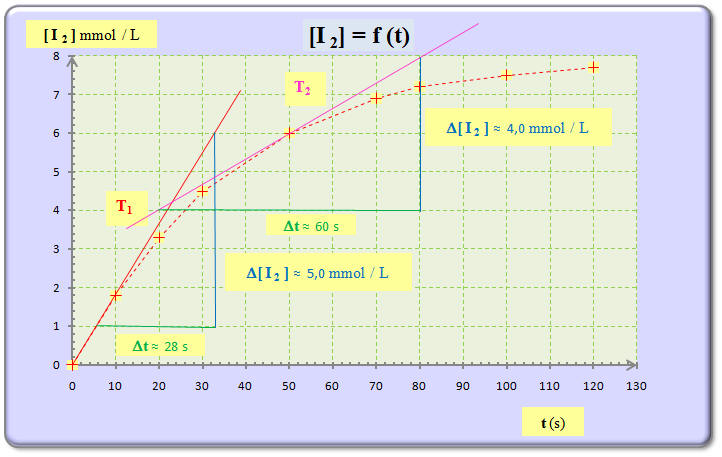
b)- Tracer la courbe représentative de l’évolution de la concentration en diiode [I2] du mélange réactionnel en fonction du temps. - Courbe [I2] = f (t). Échelles : 1 cm ↔ 10 s et 2 cm ↔ 1 mmol / L. c)- Définir la vitesse volumique de réaction v.
d)- Relier la vitesse volumique de réaction v à la concentration en diiode [I2] du mélange réactionnel. |
Tableau d’avancement :
|
Équation |
S2 O82
–
(aq) |
+ 2
I –
(aq) |
→ |
I2
(aq) |
+ 2 SO42 – (aq) |
|
|
état |
Avanc.
|
|
|
|
nt (I2) |
|
|
État initial (mol) |
0 |
n1 |
n2 |
|
0 |
0 |
|
Au cours de latrans |
x (t) |
n1
– x (t) |
n2
– 2 x (t) |
x
(t) |
2 x
(t) |
|
C6H5COOH
(aq) +
H2O (ℓ)
=
C6H5COO – (aq)
+ H3O + (aq)
|
Équation |
C6H5COOH
(aq) + |
H2O
(ℓ)
|
= |
C6H5COO–
(aq)
|
+ H3O + (aq) |
|
|
état |
Avanc
x
(mol) |
|
|
|
|
|
|
État ini (mol) |
0 |
n |
excès |
|
0 |
ε |
|
Au cours de la
trans |
x |
n – x |
excès |
x |
x
+ ε |
|
|
Avancement
final |
xf |
n – xf |
excès |
xf |
xf +
ε
≈
xf |
|
|
Avancement
maximal |
xmax |
n – xmax =
0 |
excès |
|
xmax |
xmax +
ε
≈
xmax |
|
c)- Déterminer une expression de K, constante d’équilibre de la réaction, ne faisant intervenir que la concentration molaire C de la solution d’acide benzoïque et le taux d’avancement final τ de la réaction. (0,75) - L’eau est le solvant, il est en large excès. - L’acide benzoïque est le réactif limitant. - Expression de K :
d)- Que représente cette constante l’équilibre K ? - Cette constante K = KA est la constante d’acidité de l’acide benzoïque. - Cette constante d’équilibre K représente la valeur du quotient de réaction à l’équilibre.
On donne la valeur de la constante de la réaction étudiée :
K = 6,4
× 10 – 5 à 25 °
C. e)- Calculer le taux d’avancement final τ de la réaction. Justifier. - Taux d’avancement de la réaction :
- - Le tableau d’avancement de la réaction permet d’écrire :
-
- En combinant (2) et (3) :
-
- En combinant (3) et (4) :
- - En combinant (1), (3’) et (5) :
-
- Cette constante d’équilibre K représente la valeur du quotient de réaction à l’équilibre. - taux d’avancement final τ de la réaction : - De la relation (6), on tire : C. τ 2 + K . τ – K = 0. - En remplaçant les lettres par leur valeur respective : - 5,0 × 10 – 3 τ 2 + 6,4 × 10 – 5 τ – 6,4 × 10 – 5 = 0 - Cette équation du second degré admet deux solutions : - τ1 ≈ 0,11 et τ2 ≈ – 0,12 - Or 0 ≤ τ ≤ 1, en conséquence, la bonne solution est τ1 ≈ 0,11
f)- Calculer l’avancement final
xf
et l’avancement volumique final
- Avancement final : - xf = τ . n - xf = τ . C . V
- xf
≈ 0,11
× 5,0
× 10 – 3
× 2,00
- xf ≈ 1,1 × 10 – 3 mol - Avancement volumique final :
- g)- En déduire la valeur du pH de la solution d’acide benzoïque. Justifier. - Valeur du pH de la solution :
- pH =
– log [H3O
+] or
- pH = – log [H3O +] ≈ – log (5,5 × 10 – 4) - pH ≈ 3,3 |