|
1)- Oxydation des
ions iodure par les ions peroxodisulfate (2,5 pts).
La réaction entre les ions iodure
I – (aq) et les
ions peroxodisulfate S2
O82 – (aq)
est une réaction lente dont
l’équation s’écrit :
S2 O82
–
(aq) +
2 I – (aq)
→
I2 (aq)
+ 2 SO42 – (aq)
Les ions sont incolores et I2 (aq) a une
teinte jaune – orangé en milieu aqueux.
a)- Proposer une méthode chimique et une
méthode physique permettant de suivre
l’évolution de cette réaction au
cours du temps.
Lors d’une étude cinétique, on a déterminé, à différents instants, la
concentration
en diiode [I2] du mélange réactionnel.
Les résultats sont rassemblés dans
le tableau suivant.
|
t
(s)
|
0
|
10
|
20
|
30
|
50
|
70
|
80
|
100
|
120
|
|
[ I2
]
mmol / L
|
0
|
1,8
|
3,3
|
4,5
|
6,0
|
6,9
|
7,2
|
7,5
|
7,7
|
b)- Tracer la courbe représentative de
l’évolution de la concentration en diiode
[I2] du
mélange réactionnel en fonction du temps.
Échelles : 1 cm
↔
10 s et 2 cm
↔ 1
mmol / L.
c)- Définir la vitesse volumique de réaction
v.
d)- Relier la vitesse volumique de réaction
v à la concentration en diiode
[ I2 ] du
mélange réactionnel.
e)- Déterminer la valeur de la vitesse :
- À
l’instant t = 0 s,
- À
l’instant t = 50 s.
f)- Commenter l’évolution de la vitesse au
cours du temps.

2)- pH d’une
solution d’acide benzoïque (3,5 pts)
|
Données :
|
|
Acide benzoïque / ion benzoate :
|
C6H5COOH
/ C6H5COO –
|
|
Masse molaire de
l’acide benzoïque :
|
M
= 122 g / mol
|
On prépare une solution d’acide benzoïque en dissolvant une masse
m =
1,22 g
d’acide benzoïque (solide blanc) dans de l’eau distillée.
On obtient un volume V =
2,00 L de solution.
a)- Déterminer la valeur de la concentration
molaire C de la solution d’acide benzoïque obtenue.
b)- Écrire l’équation de la réaction entre
l’acide benzoïque et l’eau et dresser le
tableau d’avancement de la
réaction.
c)- Déterminer une expression de
K,
constante d’équilibre de la réaction, ne faisant intervenir que la
concentration molaire C
de la solution d’acide benzoïque et
le
taux d’avancement final
τ de la réaction. (0,75)
d)- Que représente cette constante
l’équilibre K ?
On donne la valeur de la constante de la réaction étudiée :
K = 6,4
× 10 – 5 à 25 °
C.
e)- Calculer le taux d’avancement final
τ
de la réaction. Justifier.
f)- Calculer l’avancement final
xf
et l’avancement volumique final
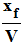 de
la réaction. de
la réaction.
g)- En déduire la valeur du pH
de la
solution d’acide benzoïque. Justifier.
|
![]()
![]()