|
Réaction
d'estérification
Cours en relation avec le TP |
|
|
|
Matériel : burette graduée (25 mL), éprouvettes graduées, bain-marie, chronomètre, 15 tubes à essais avec bouchon.
Produits : soude CB = 5 mol / L environ, butan-1-ol, acide éthanoïque, phénolphtaléine.
Données :
|
|
M
g / mol |
densité |
Degré de
pureté |
|
|
Acide éthanoïque
CH3COOH |
60,05 |
1,05 |
99,5 % |
pKA = 4,8 |
|
Butan-1-ol
CH3CH2CH2CH2OH |
74,12 |
0,810 |
99,5 % |
|
La densité
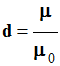 avec
m0 = 1,00 g /
mL
avec
m0 = 1,00 g /
mL
I.
La réaction d’estérification.
-
La réaction d’estérification est la
réaction d’un acide carboxylique sur un alcool. Elle donne un ester et
de l’eau.
1)-
Vérification de la concentration de la
solution de soude.
-
La solution de soude a une concentration
voisine de CB = 5 mol / L.
-
Le but de cette manipulation est de
déterminer la valeur de sa concentration plus précisément et de réaliser
un dosage acido-basique.
![]() Dans un bécher verser :
Dans un bécher verser :
-
50 mL d’eau distillée
-
Un volume VA = 5,75 mL
d’acide éthanoïque(ou 6,04 g d’acide éthanoïque)
-
Ajouter quelques gouttes de
phénolphtaléine (indicateur coloré).
![]() Dans la burette graduée :
Dans la burette graduée :
-
Remplir la burette graduée de la solution
titrée de soude jusqu’au zéro de la graduation.
![]() Dosage :
Dosage :
-
Verser la solution de soude dans le
bécher jusqu’au virage de l’indicateur coloré.
-
On peut faire un dosage rapide, puis un
dosage plus précis.
-
Noter le volume de solution de soude
versé à l’équivalence V2 =
2)-
Réaction d’estérification :
a)-
Préparation du mélange.
![]() Dans un bécher de
250 mL, mélanger :
Dans un bécher de
250 mL, mélanger :
-
Un volume V3 = 92,0 mL de
butan-1-ol ou une masse m3 = 74,52 g.
-
Un volume V4 = 57,5 mL d’acide
éthanoïque pur ou une masse m4 = 60,4 g.
b)-
Remplissage des tubes à essais.
-
Mettre le mélange dans une burette
graduée et remplir les 15 tubes à essais de 10 mL de mélange.
-
On prend un tube à essais que l’on note
A
et on le met à part.
c)-
Ajout du catalyseur.
-
On ajoute une goutte d’acide sulfurique
concentré dans 14 tubes à essais que l’on bouche.
-
On prend un tube à essais que l’on note
B
et on le met à part.
d)-
La durée.
-
On place 12 tubes à essais au bain-marie
et on déclenche le chronomètre.
- On note la température du bain-marie : θ = … ° C
1)-
Dosage de l’acide éthanoïque restant.
![]() Préparer un bécher contenant 50 mL d’eau
glacée.
Préparer un bécher contenant 50 mL d’eau
glacée.
-
A la date t = 2 min, 4 min, …….
-
Verser le contenu d’un tube à essais dans
le bécher.
-
Ajouter 3 gouttes de phénolphtaléine.
-
Doser l’acide éthanoïque restant et noter
le volume de soude versée dans le tableau.
|
Temps
en min |
Volume
de
soude
versée |
Acide
éthanoïque
restant
dans
un tube à
essais |
Ester formé
dans
un tube
à essais |
Acide
éthanoïque
restant
ramené
à une mole |
Ester formé
ramené
une mole |
|
t
min |
VB
en mL |
nA
en mol |
nE
en mol |
n'A
en mol |
n'E
en mol |
|
0 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
25 |
|
|
|
|
|
|
30 |
|
|
|
|
|
|
35 |
|
|
|
|
|
|
40 |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
50 |
|
|
|
|
|
|
60 |
|
|
|
|
|
|
70 |
|
|
|
|
|
|
80 |
|
|
|
|
|
|
90 |
|
|
|
|
|
|
100 |
|
|
|
|
|
|
120 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tube
A |
VB
= |
|
Température :
70 °C |
|
|
|
Tube
B |
VB
= |
|
|
|
|
|
|
|
|||
1)-
Vérification de la concentration de la
solution de soude.
-
Volume de solution de soude versé à
l’équivalence V2 =
-
Déterminer la valeur de concentration
CB de la solution de soude servant pour le titrage.
2)-
Le dosage de l’acide éthanoïque restant.
![]() Déterminer les quantités de matière
d’acide éthanoïque et de butan-1-ol introduits initialement dans
l’erlenmeyer. Commenter.
Déterminer les quantités de matière
d’acide éthanoïque et de butan-1-ol introduits initialement dans
l’erlenmeyer. Commenter.
-
Pourquoi réalise-t-on la trempe du
mélange avant le dosage ?
-
Déterminer la quantité de matière n0A
d’acide éthanoïque initialement présent dans chaque tube à essais
-
Donner l’expression littérale permettant
de calculer la quantité de matière nA d’acide
éthanoïque présent à la date t en fonction de CB
et VB.
-
En déduire la relation donnant la
quantité de matière nE d’ester formé à la date t.
-
Compléter le tableau.
-
Déterminer le taux limite
d’estérification sachant qu’il s’exprime par le rapport
![]() .
.
- En déduire le
rendement de la réaction.
-
Quel est le rôle des tubes A et B ?
Commenter le résultat obtenu.
-
Exploitation des mesures.
-
Tracer la courbe nA =
f (t) et nE = g (t)
-
Donner les caractéristiques de chaque
courbe obtenue. En déduire les caractéristiques de la réaction étudiée.
-
Donner la formule semi-développée de
chaque molécule et indiquer la classe de l’alcool utilisé.
-
Mettre en évidence chacune des fonctions
organiques rencontrées.
-
Comment appelle-t-on la réaction inverse
de la réaction d’estérification ?
-
Comment peut-on augmenter la vitesse de
la réaction d’estérification ou d’hydrolyse ?
-
Donner
le nom d’un catalyseur de la réaction. Modifie-t-il la limite
d’estérification ?
-
Comment peut-on améliorer le rendement de
la réaction ?
|
QCM
: Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
Réponse |
|
1 |
Un
catalyseur a une action sur : |
Sur la cinétique
de la
réaction |
Sur l’état final
de la
réaction |
Sur les deux |
A |
|
2 |
Le rendement de la réaction d’estérification d’un alcool primaire est : |
33% |
67% |
5% |
B |
|
3 |
La réaction d’hydrolyse d’un ester est : |
totale |
lente |
limitée |
B et C |
|
4 |
La
réaction d’estérification est : |
exothermique |
endothermique |
athermique |
C |