|
|
|
Estérification et Hydrolyse Cours TP en relation avec le cours |
|
|
|
I- Étude expérimentale. Exploitation du TP chimie N° 9.
1)-
Vérification de la concentration de la solution
de soude.
►
Équation bilan de la réaction de
dosage :
-
Cette réaction fait intervenir une base forte, la
soude et un acide faible, l’acide éthanoïque :
CH3COOH
+ OH– →
CH3COO–
+
H2O

-
Constante d’équilibre de la réaction :
-

-
La réaction est
quasi-totale car KR > 104
►
Quantité de matière d’acide
éthanoïque utilisé : nA
-
Masse molaire de l’acide éthanoïque :
MA
= 60,05 mol . L–1
-
On a utilisé un volume
VA =
5,75 mL d’acide éthanoïque à 99,5%
et de densité d1 = 1,05
-
Masse de solution utilisée :
-
m =
V1 .
m
-
m =
V1 .
m0
. d1
-
Masse d’acide éthanoïque présent :
-
mA =
m .
P1%
-
mA =
V1 .
m0
. d1 .
P1%
-
Quantité de matière d’acide éthanoïque :
-
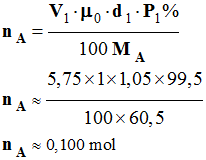
-
À l’équivalence, les réactifs ont été mélangés dans les
proportions stœchiométriques.
-
En conséquence :
- 
-
Volume de solution de soude versé à l’équivalence
V2 = 20,5 mL
-
Valeur de concentration CB de la
solution de soude servant pour le titrage.
-
Application numérique :
-

-
À l'équivalence, l'espèce majoritaire est
CH3COO –
(base faible) et pH > 7.
-
Le domaine de virage de l'hélianthine se situe
au-dessous de pH = 7,
-
Le domaine de virage de de la phénolphtaléine est
au-dessus de pH = 7.
2)-
Le dosage de l’acide éthanoïque restant.
-
Quantité de matière d’acide éthanoïque
initialement présent dans l’erlenmeyer :
-

-
Application numérique :
-

-
Quantité de matière de butan-1-ol initialement
présent dans l’erlenmeyer :
-

-
Application numérique :
-

- On a réalisé un mélange équimolaire d’alcool et d’acide carboxylique.
- Les réactifs sont dans les proportions stœchiométriques.
-
On effectue la trempe pour stopper la réaction
d’estérification en agissant sur la température du milieu réactionnel qui est un
facteur cinétique.
-
Quantité d’acide éthanoïque initialement présent
dans un tube à essais :
-
Volume total de la solution :
-
V =
V3 +
V4
-
V ≈ 57,5 + 92,0
-
V ≈ 149,5 mL
-
Il y a 10 mL de solution dans chaque tube
à essais :
-

-
Quantité de matière d’acide éthanoïque présente à
la date t :
-
nA =
CA .
VA
-
Quantité de matière d’ester formée au temps t :
|
|
RCOOH |
+ |
R’OH |
→ |
RCOOR’ |
+ |
H2O |
|
t
= 0 s |
n0A |
|
n0A |
|
0 |
|
0 |
|
t
> 0 s |
nA = n0A
–
nE |
|
nA = n0A
–
nE |
|
nE |
|
nE |
-
Tableau :
|
Temps
en min |
Volume
de
soude
versée |
acide éthanoïque
restant
dans un tube
à essais |
Ester formé
dans
un tube à essais |
acide éthanoïque
restant
ramené
à une mole |
Ester formé
ramené
à une mole |
|
t min |
VB
en mL |
nA
en mol |
nE
en mol |
n'A
en mol |
n'E
en mol |
|
0 |
13.70 |
0.067 |
0.0000 |
1.003 |
0.000 |
|
2 |
13.00 |
0.063 |
0.003 |
0.948 |
0.052 |
|
4 |
12.35 |
0.060 |
0.007 |
0.901 |
0.099 |
|
6 |
11.75 |
0.057 |
0.010 |
0.857 |
0.143 |
|
8 |
11.20 |
0.055 |
0.012 |
0.817 |
0.183 |
|
10 |
10.70 |
0.052 |
0.015 |
0.781 |
0.219 |
|
15 |
9.55 |
0.047 |
0.020 |
0.697 |
0.303 |
|
20 |
8.65 |
0.042 |
0.025 |
0.631 |
0.369 |
|
25 |
7.90 |
0.039 |
0.028 |
0.576 |
0.424 |
|
30 |
7.30 |
0.036 |
0.031 |
0.533 |
0.467 |
|
35 |
6.80 |
0.033 |
0.034 |
0.496 |
0.504 |
|
40 |
6.40 |
0.031 |
0.036 |
0.467 |
0.533 |
|
45 |
6.10 |
0.030 |
0.037 |
0.445 |
0.555 |
|
50 |
5.80 |
0.028 |
0.039 |
0.423 |
0.577 |
|
60 |
5.40 |
0.026 |
0.041 |
0.394 |
0.606 |
|
70 |
5.10 |
0.025 |
0.042 |
0.372 |
0.628 |
|
80 |
4.90 |
0.024 |
0.043 |
0.357 |
0.643 |
|
90 |
4.80 |
0.023 |
0.043 |
0.350 |
0.650 |
|
100 |
4.70 |
0.023 |
0.044 |
0.343 |
0.657 |
|
120 |
4.60 |
0.022 |
0.044 |
0.336 |
0.666 |
|
|
|
|
|
|
|
|
|
Tube A |
VB = 13,2
mL |
|
Température :
70 °C |
|
|
|
Tube B |
VB = 7,8
mL |
|
|
|
|
|
|
|
|
||
-
Taux d’estérification : le taux limite
d’estérification est donné par la relation
-

-
Rendement de la réaction
-

-
ρ ≈ 67 %
![]() La réaction est donc limitée, il y a coexistence
dans la même solution des réactifs et des produits.
La réaction est donc limitée, il y a coexistence
dans la même solution des réactifs et des produits.
![]() Le
système n’évoluant plus dans le temps, cet état est caractéristique d’un
équilibre chimique.
Le
système n’évoluant plus dans le temps, cet état est caractéristique d’un
équilibre chimique.
-
Rôle des tubes
A et
B :
-
les tubes
A et
B ont été laissés à la température
ambiante.
-
Le tube
B contient en outre de l’acide
sulfurique.
-
Tube
A : 
-
Tube
B :
-
À température ambiante, la réaction
d’estérification est très lente.
-
L’acide sulfurique est un catalyseur de la
réaction d’estérification.
-
Les courbes nA =
f (t)
et nE =
g (t)
-
nA =
f (t) est
une fonction décroissante du temps et nE =
g (t)
est une fonction croissante du temps.
-
La réaction d’estérification étant limitée, il
existe une réaction inverse qui est la réaction d’hydrolyse d’un ester.
-
C’est aussi une réaction limitée.
-
Donner les caractéristiques de chaque courbe
obtenue. En déduire les caractéristiques de la réaction étudiée.
-
Formule semi-développée de chaque molécule et
classe de l’alcool utilisé :
-
Cette réaction fait intervenir l’acide éthanoïque
et le butan-1-ol qui est un alcool primaire.
-
Acide éthanoïque :
CH3 –
COOH
-
Butan-1-ol :
CH3
– CH2 – CH2 – CH2 – OH
Alcool primaire.
-
Fonctions organiques rencontrées :
-
Fonction acide carboxylique :
-
Fonction alcool :
-
Réaction d’estérification et réaction
d’hydrolyse :
|
|
|
|
|
Estérification |
|
|
|
|
|
RCOOH |
+ |
R’OH |
1 →
← 2 |
RCOOR’ |
+ |
H2O |
|
|
|
|
|
Hydrolyse |
|
|
|
|
t
= 0 s |
1 |
|
1 |
|
0 |
|
0 |
|
t
> 0 s |
0,33 mol |
|
0,33 |
|
0,67 |
|
0,67 |
-
Augmentation la vitesse de la réaction
d’estérification ou d’hydrolyse :
-
Pour augmenter la vitesse de la réaction, on peut
augmenter la température du milieu réactionnel et utiliser un catalyseur.
-
Le catalyseur agit aussi bien sur la vitesse de
la réaction d’estérification ou d’hydrolyse.
-
Il n‘agit pas sur la limite de la réaction.
-
Le catalyseur utilisé ici est l’acide sulfurique
en conséquence les ions H3O+.
-
Le catalyseur ne modifie pas la limite
d’estérification.
-
Amélioration le rendement de la réaction :
-
Pour améliorer le rendement de la réaction, il
faut déplacer l’équilibre dans le sens 1 ou 2.
-
Pour déplacer l’équilibre dans le sens 1, on peut
utiliser un excès d’acide ou d’alcool.
-
Pour déplacer l’équilibre dans le sens 2, on peut
utiliser un excès d’eau.
|
QCM :
Pour
chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
Réponse |
|
1 |
Un catalyseur a uneaction sur : |
Sur la
cinétique
de la réaction |
Sur l’état final
de la réaction |
Sur les deux |
A |
|
2 |
Le rendement de
la réaction
d’estérification d’un alcool
primaire est : |
33% |
67% |
5% |
B |
|
3 |
La réaction
d’hydrolyse d’un ester est : |
totale |
lente |
limitée |
B
et C |
|
4 |
La réaction
d’estérification est : |
exothermique |
endothermique |
athermique |
C |
II- Les caractéristiques de la réaction d'estérification et de la réaction d'hydrolyse.
La réaction d'estérification est une
réaction lente, limitée et athermique.
Il en est de
même de la réaction d'hydrolyse.
III- Estérification et hydrolyse : l'équilibre chimique.
- Les réactions d'estérification et d'hydrolyse sont des réactions inverses se produisant dans les mêmes conditions expérimentales.
- L'état final obtenu est le même que l'on parte d'un mélange équimolaire d'acide et d'alcool ou d'ester et d'eau.
- Dans l'état final, les proportions des différents composés n'évoluent plus au cours du temps.
- On est en présence d'un état d'équilibre.
- C'est un équilibre chimique dynamique.
- Les vitesses des deux réactions inverses sont égales et annulent ainsi leurs effets.
|
|
|
|
|
Estérification |
|
|
|
|
|
RCOOH |
+ |
R’OH |
1 →
←
2 |
RCOOR’ |
+ |
H2O |
|
|
|
|
|
Hydrolyse |
|
|
|
2)- Le déplacement de l'équilibre.
a)- Influence de la quantité de réactifs.
-
Un apport d’acide ou d’alcool déplace l’équilibre dans le sens de
l’estérification.
-
Le rendement de l’estérification est d’autant plus important que
l’acide soit en excès par rapport à l’alcool ou inversement.
-
Si l’acide est en excès par rapport à l’alcool, c’est l’alcool qui
limite la réaction.
-
Exemple : on mélange 5 moles
d’acide avec 1 mole d’un alcool primaire.
-
Calculer le rendement de la réaction.
|
|
|
|
|
Estérification |
|
|
|
|
|
RCOOH |
+ |
R’OH |
1 →
←
2 |
RCOOR’ |
+ |
H2O |
|
|
|
|
|
Hydrolyse |
|
|
|
|
t = 0 s |
1 |
|
5 |
|
0 |
|
0 |
|
Équilibre |
1 – n |
|
5 – n |
|
n |
|
n |
-
En conséquence :
-

-
Il faut résoudre une équation du second degré :
-
On trouve
n ≈ 0,94
-
On améliore le rendement de l’hydrolyse en ajoutant un excès d’eau
(moins cher que l’ester).
b)- Autre façon d'améliorer le rendement de l'estérification.
-
Extraction de l’ester au fur et à mesure de sa formation.
-
Cette méthode est possible si la température d’ébullition de l’ester
est nettement plus faible que celle de l’eau, de l’alcool et de l’acide
présent.
-
Exemple : méthanol 65 °C, acide méthanoïque 101 °C, ester obtenu
méthanoate de méthyle 31,5 °C.
-
Dans ce cas, on peut extraire l’ester par distillation.
-
Élimination de l’eau : cette méthode est souvent délicate.
-
On peut ajouter un produit avide d’eau.
3)- Influence de la nature des réactifs.
-
Le rendement de l’estérification dépend de la classe de
l’alcool utilisé. Pour des mélanges équimolaires, le rendement est de :
-
67 % pour un alcool primaire
-
60 % pour un alcool secondaire
-
5 % pour un alcool tertiaire.
4)- Influence de la température et du catalyseur.
- Pour que l’équilibre soit atteint plus rapidement, il est nécessaire de chauffer pour augmenter la vitesse de la réaction
- (aussi bien
l’estérification que l’hydrolyse) et d’utiliser un catalyseur : l’acide
sulfurique.
-
Ceci ne modifie pas l’état d’équilibre.
|
|
|
|