|
QCM N° 14 |
Synthèse d'espèces chimiques |
|
QCM N° 14
Synthèse d'une espèce chimique.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). Énoncé A B C R 1 Lors d’une synthèse chimique : Un seul réactif peut être
présent Il peut se former plusieurs
produits Il se forme une seule espèce
chimique AB 2 Lorsqu’on chauffe à reflux un
mélange réactionnel : La transformation est accélérée Les vapeurs formées se
condensent Un calalyseur est nécessaire AB 3 Pour accélérer une réaction
chimique : On peut ajouter un catalyseur On peut chauffer le mélange
réactionnel On doit condenser les vapeurs
formées AB 4 Le schéma du montage à reflux
peut être : A 5 Dans un réfrigérant à eau : L’eau circule de bas en haut L’eau circule de haut en bas Le sens de circulation de l’eau
est indifférent A 6 À la fin de la synthèse,
l’espèce chimique obtenue : Est toujours pure Peut être mélangée à d’autres
espèces Est extraite du mélange
réactionnel BC 7 Pour isoler l’espèce chimique
synthétisée, on effectue :
Une séparation Une identification Une chromatographie sur couche
mince A 8 Pour récupérer une espèce
chimique solide, on effectue : Une décantation Une filtration Une hydrodistillation B 9 La chromatographie
ci-dessous permet
d’affirmer que : L’un des réactifs est encore
présent dans la solution de produit obtenu Des impuretés sont présentes
dans le produit synthétisé Le produit synthétisé est pur B 10 Par rapport au chauffage
classique, le montage à reflux permet : D’augmenter la température
d’ébullition du milieu réactionnel De ne pas répandre dans
l’atmosphère les vapeurs formées De purifier les espèces formées B 11 Dans ce même montage
à reflux, le réfrigérant à
eau permet :
D’éliminer les impuretés D’abaisser la température du
mélange à l’intérieur du ballon De condenser les vapeurs
formées C 12 Après une synthèse, on réalise
parfois une chromatographie sur couche mince. Cette
technique permet : De purifier le produit
synthétisé De vérifier la présence et la
pureté de l’espèce synthétisée D’isoler l’espèce s ynthétisée
du mélange réactionnel B 13
Après la synthèse de l’acétate
d’isoamyle à partir de l’alcool
isoamylique, on
réalise une
chromatographie sur couche
mince. On
dépose :
En C, de l’acétate d’isoamyle
pur
En A, de l’alcool isoamylique
En S, le produit synthétisé
En F, un sucre, le fructose
En B, un extrait de banane.
Après élution et révélation,
on obtient le
chromatogramme suivant : Le produit synthétisé contient
encore de l’alcool isoamylique L’extrait de banane contient du
fructose Le produit synthétisé est
vraisemblablement de l’acétate d’isoamyle pur BC
![]()



►
Le chauffage à reflux :
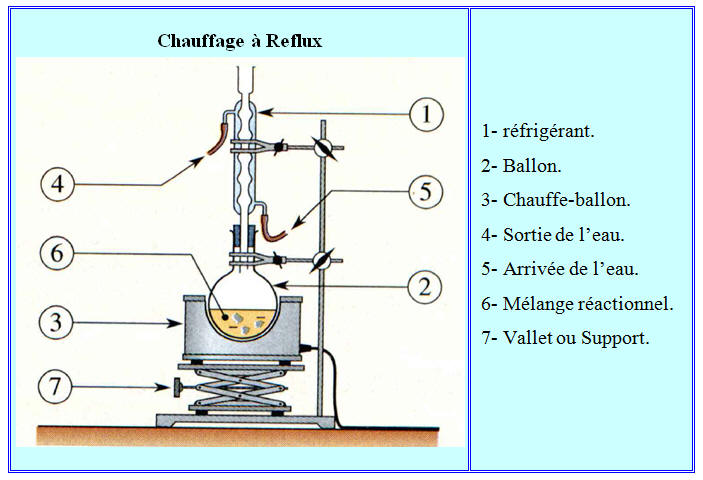
L'eau arrive (5), monte dans le réfrigérant, le remplit en sort (4)
-
Ce montage permet de maintenir le
milieu réactionnel à une température constante, en l'occurrence
pratiquement la température d'ébullition du solvant.
-
Les vapeurs sont condensées dans
le réfrigérant et retournent à l'état liquide dans le ballon.
-
On évite ainsi la perte de
matière.
-
Les réactifs et les produits
restent dans le milieu réactionnel.
- La présence du vallet est obligatoire.
- Elle permet d’enlever le chauffe-ballon sans
toucher au reste du montage (ballon et réfrigérant).
-
Ainsi, on peut rapidement
refroidir le mélange réactionnel si un problème survient et (ou)
lorsque la réaction est terminée.
-
Dans le réfrigérant, l’eau
circule du bas vers le haut.
►
À la fin de la synthèse, on
refroidit le milieu réactionnel pour :
-
Des raisons de
sécurité (pour éviter les brûlures)
-
Condenser les vapeurs
éventuellement toxiques.
-
Faire précipiter le produit s’il
est solide.
►
Méthodes d’extraction :
►
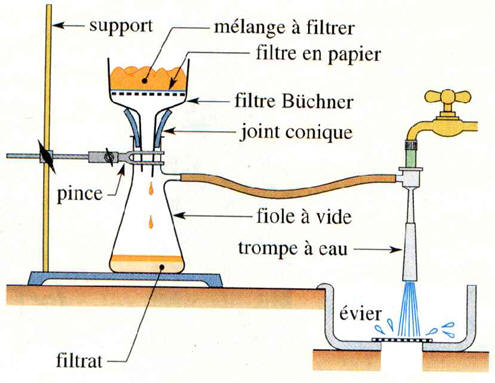
Filtration solide/liquide :
-
Filtration simple :

-
Filtration sous vide :
►
Filtration solide/liquide :
-
Elle permet de séparer un solide
d’un liquide dans lequel il est insoluble.
►
Filtration solide/liquide :
-
Lors d’une extraction
liquide/liquide :
-
L’espèce chimique à extraire est
plus soluble dans le solvant extracteur que dans le solvant de
départ.
-
Et le solvant extracteur et le
solvant de départ sont non miscibles.
►
L’extraction liquide/liquide.
-
Lors d’une extraction
liquide/liquide :
-
L’espèce chimique à extraire est
plus soluble dans le solvant extracteur que dans le solvant de
départ.
-
Et le solvant extracteur et le
solvant de départ sont non miscibles.
-
Pour extraire une espèce dissoute
dans un solvant S1, on utilise un autre
solvant S2, non miscible avec
S1,
dans lequel l’espèce chimique est nettement plus soluble.
-
L’extraction par un solvant
consiste à dissoudre l’espèce chimique recherchée dans un
solvant non miscible avec l’eau et à séparer les deux phases
obtenues.
-
L’extraction par un solvant se
réalise dans une ampoule à décanter.
-
Le choix du solvant dépend de
l’espèce chimique recherchée.
-
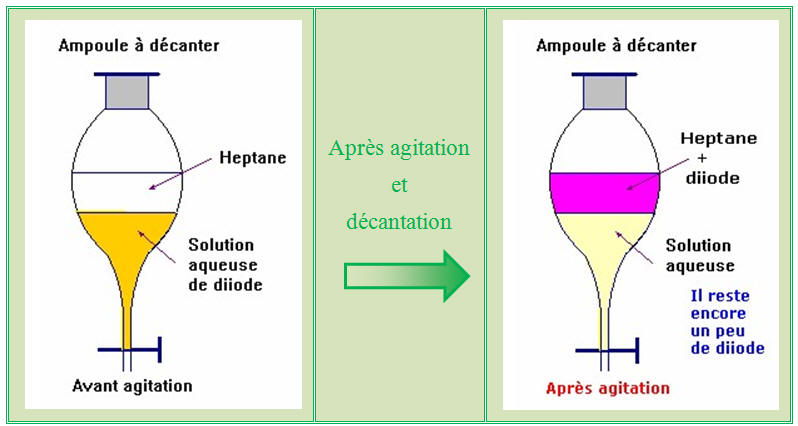
Ampoule à décanter :
-
Expérience :
extraction du
diiode présent dans une solution.

-
Lorsque deux liquides ne sont pas
miscibles, le liquide qui surnage est celui dont la densité est
la plus faible.
►
Identification de l’espèce
chimique synthétisée :
-
Il est nécessaire de vérifier la
présence de l’espèce attendue ainsi que son degré de pureté.
-
La caractérisation de l’espèce
chimique peut se faire grâce à ses propriétés physiques :
-
Aspect,
-
Solubilité,
-
Température d’ébullition,
température de fusion (si l’espèce obtenue est à l’état solide),
-
Densité,
-
Indice de réfraction…
-
On peut effectuer une analyse
comparative :
-
On peut réaliser une
chromatographie sur couche mince (C.C.M) :
-
De l’espèce
synthétique,
-
De l’espèce de
référence,
-
D’un extrait naturel
contenant la même espèce chimique.
-
Il faut ensuite
comparer la position des différentes taches du chromatogramme
obtenu.
- Remarque : Une espèce chimique d’origine naturelle est identique à l’espèce chimique obtenue par synthèse.
- Rien ne permet de les différencier.
►
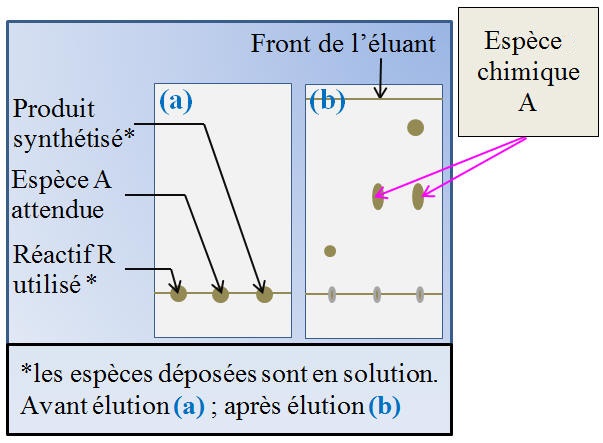
Étude du chromatogramme :
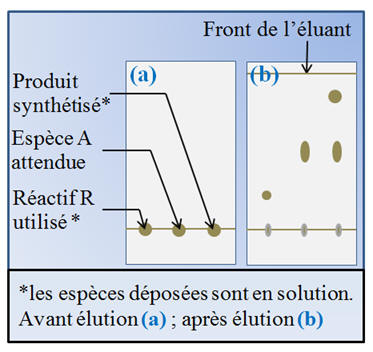
-
Le produit synthétisé n’est pas
pur.
-
On est en présence d’un mélange
de deux espèces chimiques car on observe deux taches.
-
La première tache, du produit
synthétisé, se situe au même niveau que celle du dépôt de
l’espèce chimique A.
-
Le produit synthétisé contient
bien l’espèce A.
-
Le produit synthétisé ne contient
pas le réactif R.
-
Il n’y a pas de tache au même
niveau que celle du dépôt du réactif
R.
|
|