|
QCM N° 09 |
Les Solutions |
|
|
Les
solutions
Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
Énoncé |
A |
B |
C |
R |
|
|
1 |
Dans
une solution aqueuse
de
diiode |
Le
soluté
est
l’eau |
Le
solvant
est
l’eau |
Le
soluté
est
le
diiode |
BC |
|
2 |
Une
solution aqueuse est
saturée lorsque : |
Le
soluté
est
totalement
dissous |
Il
reste
du
soluté
non
dissous |
Il y
a
autant de
soluté que
de
solvant |
B |
|
3 |
Unr
ampoule contient du
gluconate de magnésium
à 5,0
mg / L.
Cette
valeur est : |
Une
concentration
massique |
Une
concentration
molaire |
Une
masse
molaire |
A |
|
4 |
Une
solution de volume
0,10
L contient 0,50 g
de
saccharose dissous.
La
concentration
massique en saccharose
est :
|
0,50
g / L |
5,0 g
/ L |
50 g
/ L |
B |
|
5 |
Une
solution de volume
500
mL contient
500
mmol de saccharose.
La
concentration molaire
en
saccharose est : |
1,00
mol / L |
100
mol / L |
0,100
mol / L |
A |
|
6 |
Les
deux solutions de diiode ci-dessous ont
même
teinte
|
Elles
ont
la
même
concentration
molaire |
Elles
contiennent
la
même
quantité de
matière |
Elles
ont
la
même
concentration
massique |
AC |
|
7 |
La
verrerie ci-dessous est : |
Une
pipette
graduée |
Une
pipette
jaugée |
Une
fiole
jaugée |
B |
|
8 |
Pour
préparer 1,0 L d’une
solution de permanganate
de
potassium (solide de
masse
molaire 158 g / mol
à la
concentration molaire
0,10
mol / L, il faut peser
une
masse de : |
1,58
g |
15,8
g |
0,158
g |
B |
|
9 |
Une
solution mère de
concentration molaire
C0
= 2,0 mol / L est
diluée 5 fois.
La
concentration C1
de la
solution fille est : |
C1
≈ 10
mol / L |
C1
≈ 2,5
mol / L |
C1
≈
0,40 mol / L |
C |
|
10 |
Pour
diluer précisément
10
fois une solution mère,
on
peut utiliser : |
Une
fiole
jaugée de
100,0
mL et
une
pipette
jaugée de
10,0
mL |
Un
bécher
de
100 mL et
une
pipette
graduée de
10,0
mL |
Une
fiole
jaugée de
200,0
mL et
une
pipette
jaugée de
20,0
mL |
AC |
-
Un corps pur est constitué d’une
seule espèce chimique et peut être représenté par sa formule
chimique.
-
Un corps pur possède des
constantes physiques spécifiques : température de fusion,
température d’ébullition, masse volumique, indice de
réfraction,…
►
Mélange.
-
Un mélange est constitué
d’espèces chimiques différentes. Il ne peut pas être représenté
par une formule chimique.
-
Ainsi l’air est un mélange de
dioxygène O
2, de diazote N
2, l’argon Ar,…
-
On ne donne pas de formule
chimique à l’air. On peut donner la formule chimique des
constituants de l’air
►
Dissolution d’une espèce chimique :
-
Lorsqu’on dissout une espèce chimique dans un
liquide on obtient une solution.
-
L’espèce chimique dissoute est appelée le soluté.
-
Le liquide dans lequel on dissout l’espèce
chimique est appelé le solvant.
-
Si le solvant utilisé est l’eau, on obtient une
solution aqueuse.
-
Une espèce chimique est insoluble dans l’eau si on
la retrouve tel quelle et présence d’eau.
-
Une solution est saturée lorsque le soluté
introduit n’est pas totalement dissous.
-
Une solution dans laquelle après agitation, tout
le soluté solide introduit n’a pas disparu, est une solution
saturée.
►
Propriétés des solutions :
-
Une solution est un liquide homogène contenant
plusieurs constituants.
-
L’espèce chimique mise en solution peut être
constituée de :
-
Molécules (solide moléculaire, liquide ou gaz)
-
D’ions (solides ioniques).
-
Le soluté est ionique si la solution obtenue est
formée d’ions parmi des molécules d’eau.
-
Le soluté est moléculaire si la solution obtenue
contient des molécules de soluté (soluté moléculaire) et des
molécules d’eau.
-
Il se peut que le soluté moléculaire réagisse
partiellement avec l’eau pour donner des ions.
-
La solution aqueuse contient alors : des ions et
des molécules de soluté n’ayant pas réagi
►
En conclusion :
-
De manière générale, une solution aqueuse peut
contenir
-
des
molécules
-
des
ions
-
des
molécules et des ions.
►
Concentration massique ou titre massique :

►
Concentration molaire :
-
La concentration molaire d’une espèce chimique en
solution est la quantité de matière de soluté présente dans un
litre de solution.

►
Relation entre quantité de matière, masse, volume
et concentrations.

►
Relation liant la concentration massique et la
concentration molaire :
-
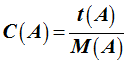
►
Dilution d’une solution aqueuse.
-
Principe de la dilution :

-
Lors d’une dilution, la concentration molaire du
soluté diminue, mais sa quantité de matière ne change pas.
-
On dit qu’au cours d’une dilution, la quantité de
matière de soluté se conserve.
-
Conséquence : 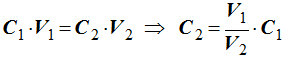
-
Avec les titres massiques :

-
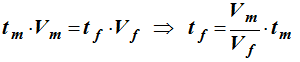
-
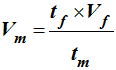
►
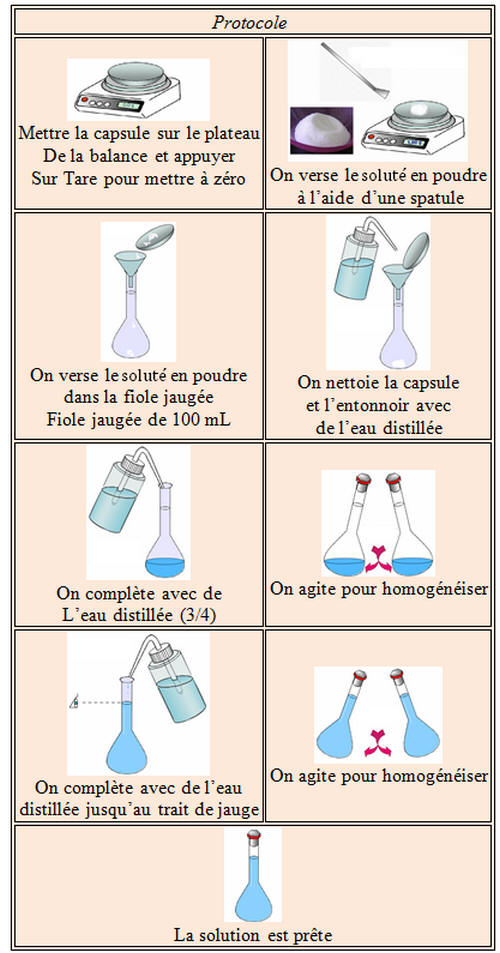
Préparation d’une solution à
partir d’un soluté solide :
►
Principe de la dilution : mode opératoire.
-
La masse volumique d’une espèce
chimique est égale au quotient de sa masse par son volume.
-
On écrit :

-
La densité des liquides et des
solides se mesure par rapport à l’eau.
-
La
densité des gaz se mesure par rapport à l’air.
-
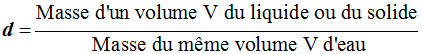
-
Relation : on écrit :

|
|