|
Sens d'évolution s pontanée d'un système chimique. |
|
|
|
|
|
|
QCM N°
07
Sens
d'évolution spontanée d'un système chimique.
La
transformation non totale.
L’évolution
spontanée d’un système
Le transfert
spontané d’électrons.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
On mélange 1
mol d’ions
fer II Fe2+
(aq) et 2 mol
d’ions argent
Ag+ (aq).
On obtient
0,80 mol
d’ions fer III
Fe3+ (aq).
Donnée :
Fe2+
(aq) + Ag+ (aq)
Fe3+ (aq)
+ Ag (s) |
La
transformation
est non totale |
La
transformation
est modélisée
par deux
réactions
opposées
l’une de l’autre. |
La
transformation
est totale |
AB |
|
2 |
Le taux d’avancement final de la réaction
décrite en
1.
vaut : |
|
|
τ
= 80 % |
AC |
|
3 |
À l’état
d’équilibre de la
transformation
décrite
en
1. :
|
vapp (Fe3+) =
vdisp (Fe3+) |
Microscopiquement
il n’y a plus
de réaction |
Le système
chimique
n’évolue plus |
AC |
|
4 |
Le quotient de
la
réaction Qr :
|
S’exprime en
mol . L–1 |
Dépend de
l’écriture de
l’équation de
la réaction |
Varie au
cours de la
transformation |
BC |
|
5 |
Soit
l’équation : Cu2+ (aq) + 2 Ag (s)
Cu
(s) + 2 Ag+ (aq)
Le quotient de
réaction
associé
s’écrit : |
|
|
|
B |
|
6 |
Soit
l’équation : CH3CO2H (aq)
+ H2O (ℓ)
CH3CO2– (aq)
+ H3O+ (aq)
À 25 ° C, la
constante
d’équilibre
associée
est K = 6,3 × 104.
Le quotient de
réaction
à l’état
initial Qr,i d’un
système est
égal à
3,0 × 105. |
La
transformation
évolue dans
le sens direct
de l’équation. |
La
transformation
évolue dans
le sens inverse
de l’équation. |
La
transformation
n’évolue pas
car l’état
d’équilibre est
atteint.
|
B |
|
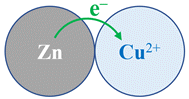
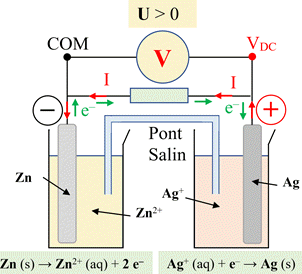
7 |
Lors de son
fonctionnement,
la pile
décrite ci-dessous : |
Évolue par
transfert
direct
des électrons
entre ses
réactifs. |
Évolue vers
un état
d’équilibre. |
Évolue par
transfert
indirect
d’électrons |
BC |
|
8 |
Dans la pile
décrite en 7.,
les électrons
circulent : |
De l’électrode
de zinc vers
l’électrode
d’argent |
De l’électrode
d’argent vers
l’électrode
de zinc. |
Dans les
solutions |
A |
|
9 |
Pour la pile
décrite en 7.,
l’équation de
la réaction
électrochimique s’écrit : |
Zn2+
(aq) + 2 e–
→ Zn
(s)
Sur
l’électrode
de zinc |
Zn
(s) →
Zn2+
(aq) + 2 e–
Sur
l’électrode
de zinc |
Ag+
(aq) + e–
→ Ag
(s) Sur
l’électrode
d’argent |
BC |
|
10 |
L’équation de
la réaction
de
fonctionnement de la
pile décrite
en 7.
est : |
Zn2+ (aq)
+ 2 Ag (s)
→ Zn (s)
+ 2 Ag+ (aq) |
Zn (s)
+ 2 Ag+ (aq)
→ Zn2+ (aq)
+ 2 Ag (s) |
2 Zn (s)
+ Ag+ (aq)
→ 2 Zn2+ (aq)
+ Ag (s) |
B |
|
11 |
Un réducteur
usuel
peut être du :
|
Dioxygène
O2
(g) |
Dihydrogène
H2 (g) |
Dichlore
Cℓ2
(g) |
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Transformation totale :
Transformation non totale :
|
Transformations totales et non totales :
Comparaison entre
xf et
xmax :
- Si xf = xmax
, alors la transformation est totale.
- Si xf
< xmax , alors la transformation est non totale. |
a A + b B
![]() c
C + d D
c
C + d D
►
Exemple :
|
Équation |
Fe2+
(aq) |
+
Ag+ (aq) |
|
Fe3+
(aq) |
+
Ag (s) |
|
|
État |
Avancement |
n
(Fe2+) |
n
(Ag+) |
|
n
(Fe3+) |
n
(Ag) |
|
État initial
(mol) |
0 |
ni
(Fe2+) ≈ 1 |
ni
(Ag+) ≈ 2 |
|
0 |
0 |
|
État
Intermédiaire
(mol |
x |
1
– x |
2
– x |
|
x |
x |
|
État
final
(mol) |
xf
= 0,80 |
1
– xf =
0,20 |
2
– xf =
1,8 |
|
xf =
0,80 |
xf =
0 ,80 |
|
État
maximal
(mol) |
xmax
= 1 |
0 |
1 |
|
1 |
1 |
Notion d’équilibre dynamique :
►
Échelle microscopique :
►
Échelle macroscopique :
Taux d’avancement final.
|
|
|
|
τ
(tau) |
Taux d’avancement
final (sans unité) |
|
xf |
Avancement final
(mol) |
|
xmax |
Avancement
maximal (mol) |
Quotient de réaction Qr.
a
. A (aq)
+
b . B
(aq)
![]() c
. C (aq)
+
d . D
(aq)
c
. C (aq)
+
d . D
(aq)
|
|
|
|
Qr
|
Quotient de
réaction (sans unité) |
|
[C]
et [D] |
Concentration des
produits (mol . L–1) |
|
[A]
et
[B] |
Concentration des
réactifs (mol . L–1) |
|
C0 |
Concentration
standard : C0 =
1,0 mol . L–1 |
►
Remarque :
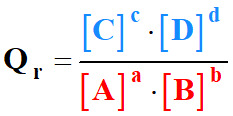
Constante d’équilibre K.
K = Qr,éq
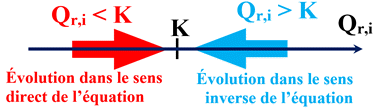
Prévision du sens de l’évolution spontanée.
|
|
|
|
Sens direct
|
|
|
|
|
a A
(aq) |
+ |
b B
(aq) |
|
c C
(aq) |
+ |
d D
(aq) |
|
|
|
|
Sens inverse
|
|
|
|
►
Si le quotient de réaction initial Qr,i
est inférieur à la constante d’équilibre K,
►
Si le quotient de réaction initial Qr,i
est supérieur à la constante d’équilibre K,
Transfert spontanée d’électrons :
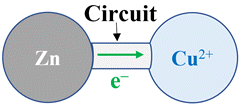
Constitution d’une pile :
►
Schéma d’une pile :
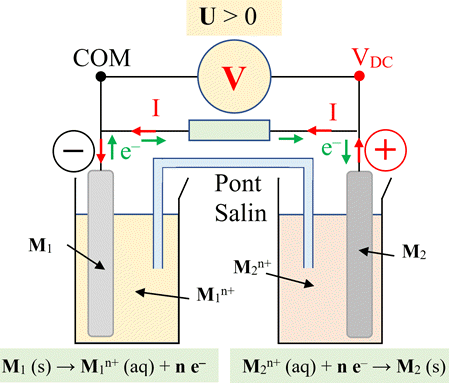
►
Remarque :
Rôle du pont salin.
Capacité électrique d’une pile :
|
Qmax
= n (e–)max . NA
. e |
|
|
Qmax |
Capacité électrique de la pile
(coulomb : C) |
|
n
(e–)max |
Quantité maximale d’électrons
échangés (mol) |
|
NA |
Nombre d’Avogadro (mol–1) NA = 6,02 × 1023
mol–1 |
| e |
Charge élémentaire (coulomb : C) e = 1,60 × 10–19 C |
►
Remarque :
Les oxydants et les réducteurs usuels.
►
Les réducteurs :
►
Les oxydants :
|
Espèces oxydante |
Nom de l’espèce |
Milieu |
|
O2
(g) |
Dioxygène |
Air |
|
CℓO–
(aq) |
Ion hypochlorite |
Eau de Javel |
|
Cℓ2
(g) |
Dichlore |
|
|
|